1. 领域背景与文献引入
文献英文标题:MRI-based radiomic prognostic signature for locally advanced oral cavity squamous cell carcinoma: development, testing and comparison with genomic prognostic signatures;发表期刊:Biomarker Research;影响因子:未公开;研究领域:头颈部肿瘤(口腔鳞状细胞癌)预后预测、放射组学
口腔鳞状细胞癌(OCSCC)是头颈部鳞状细胞癌(HNSCC)最常见的亚型,占比约50%,局部晚期患者的标准治疗方案为手术联合辅助放化疗,但患者预后差异显著。当前临床预后预测主要依赖TNM分期系统,然而该系统存在明显局限性:术前仅能通过临床TNM(cTNM)评估,准确性有限;术后病理TNM(pTNM)虽更精准,但无法用于术前治疗决策。2000年后组学技术逐渐应用于HNSCC预后预测,基因组学方面,基于TCGA数据库的基因表达特征陆续出现,但这类检测需侵入性组织样本,且多针对HNSCC整体队列,OCSCC特异性模型较少;放射组学方面,早期研究多基于CT、PET成像,近年MRI放射组学因软组织分辨率高的优势逐渐受到关注,但针对OCSCC的特异性MRI放射组学预后模型仅3项,且多为单中心回顾性研究,缺乏多中心前瞻性验证,同时未与基因组学模型直接对比,临床应用价值不明确。
针对OCSCC术前预后预测工具匮乏、现有模型验证不足的核心问题,本研究构建并验证了基于常规T1/T2加权MRI的放射组学预后特征,对比其与TNM分期及已发表基因组预后特征的性能,旨在为OCSCC提供非侵入性、高性价比的术前预后分层工具,推动个体化治疗决策。
2. 文献综述解析
本研究综述部分按技术类型(基因组学、放射组学)分类评述OCSCC/HNSCC预后预测研究,核心逻辑为梳理不同技术的发展现状、优势与局限性,明确当前研究空白,为自身研究的必要性提供依据。
基因组学预后研究方面,2010年后基于TCGA数据库的基因表达特征陆续被开发,可用于HNSCC患者的预后分层,但这类研究存在诸多局限性:多数模型基于HNSCC整体队列构建,针对OCSCC特异性的模型较少;检测需获取肿瘤组织样本,侵入性强,且成本较高,临床推广难度大;部分模型虽在内部队列中表现出良好性能,但在外部独立队列中的预后分层能力差异显著,稳定性不足。放射组学预后研究方面,早期多基于CT、PET成像,在HNSCC预后预测中展现出一定价值,但MRI放射组学研究起步较晚,针对OCSCC的研究仅3项,且均为单中心回顾性研究,缺乏多中心前瞻性验证,结果的外推性有限;同时现有MRI放射组学模型未与基因组学模型进行直接对比,无法明确其在临床预后预测中的相对优势。
本研究的创新价值在于,首次通过多中心回顾性+前瞻性队列验证了OCSCC特异性MRI放射组学预后特征,直接对比其与TNM分期及7项已发表基因组预后特征的性能,证明其在预后分层上的显著优势,填补了OCSCC非侵入性术前预后模型多中心验证及与基因组学模型对比的研究空白,为临床提供了更易推广的预后评估工具。
3. 研究思路总结与详细解析
本研究的核心目标是构建并验证基于MRI的OCSCC放射组学预后特征,明确其在总生存期(OS)预测中的价值,并对比其与现有TNM分期及基因组预后特征的性能;核心科学问题为MRI放射组学特征能否有效预测OCSCC患者OS,且性能优于现有临床及基因组学预后工具;技术路线遵循“数据集构建→图像预处理与特征提取→特征筛选与模型构建→回顾性验证→前瞻性验证→性能对比”的闭环逻辑。
3.1 多中心数据集构建与临床终点定义
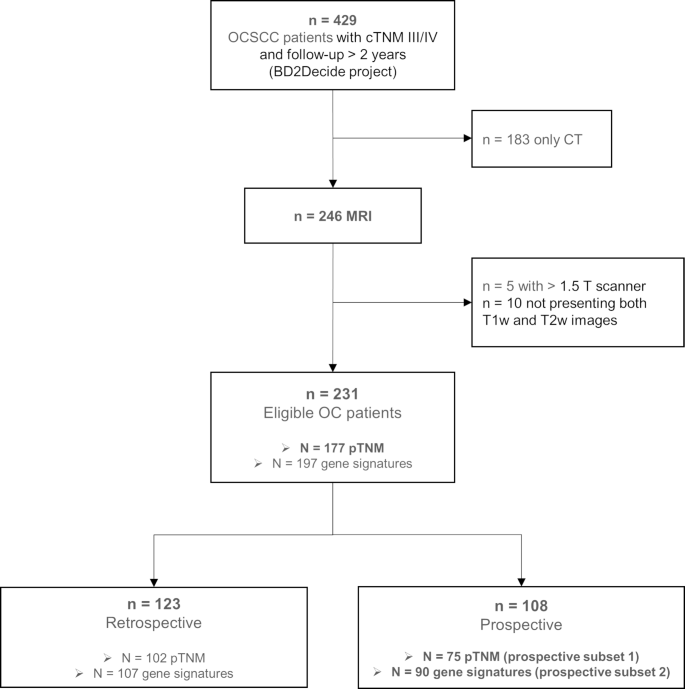
实验目的是构建具有代表性的OCSCC多中心数据集,明确研究的核心临床终点。研究从BD2Decide数据库中纳入231例局部晚期OCSCC患者,分为回顾性队列(n=123)和前瞻性队列(n=108),纳入标准为患者具有T1/T2加权MRI图像且由1.5T扫描仪获取;临床终点定义为总生存期(OS),即从初诊至患者死亡或末次随访的时间。结果显示,回顾性队列与前瞻性队列在随访时间、疾病分期、吸烟状态上存在差异(前瞻性队列IVa/b期占比更高、吸烟比例更高),但均符合局部晚期OCSCC的纳入标准,为模型的构建与验证提供了多样化的样本基础。
文献未提及具体实验产品,领域常规使用MRI扫描仪(1.5T)、图像存储与管理系统等。
3.2 MRI图像预处理与放射组学特征提取
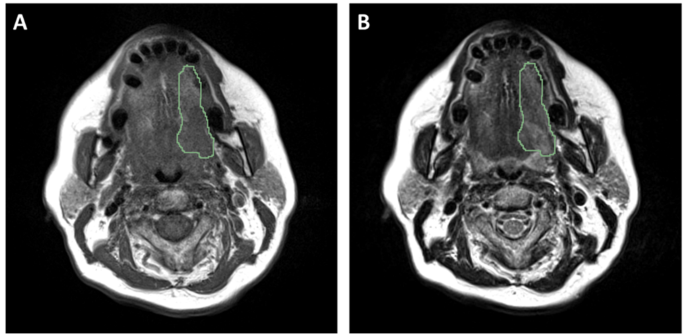
实验目的是标准化MRI图像,减少成像异质性,提取可重复的放射组学特征。研究对T1/T2加权MRI图像进行多步骤预处理:采用3D高斯滤波去噪,N4ITK算法校正磁场不均匀性,Z-score法进行强度标准化,最后将体素重采样至2mm各向同性分辨率;使用Pyradiomics工具从预处理后的图像中提取1072项放射组学特征(T1、T2加权各536项),涵盖形状大小、一阶统计、纹理、小波变换等多个类别。预处理步骤有效降低了不同中心、不同扫描参数导致的图像异质性,提取的特征覆盖了肿瘤的形态、纹理等多维度信息,为后续特征筛选提供了丰富的数据基础。
实验所用关键产品:Pyradiomics 2.2.0(开源放射组学工具)、Matlab 2022a(数据处理软件)。
3.3 放射组学特征筛选与预后模型构建
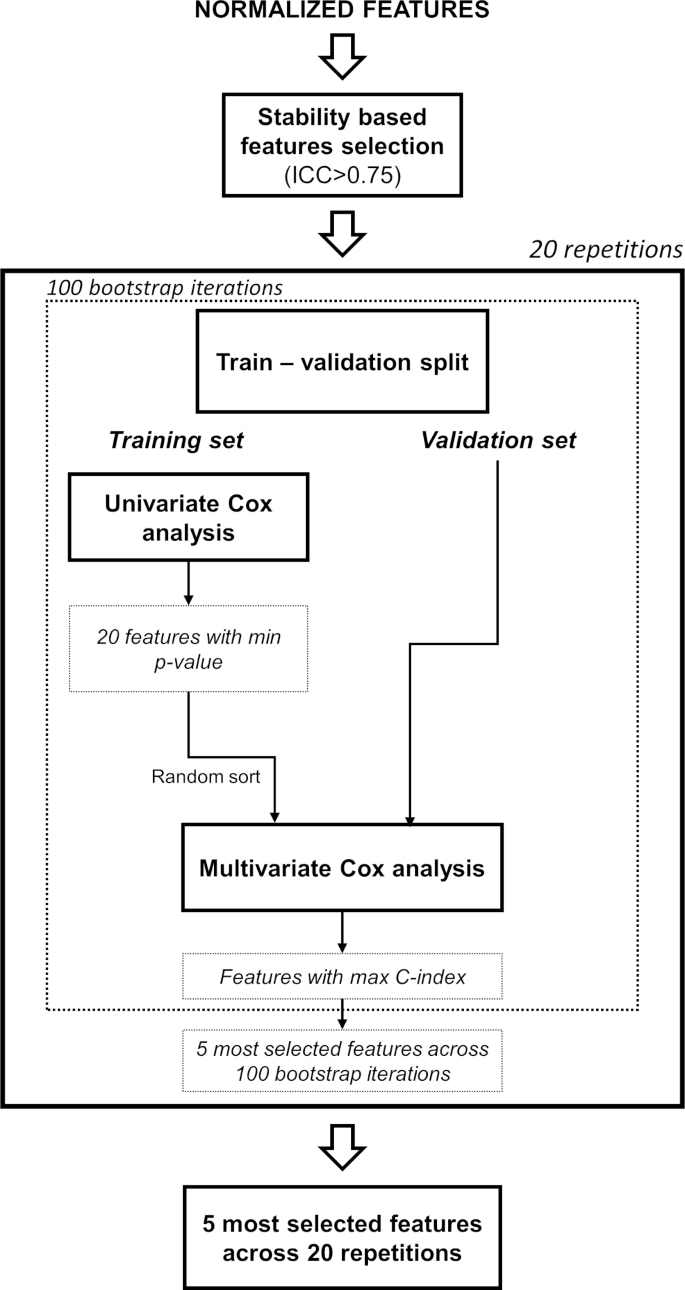
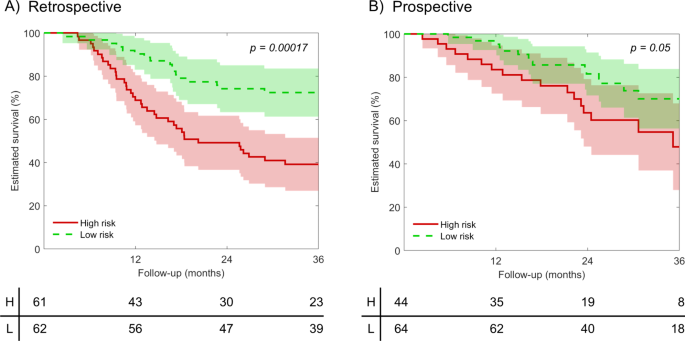
实验目的是筛选具有预后价值的稳定放射组学特征,构建Cox比例风险回归模型。研究首先对提取的特征进行稳定性分析,保留组内相关系数(ICC)>0.75的222项稳定特征;随后通过100次bootstrap迭代的单变量+多变量Cox回归筛选特征,最终选取5项特征构建预后模型;以回顾性队列中特征的中位数为阈值,将患者分为高/低风险组。最终筛选的5项特征均来自T2加权图像的小波LLL变换,包括4项纹理特征和1项一阶统计特征;构建的模型在回顾性队列中表现出显著的预后价值:C指数为0.68(IQR 0.66-0.70),风险比(HR)为2.64(95%CI 1.62-4.31),高/低风险组OS差异显著(log-rank p<0.001)。
文献未提及具体实验产品,领域常规使用统计分析软件(如Matlab、R)进行特征筛选与模型构建。
3.4 模型前瞻性验证与性能对比
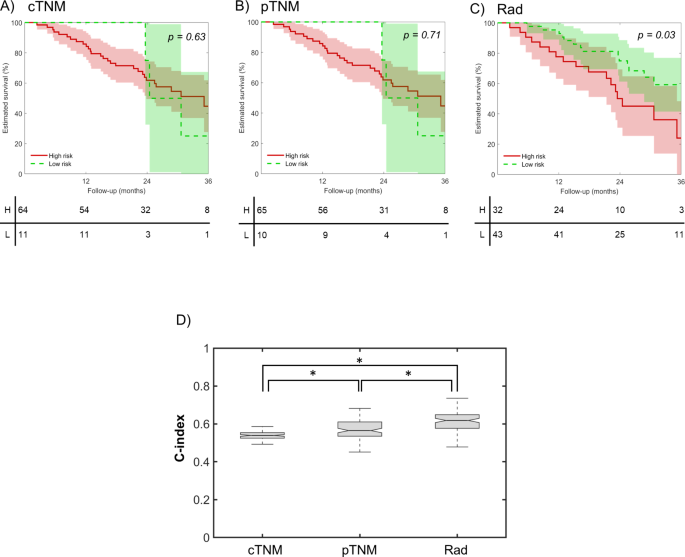
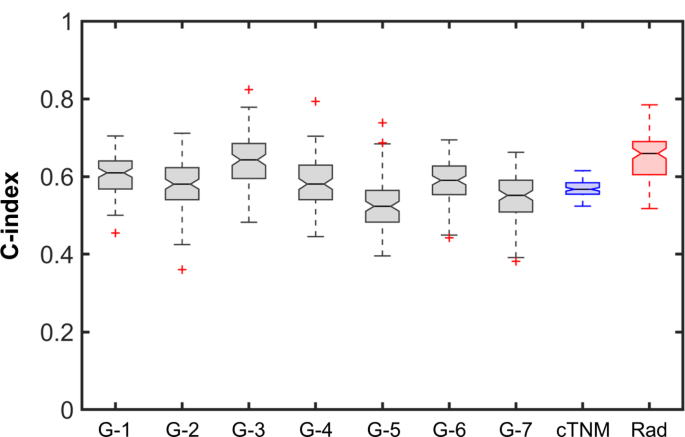
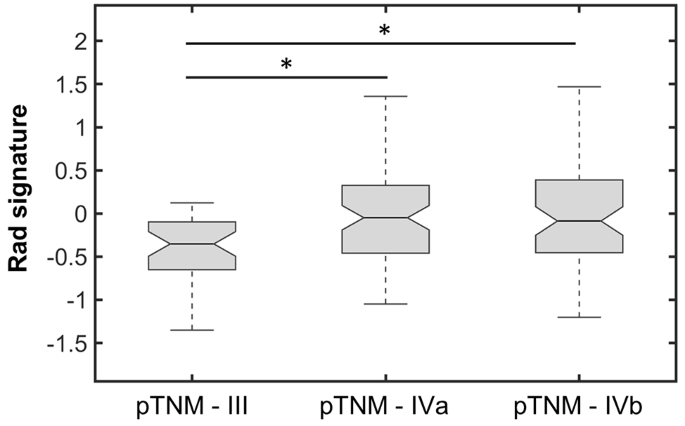
实验目的是验证模型在独立队列中的性能,并对比其与TNM分期、基因组预后特征的预后价值。研究将构建的模型应用于前瞻性队列(n=108),计算C指数、HR及高/低风险组OS差异;分别在75例患者中对比模型与cTNM、pTNM的性能,在90例患者中对比模型与7项已发表基因组预后特征的性能;同时分析模型与pTNM分期的相关性。结果显示,模型在前瞻性队列中C指数为0.62(IQR 0.58-0.64),HR为2.12(95%CI 1.04-4.47),高/低风险组OS差异显著(log-rank p=0.05);模型性能优于cTNM、pTNM分期,且优于7项基因组特征中的6项,仅与1项基因组特征性能相当;模型在pTNM III期与IVa/b期患者中存在显著差异,提示其可辅助术前预测病理分期。
实验所用关键产品:Qiagen RNeasy Mini Kit(RNA提取试剂盒)、Affymetrix human Clariom D arrays(基因表达芯片)。
4. Biomarker研究及发现成果解析
本研究开发的Biomarker是基于T1/T2加权MRI的放射组学预后特征,由5项T2加权图像小波LLL变换特征组成。其筛选逻辑为:多中心OCSCC患者数据集图像预处理→放射组学特征提取→稳定性分析筛选可重复特征→单变量+多变量Cox回归筛选与OS相关的特征→构建Cox比例风险回归模型;验证逻辑为:回顾性队列构建并初步验证模型→前瞻性独立队列验证模型预后性能→与现有临床TNM分期及基因组预后特征对比性能。
该Biomarker来源于OCSCC患者的术前T1/T2加权MRI图像,验证方法包括:在回顾性队列(n=123)中通过Cox回归模型验证其与OS的相关性,在前瞻性队列(n=108)中验证其预后分层能力,同时对比其与TNM分期、基因组特征的预后价值。特异性与敏感性数据方面,回顾性队列中模型的C指数为0.68(IQR 0.66-0.70),前瞻性队列中为0.62(IQR 0.58-0.64);高/低风险组分层的log-rank p值在回顾性队列中<0.001,前瞻性队列中=0.05,提示模型具有稳定的预后分层能力。
核心成果方面,该放射组学特征可独立预测OCSCC患者OS,回顾性队列中HR为2.64(95%CI 1.62-4.31,n=123,p<0.001),前瞻性队列中HR为2.12(95%CI 1.04-4.47,n=108,p=0.05);其创新性在于首次通过多中心前瞻性队列验证了OCSCC特异性MRI放射组学预后特征,且证明其性能优于常规TNM分期及多数已发表基因组预后特征;此外,该特征与pTNM分期独立相关,提示其可用于术前预测病理分期,为个体化治疗方案的制定提供参考。
