1. 领域背景与文献引入
文献英文标题:Microfluidic biosensors for biomarker detection in body fluids: a key approach for early cancer diagnosis;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤早期诊断、微流控生物传感器、液体活检生物标志物。
全球癌症发病率与死亡率逐年攀升,早期诊断是降低癌症致死率的核心干预手段——已有研究数据显示,乳腺癌常规筛查可使女性死亡率降低约40%,肺癌早期筛查可降低20%死亡率,食管癌早期诊断治疗可降低30%-60%死亡率,前列腺癌通过前列腺特异性抗原(PSA)筛查可降低21%死亡率。当前癌症诊断体系中,病理诊断为金标准,但依赖可见肿瘤病灶的影像学评估;液体活检技术如聚合酶链式反应(PCR)、质谱分析等虽实现了非侵入性检测,但存在样本预处理复杂、成本高昂、难以检测早期癌症低浓度纳米级生物标志物的局限性。为突破上述瓶颈,微流控技术凭借微尺度流体操控带来的高灵敏度、高特异性、样本用量少等优势,成为液体活检优化的核心方向。本文旨在系统综述2018-2024年微流控生物传感器在癌症早期诊断中的研究进展,涵盖其工作原理、制备技术、纳米材料整合策略及临床转化潜力,同时探讨人工智能(AI)与微流控技术结合的未来应用方向,为该领域的后续研究及临床应用提供全面指导。
2. 文献综述解析
本文综述部分以“微流控技术-生物标志物-检测方法”的三维框架为分类维度,系统梳理了癌症早期诊断领域中微流控生物传感器的研究进展,明确了现有技术的优势、局限性及未来发展方向。
在制备技术层面,现有研究涵盖光刻、注塑成型、激光烧蚀、3D打印、软光刻等多种微流控芯片制备方法,其中光刻技术具备微米级高精度,但依赖洁净室环境且生产效率较低;3D打印技术可实现复杂结构的快速定制化制备,但当前分辨率仍难以满足纳米级结构需求;软光刻技术适合弹性材料如聚二甲基硅氧烷(PDMS)的微结构制备,是当前实验室研究的主流方法,但存在多步骤操作导致的效率低下问题。在生物标志物层面,现有研究聚焦于蛋白类标志物(如癌胚抗原CEA、前列腺特异性抗原PSA)、核酸类标志物(如微小RNA miRNA、循环肿瘤DNA ctDNA)、细胞类标志物(如循环肿瘤细胞CTCs)及外泌体(sEVs)等,各类标志物具备不同的诊断潜力——蛋白标志物临床应用成熟但特异性不足,微小RNA稳定性高适合非侵入检测,循环肿瘤细胞可反映肿瘤转移潜力但早期含量极低。在检测方法层面,现有研究将微流控技术与电化学传感、表面增强拉曼光谱(SERS)、磁富集、酶联免疫吸附试验(ELISA)等技术结合,其中电化学传感器实现了快速定量检测,表面增强拉曼光谱技术可提供分子水平的结构信息,磁富集技术能高效分离低丰度标志物,酶联免疫吸附试验技术适合多标志物联合检测。现有研究的局限性主要体现在:微流控与纳米材料整合的规模化生产一致性不足,AI与微流控结合的临床验证数据匮乏,单一生物标志物诊断的特异性难以满足临床需求。
相较于领域内已有的综述,本文首次系统整合了2018-2024年微流控生物传感器在制备技术、生物标志物检测、多技术整合等方面的最新进展,重点突出了纳米材料对传感器性能的提升作用,以及AI技术在微流控生物传感器数据分析中的应用前景;同时,本文强调了多标志物联合检测在提升早期癌症诊断特异性中的核心作用,填补了该领域近期综述在多维度整合分析及未来方向预判上的空白,为临床转化提供了更具针对性的指导。
3. 研究思路总结与详细解析
本文为系统性综述研究,核心目标是全面梳理微流控生物传感器在癌症早期诊断中的研究进展与临床转化潜力,核心科学问题是如何通过微流控技术的优化与多技术整合,突破早期癌症低浓度生物标志物检测的瓶颈,技术路线遵循“领域背景引入→核心技术原理与制备方法解析→关键生物标志物分类梳理→多技术整合实例分析→挑战与未来方向预判”的逻辑闭环。
3.1 微流控生物传感器原理与制备技术解析
实验目的:明确微流控生物传感器的核心优势及制备技术的发展现状与应用场景;方法:系统梳理微流控技术的工作原理(微尺度流体操控,结合纳米材料的高比表面积特性提升生物标志物捕获与信号放大效率),并分类总结各类制备技术的操作流程、性能特点及适用场景;结果解读:微流控生物传感器的核心优势包括样本用量少、检测速度快、便携性强、高通量分析及低污染等(图1),可实现早期癌症低浓度生物标志物的精准检测;制备技术中,软光刻技术适合实验室高精度微结构的定制化制备,3D打印技术为复杂结构的快速原型开发提供了可能,纸基微流控材料则适合基层医疗场景的低成本检测;不同制备技术的优缺点对比为特定应用场景的技术选择提供了依据;产品关联:文献中提及的关键制备材料包括硅、玻璃、PDMS、纸基材料等,关键纳米材料包括金纳米颗粒(AuNPs)、银纳米立方体(AgNCs)、量子点(QDs)等,未明确标注具体品牌及货号,领域常规使用康宁的玻璃基板、道康宁的PDMS材料、Sigma-Aldrich的纳米颗粒试剂等。
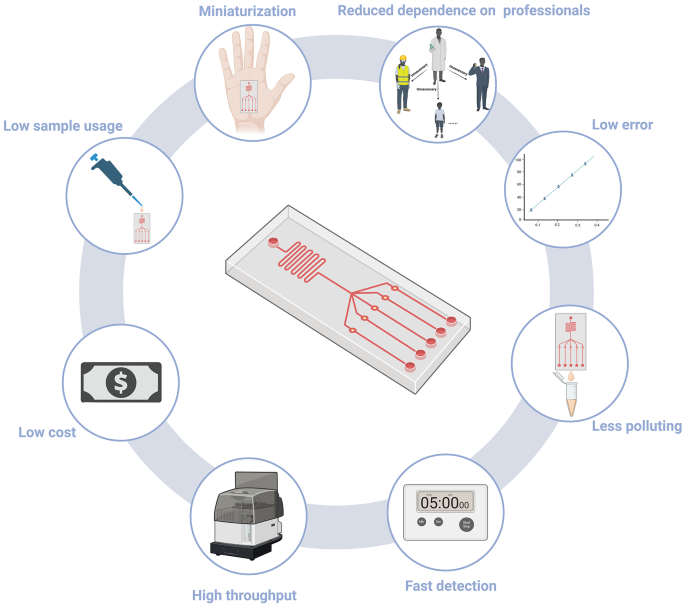
3.2 核心癌症生物标志物分类与检测需求解析
实验目的:梳理适合早期癌症诊断的生物标志物类型、特点及检测挑战;方法:分类整理蛋白类、核酸类、细胞类、外泌体及其他类型生物标志物的来源、生物学功能及检测需求;结果解读:蛋白类生物标志物如癌胚抗原、前列腺特异性抗原等临床应用广泛,但在非癌症疾病中也可能出现异常升高,特异性不足;微小RNA具备极强的稳定性,可在血浆、血清等体液中稳定存在,适合非侵入性早期检测;循环肿瘤细胞是肿瘤转移的“种子”,但其在早期癌症患者外周血中的含量极低(每毫升血液中仅数个),检测难度大;循环肿瘤DNA携带肿瘤特异性突变信息,可反映肿瘤的遗传异质性,但早期浓度极低;多标志物联合检测可有效提升诊断的特异性与准确性,如同时检测CA-125、EpCAM、CD24三种外泌体标志物可显著提升卵巢癌的诊断准确性;产品关联:文献中提及的检测试剂包括抗癌胚抗原抗体、抗前列腺特异性抗原抗体、微小RNA捕获探针等,未明确标注具体品牌及货号,领域常规使用Abcam的抗体试剂、Thermo Fisher的核酸检测试剂等。
3.3 多技术整合的微流控生物传感器实例分析
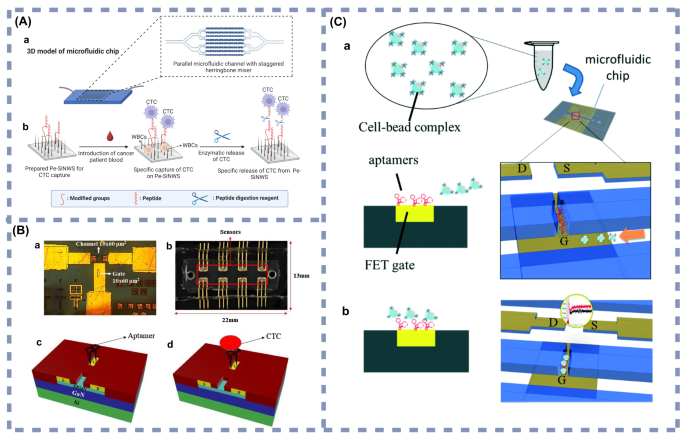
实验目的:总结近年微流控技术与不同检测方法结合的应用进展及临床潜力;方法:分类整理电化学传感、表面增强拉曼光谱、磁富集、酶联免疫吸附试验与微流控结合的典型研究实例,分析其检测性能与临床应用场景;结果解读:电化学微流控传感器方面,Prathap等开发的黑色素瘤循环肿瘤细胞检测系统,通过孔径筛选结合抗Melanocortin 1受体(MC1R)抗体修饰的电化学电极,实现了10细胞/10mL的检测限(图3A),适合黑色素瘤的早期筛查与复发监测;表面增强拉曼光谱微流控传感器方面,Gu等开发的双标志物检测系统,基于Au@SiO₂阵列基底的“热点”效应,实现了鳞状细胞癌抗原(SCCA)(0.37pg/mL)与癌胚抗原(0.28pg/mL)的超灵敏检测(图4A),适合鳞状细胞癌等多种癌症的早期诊断;磁富集微流控传感器方面,Liu等开发的乳腺癌外泌体检测系统,通过免疫磁珠捕获结合液滴微流控技术,实现了10个/μL的检测限(图5A),适合乳腺癌的早期检测与动态监测;酶联免疫吸附试验微流控传感器方面,Shen等开发的胰腺癌循环肿瘤细胞捕获系统,通过肽修饰的硅纳米线实现了95.6%的循环肿瘤细胞捕获效率与92.6%的细胞释放效率(图6A),适合胰腺癌的早期筛查与活细胞分析;产品关联:文献中提及的关键产品包括聚苯胺(PANI)纳米纤维修饰的丝网印刷电极(SPE)、免疫磁珠、核酸适配体等,未明确标注具体品牌及货号,领域常规使用Bio-Rad的丝网印刷电极、Thermo Fisher的免疫磁珠等。
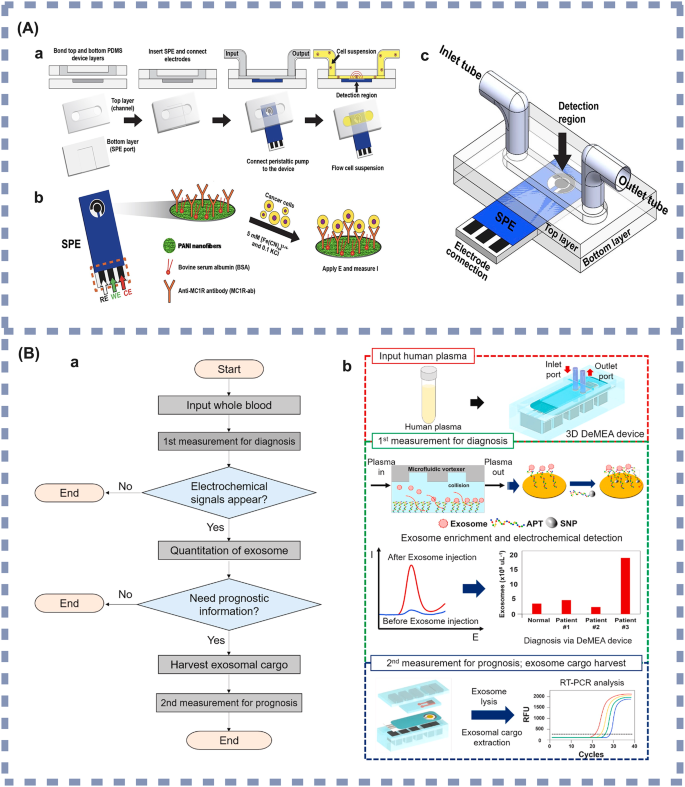
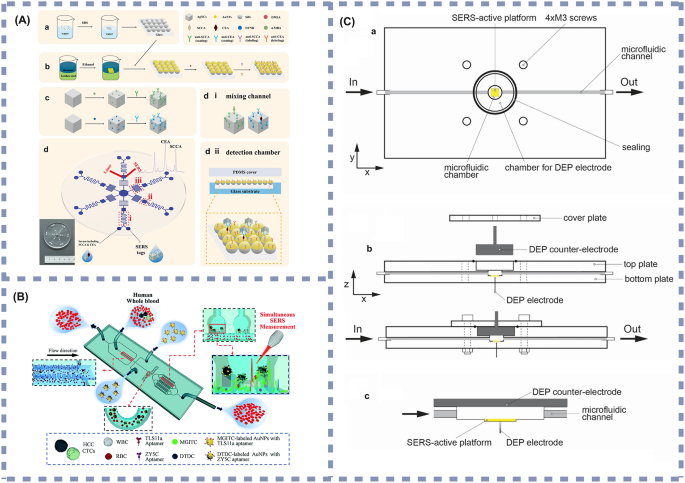
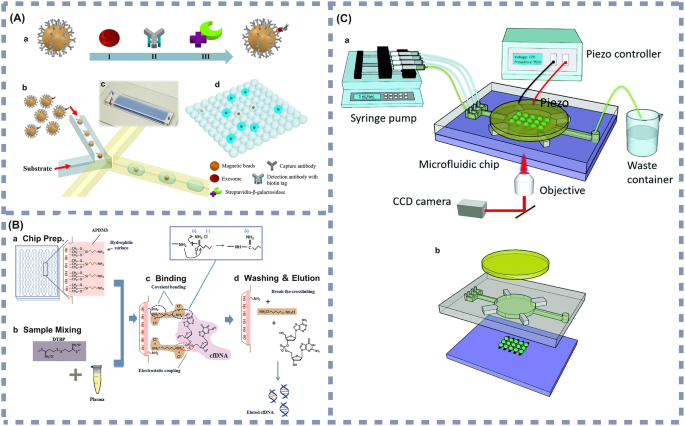
3.4 临床转化挑战与未来方向探讨
实验目的:分析微流控生物传感器临床应用的核心挑战及未来发展方向;方法:梳理现有研究的局限性,结合AI技术、个性化医疗的发展趋势,预判微流控生物传感器的未来应用场景;结果解读:当前微流控生物传感器临床转化的核心挑战包括规模化生产的一致性控制、成本降低、临床验证数据不足等;未来发展方向包括:多标志物联合检测系统的开发,提升诊断特异性;AI与微流控技术的深度整合,实现智能数据分析与诊断;便携化即时检测设备的开发,适合基层医疗场景应用;产品关联:文献提及AI与微流控结合的潜在应用,未涉及具体产品,领域常规使用TensorFlow、PyTorch等AI框架进行生物标志物数据分析。
4. Biomarker研究及发现成果解析
本文系统梳理了适合早期癌症诊断的多类生物标志物,明确了各类标志物的检测逻辑、性能数据及临床应用潜力,为早期癌症诊断的生物标志物选择与检测技术开发提供了全面指导。
文献中涉及的Biomarker包括蛋白类(癌胚抗原、前列腺特异性抗原、鳞状细胞癌抗原、EpCAM、MC1R等)、核酸类(微小RNA、循环肿瘤DNA)、细胞类(循环肿瘤细胞)、外泌体及其他类型(端粒酶、挥发性有机化合物VOCs);筛选与验证逻辑遵循“临床需求导向→实验室技术验证→临床样本验证”的链条:首先基于早期癌症诊断的需求筛选具备潜在特异性的标志物,然后通过微流控结合不同检测技术提升检测灵敏度,部分标志物已通过临床样本验证其诊断价值。
蛋白类Biomarker主要来源于血清、血浆样本,验证方法包括电化学免疫传感、表面增强拉曼光谱免疫检测等,其中鳞状细胞癌抗原的检测限为0.37pg/mL(文献未明确样本量及P值),癌胚抗原的检测限为0.28pg/mL(文献未明确样本量及P值);核酸类Biomarker中,微小RNA来源于血浆、血清样本,通过核酸杂交结合微流控技术实现检测,其稳定性强可耐受温度与pH波动;循环肿瘤DNA来源于血浆样本,通过微流控结合数字液滴PCR(ddPCR)或下一代测序(NGS)实现检测,可反映肿瘤的特异性突变;细胞类Biomarker循环肿瘤细胞来源于外周血样本,通过免疫捕获或尺寸筛选结合微流控技术实现检测,黑色素瘤循环肿瘤细胞检测限为10细胞/10mL(n=3,文献未明确提供P值);外泌体来源于血浆样本,通过免疫磁珠捕获结合微流控技术实现检测,乳腺癌外泌体检测限为10个/μL(n=3,文献未明确提供P值);其他类型Biomarker中,端粒酶可通过Telomeric Repeat Amplification Protocol方法检测,挥发性有机化合物可通过代谢组学方法检测,但当前特异性仍需提升。
本文的核心成果在于系统整合了多类Biomarker的检测进展,明确了多标志物联合检测是提升早期癌症诊断特异性的关键策略——如Zhao等开发的ExoSearch芯片通过同时检测CA-125、EpCAM、CD24三种外泌体标志物,显著提升了卵巢癌的诊断准确性;创新性在于首次重点讨论了AI技术在微流控生物传感器Biomarker数据分析中的应用前景,为智能诊断系统的开发提供了方向;统计学结果方面,部分研究提供了检测限数据,如黑色素瘤循环肿瘤细胞检测限10细胞/10mL(n=3),乳腺癌外泌体检测限10个/μL(n=3),未明确标注P值等统计学显著性结果。
