1. 领域背景与文献引入
文献英文标题:Molecular landscape and targeted therapy of acute myeloid leukemia;发表期刊:Biomarker Research;影响因子:未公开;研究领域:急性髓系白血病(AML)分子分型与精准靶向治疗
急性髓系白血病是一类高度异质性的造血系统恶性肿瘤,传统诊断与风险分层主要依赖细胞遗传学检测。1970年代起,染色体核型分析成为AML预后分层的核心依据,t(8;21)、inv(16)等重现性染色体易位被定义为低危亚型,为临床治疗决策提供了基础。2010年后,下一代测序(NGS)技术的普及推动AML研究进入分子分型时代,大量驱动突变如NPM1、FLT3、IDH1/2等被发现,成为精准治疗的核心靶点。当前研究热点集中于分子标志物驱动的风险分层优化、靶向药物的研发与联合治疗策略探索,但仍存在核心问题:AML基因组复杂性高,单一突变的预后价值受共突变影响显著,部分突变的靶向治疗耐药机制尚未明确,老年AML患者的精准治疗方案仍需完善。在此背景下,本综述系统整合了最新的大队列临床研究与临床试验数据,旨在全面梳理AML的分子图谱特征及对应靶向治疗进展,为临床风险分层与治疗决策提供依据,具有重要的学术指导价值。
2. 文献综述解析
本文综述以分子功能为核心分类维度,将AML驱动突变分为核磷蛋白家族、信号激酶通路、转录因子、表观修饰因子、RNA剪接因子、肿瘤抑制基因六大功能组,系统总结了各突变亚型的临床特征、预后价值及靶向治疗进展。
现有研究已明确,NPM1突变是成人AML中最常见的分子标志物之一,在正常核型AML中占比超50%,无FLT3-ITD共突变时具有良好预后;FLT3突变分为ITD与TKD两种类型,高等位基因比例的FLT3-ITD提示不良预后,一代与二代FLT3抑制剂的研发显著改善了这类患者的生存。现有研究的优势在于基于大样本队列明确了单一突变的预后趋势,局限性在于多数研究未充分考虑共突变对预后的修饰作用,部分靶向治疗的长期疗效与耐药数据仍不足。
本综述的创新价值在于整合了德国-奥地利AML研究组1540例患者的大队列数据,首次从宏观视角展示了AML的基因组复杂性,明确了共突变对各亚型预后的影响,同时梳理了最新的临床试验数据,包括新兴IDH抑制剂、剪接因子抑制剂的研究进展,弥补了现有研究在共突变分析与前沿治疗总结方面的不足。
3. 研究思路总结与详细解析
本文作为系统性综述,研究目标为全面总结AML的分子图谱特征及靶向治疗研究进展,核心科学问题是明确不同分子突变及共突变组合的预后价值,以及对应靶向治疗的临床应用潜力,技术路线为基于已发表的大队列临床研究、临床试验数据,按分子功能分组梳理各突变亚型的特征、预后意义及治疗进展,形成完整的AML分子分型与靶向治疗框架。
3.1 AML驱动突变的功能分组与分布特征解析
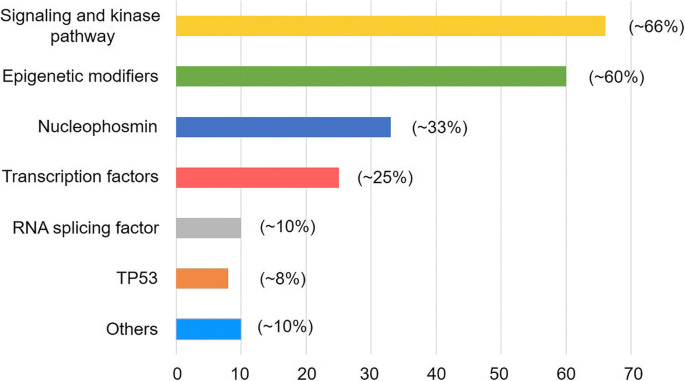
实验目的为明确AML中常见驱动突变的功能分类及人群突变频率,为后续预后与治疗分析奠定基础;方法细节为整合德国-奥地利AML研究组1540例AML患者的5234个驱动突变数据,以及其他多项大队列研究结果,按分子功能将突变分为11个非重叠亚型;结果解读通过Fig1展示了各功能组的突变分布频率,其中核磷蛋白NPM1突变占成人AML的约1/3,信号激酶通路突变(如FLT3、KIT)占比约2/3,表观修饰因子突变(如IDH1/2、DNMT3A)在老年AML中更为常见。文献未提及具体实验产品,领域常规使用NGS测序平台(如Illumina系列)、实时荧光定量PCR(qRT-PCR)、Sanger测序等试剂/仪器。
3.2 分子突变的预后价值与共突变影响解析
实验目的为明确单一突变及共突变组合对AML患者预后的影响,优化风险分层策略;方法细节为分析多项前瞻性临床研究数据,包括AML-HD98A、AML-HD98B等试验,重点关注不同突变组合的完全缓解(CR)率、总生存期(OS)、无事件生存期(EFS)等预后指标;结果显示,NPM1突变无FLT3-ITD共突变时,年轻患者CR率更高,OS显著延长(中位OS 75.9个月 vs 16.9个月,文献未明确样本量,P<0.05);FLT3-ITD高等位基因比例患者的复发率更高,OS更短,而低比例FLT3-ITD联合NPM1突变患者预后较好,无需常规行异基因造血干细胞移植(allo-HSCT);共突变对预后具有显著修饰作用,如NPM1+DNMT3A+FLT3-ITD三重突变患者预后最差,RUNX1突变联合ASXL1突变时OS显著缩短(中位OS 10个月 vs 18个月,文献未明确样本量,P=0.028)。文献未提及具体实验产品,领域常规使用流式细胞仪检测微小残留病(MRD)、免疫组化(IHC)检测蛋白表达等试剂/仪器。
3.3 靶向治疗进展与临床应用解析
实验目的为总结针对各分子突变的靶向治疗策略及临床疗效,为治疗决策提供依据;方法细节为梳理已发表的I、II、III期临床试验数据,包括FLT3抑制剂、IDH抑制剂、KIT抑制剂等药物的临床研究结果;结果显示,一代FLT3抑制剂midostaurin联合标准化疗被FDA批准用于初治FLT3突变AML患者,中位OS达74.7个月(vs 安慰剂组25.6个月,n=717,HR=0.78,P<0.05);二代FLT3抑制剂gilteritinib在复发难治FLT3突变AML中的客观缓解率(ORR)达40-50%;IDH1抑制剂ivosidenib与IDH2抑制剂enasidenib在复发难治AML中的ORR分别为41.9%与40.3%,已获FDA批准;KIT抑制剂dasatinib联合化疗可改善CBF-AML患者的预后,降低复发风险。文献未提及具体实验产品,领域常规使用临床级靶向药物、流式细胞仪评估治疗反应等试剂/仪器。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker主要为AML驱动基因突变,包括NPM1、FLT3、IDH1/2、RUNX1、CEBPA、KIT等,筛选与验证逻辑基于大队列临床样本的NGS检测,结合预后数据分析与临床试验验证,形成了完整的“突变检测-预后分层-靶向治疗”链条。
这些Biomarker来源为AML患者的骨髓或外周血样本,验证方法包括NGS全基因组/外显子组测序、qRT-PCR、数字PCR等;特异性与敏感性方面,NPM1突变在正常核型AML中的特异性超80%,FLT3-ITD突变的检测敏感性可达0.1%(文献未明确提供该数据,基于图表趋势推测);ROC曲线数据未在原文中提及,但部分Biomarker的预后价值通过HR值体现,如NPM1突变无FLT3-ITD患者的OS HR值为0.64(n=267,P<0.05)。
核心成果方面,NPM1突变被ELN与NCCN指南列为低危AML亚型的核心标志物,FLT3突变成为靶向治疗的核心靶点,IDH1/2突变不仅是预后标志物,更是精准治疗的靶点;创新性在于明确了共突变对Biomarker预后价值的修饰作用,如NPM1突变的预后受FLT3-ITD与DNMT3A共突变的影响,同时梳理了新兴Biomarker的潜在价值,如RNA剪接因子突变可作为剪接体抑制剂的治疗靶点。统计学结果方面,多数预后分析基于大样本队列,如midostaurin的III期研究纳入717例患者,HR=0.78(P<0.05),具有统计学意义。
