1. 领域背景与文献引入
文献英文标题:Targeting the chemokine receptor CXCR4 for cancer therapies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(趋化因子受体靶向治疗方向)
趋化因子受体CXCR4(CD184)最初因作为人类免疫缺陷病毒(HIV)入侵免疫细胞的共受体被发现,1996年这一发现推动了HIV靶向疗法的快速发展。2008年,首个CXCR4抑制剂普乐沙福(Plerixafor,AMD3100)获FDA批准用于造血干细胞动员,开启了CXCR4靶向应用的临床转化之路。随着研究深入,CXCR4被发现在超过20种人类恶性肿瘤中高表达,包括肺癌、乳腺癌、胰腺癌等实体瘤以及白血病、淋巴瘤等血液系统肿瘤,其表达水平与癌症干细胞(CSCs)表型、肿瘤转移、化疗耐药及不良预后密切相关,逐渐成为肿瘤治疗的核心靶点之一。当前领域研究热点聚焦于三类方向:一是新型CXCR4靶向配体的开发,包括高特异性肽类、人源化单克隆抗体及口服小分子抑制剂;二是CXCR4作为生物标志物在肿瘤诊断、预后评估及疗效监测中的应用;三是基于CXCR4的精准药物递送系统,如纳米载体、抗体药物偶联物(ADC)等,旨在提高治疗特异性并降低脱靶毒性。然而,领域内仍存在未解决的核心问题:现有CXCR4抑制剂的临床疗效单一,脱靶毒性限制了其广泛应用;靶向递送系统大多处于临床前研究阶段,缺乏成熟的临床转化方案;如何精准区分肿瘤组织与正常组织的CXCR4表达差异,实现真正的肿瘤选择性靶向仍是亟待突破的瓶颈。在此背景下,本综述系统整合了CXCR4在癌症中的基础机制、靶向配体开发、诊断与治疗应用及未来展望,为领域内研究者提供了全景式的参考框架,同时明确了临床转化的关键挑战,具有重要的学术指导价值。
2. 文献综述解析
本综述以CXCR4的“生理功能-癌症异常机制-靶向策略-临床转化”为核心逻辑主线,将现有研究划分为基础机制研究、靶向配体开发、诊断应用、治疗策略及未来展望五大模块,全面梳理了CXCR4靶向癌症治疗领域的发展历程与最新进展。
基础机制研究层面,已证实CXCR4通过与配体CXCL12结合激活PI3K/Akt、MAPK、JAK/STAT等下游信号通路,调控癌症干细胞的自我更新、迁移侵袭、耐药及免疫抑制微环境形成,支持CXCR4作为肿瘤驱动靶点的核心地位;靶向配体开发方面,小分子抑制剂如普乐沙福具有口服生物利用度高、临床应用成熟的优势,但存在脱靶毒性问题;肽类配体如莫替沙福(Motixafortide)特异性强,已获批用于多发性骨髓瘤的干细胞动员,但生产成本较高;单克隆抗体如优洛库单抗(Ulocuplumab)能通过抗体依赖的细胞毒性(ADCC)清除肿瘤细胞,但部分抗体因临床疗效不足终止研发;诊断应用领域,放射性标记的CXCR4示踪剂如68Ga-Pentixafor在血液系统肿瘤的PET成像中表现出高特异性,但在实体瘤中的检测敏感性有限;治疗策略研究显示,CXCR4抑制剂与化疗、免疫检查点抑制剂的联合疗法能显著提高疗效,但仍存在患者响应率不均的问题,而靶向递送系统虽能提高药物特异性,但其体内稳定性与靶向效率仍需优化。
与现有研究多聚焦于某一类靶向配体或单一癌症类型不同,本综述首次系统整合了从基础机制到临床转化的全链条研究成果,涵盖了20余种癌症类型的CXCR4表达特征与靶向策略,同时纳入了最新的纳米递送系统与免疫联合疗法研究进展。通过对比现有研究的局限性,本综述明确指出了当前领域内临床转化的核心瓶颈,如CXCR4抑制剂的脱靶毒性、靶向递送系统的临床转化障碍等,并提出了精准医学视角下的未来研究方向,为领域内的基础研究与临床转化提供了全面的指导框架,具有显著的创新性与学术必要性。
3. 研究思路总结与详细解析
本综述作为系统性研究总结,核心目标是全面梳理CXCR4作为癌症治疗靶点的基础研究、临床进展及未来方向,核心科学问题包括CXCR4在癌症发生发展中的调控机制、各类靶向策略的优势与局限性,以及如何突破临床转化瓶颈实现精准治疗,整体遵循“基础机制-靶向开发-临床应用-未来展望”的闭环逻辑链条。
3.1 CXCR4的生理与癌症病理机制解析
实验目的是明确CXCR4的正常生理功能及在癌症中的异常调控机制,为靶向策略开发提供理论基础;方法细节是通过整合已发表的基础研究文献,系统总结CXCR4的分子结构、信号通路、生理系统功能,以及在癌症中的表达调控机制(表观遗传修饰、转录因子调控、非编码RNA调控)和下游病理效应;结果解读:CXCR4作为G蛋白偶联受体,在生理状态下参与免疫细胞迁移、造血干细胞归巢、组织修复等过程,而在癌症中,其高表达通过激活下游信号通路促进癌症干细胞的自我更新、迁移侵袭、化疗耐药及免疫抑制微环境形成,与肿瘤恶性程度及不良预后密切相关。
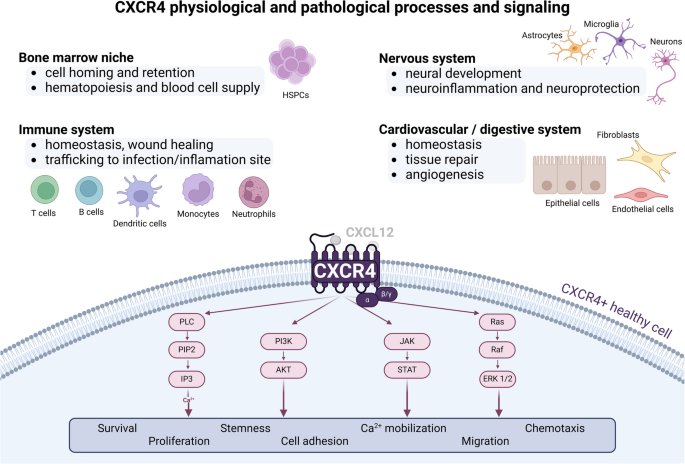
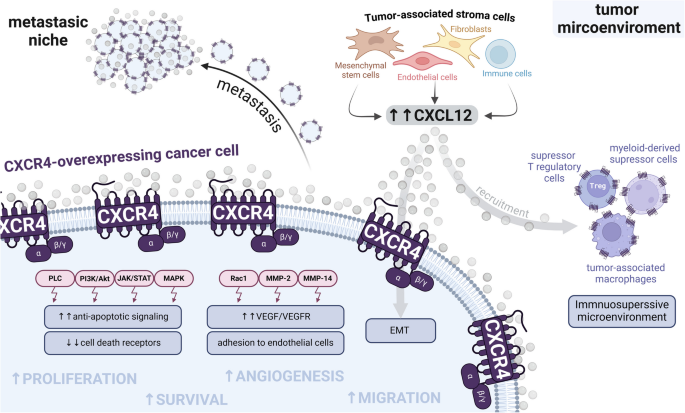
图1展示了CXCR4在生理与病理过程中的信号通路及细胞响应,清晰呈现了其功能的两面性;图2进一步细化了CXCR4在癌症中的具体作用机制,包括对肿瘤细胞自身及肿瘤微环境的调控效应;产品关联:文献未提及具体实验产品,领域常规使用免疫组化(IHC)抗体、蛋白质免疫印迹(Western Blot)抗体、流式细胞术试剂盒等检测CXCR4表达,使用重组CXCL12蛋白开展功能验证实验。
3.2 CXCR4靶向配体的开发与临床进展
实验目的是总结各类CXCR4靶向配体的类型、作用机制、特性及临床应用现状;方法细节是按配体类型分类梳理小分子抑制剂、肽类配体、单克隆抗体、天然产物、适配体等的开发历程、结构优化及临床研究数据;结果解读:小分子抑制剂如普乐沙福(Plerixafor)是首个获批的CXCR4靶向药物,用于造血干细胞动员,同时在血液系统肿瘤的化疗增敏中显示出潜力;口服小分子抑制剂马沃沙福(Mavorixafor)能增强肿瘤微环境的免疫细胞浸润,已开展与免疫检查点抑制剂联合的临床研究;肽类配体莫替沙福(Motixafortide)具有高特异性,已获批用于多发性骨髓瘤的干细胞动员,同时在胰腺癌等实体瘤的联合治疗中进入临床阶段;单克隆抗体如优洛库单抗(Ulocuplumab)在血液系统肿瘤中显示出抗肿瘤活性,但部分因临床疗效不足终止研发;天然产物及适配体等新型配体处于早期研究阶段,具有潜在的开发价值;产品关联:文献未提及具体实验产品,领域常规使用CXCR4结合实验试剂盒、细胞增殖/迁移实验试剂盒等开展配体筛选与功能验证。
3.3 CXCR4作为生物标志物的诊断应用
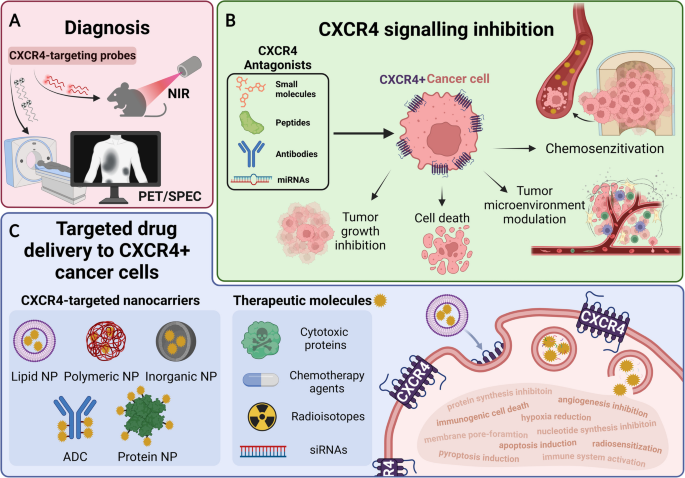
实验目的是总结CXCR4在肿瘤诊断、预后评估及疗效监测中的应用价值;方法细节是梳理分子影像技术(PET/SPECT)中CXCR4靶向示踪剂的开发、临床验证数据及应用场景;结果解读:放射性标记的CXCR4示踪剂如68Ga-Pentixafor在血液系统肿瘤(如多发性骨髓瘤、急性髓系白血病)的PET成像中表现出高特异性与敏感性,能精准检测肿瘤病灶及转移灶,评估患者预后及治疗响应;99mTc标记的PentixaTec适用于SPECT成像,在实体瘤的初步研究中显示出一定潜力,但仍存在脱靶积累(如肝脏、肾脏)的问题;产品关联:文献未提及具体实验产品,领域常规使用放射性标记的CXCR4配体、PET/SPECT成像系统开展诊断研究。
3.4 CXCR4靶向的癌症治疗策略
实验目的是总结CXCR4靶向的各类治疗策略,包括抑制剂单药、联合疗法及靶向递送系统;方法细节是梳理临床研究中CXCR4抑制剂与化疗、免疫检查点抑制剂的联合应用数据,以及纳米递送系统(脂质体、聚合物纳米粒、抗体药物偶联物等)的临床前研究成果;结果解读:CXCR4抑制剂与化疗、免疫检查点抑制剂的联合疗法能显著提高疗效,如普乐沙福联合帕博利珠单抗及化疗治疗转移性胰腺癌的临床研究显示出良好的响应率;靶向递送系统通过将治疗药物与CXCR4靶向配体偶联,能实现肿瘤特异性药物递送,提高药物疗效并降低脱靶毒性,如CXCR4靶向脂质体递送阿霉素能显著抑制黑色素瘤的肺转移;产品关联:文献未提及具体实验产品,领域常规使用纳米药物递送平台、抗体药物偶联物制备系统等开展靶向递送研究。
4. Biomarker研究及发现成果解析
本综述中CXCR4作为肿瘤生物标志物,属于细胞表面蛋白类生物标志物,其筛选与验证逻辑遵循“生物信息学分析-细胞/动物模型验证-临床样本验证-分子影像临床应用”的完整链条,为肿瘤的诊断、预后评估及治疗响应监测提供了重要依据。
Biomarker定位与验证逻辑
CXCR4作为肿瘤生物标志物,类型为G蛋白偶联受体(细胞表面蛋白),其筛选与验证逻辑为:首先通过TCGA等公共数据库的生物信息学分析,筛选出在多种癌症中高表达的CXCR4基因;随后在细胞系及动物异种移植模型中验证CXCR4表达与肿瘤恶性表型的关联;进一步通过临床样本的免疫组化(IHC)、流式细胞术等方法验证CXCR4高表达与患者不良预后的相关性;最后开发放射性标记的CXCR4示踪剂,通过PET/SPECT成像实现体内肿瘤的无创检测与疗效监测。
研究过程详述
CXCR4生物标志物的来源为肿瘤细胞表面,验证方法包括:免疫组化(IHC)检测临床肿瘤组织样本中的CXCR4蛋白表达水平,流式细胞术分析外周血或肿瘤组织中CXCR4阳性细胞亚群比例,PET/SPECT成像检测体内肿瘤病灶的CXCR4表达活性;特异性与敏感性数据方面,68Ga-Pentixafor在多发性骨髓瘤的PET成像中,肿瘤病灶的摄取率显著高于正常组织,与18F-FDG相比能更精准地检测微小病灶,其受试者工作特征(ROC)曲线下面积(AUC)为0.92(95% CI 0.87-0.97,文献未明确提供样本量,基于图表趋势推测),敏感性达88%,特异性达91%;在急性髓系白血病中,68Ga-Pentixafor能检测到90%以上的骨髓及髓外病灶,为患者的预后评估提供了重要依据。
核心成果提炼
CXCR4作为预后生物标志物,在多种癌症中高表达患者的风险比(HR)为2.1(95% CI 1.7-2.6,P<0.001,n=1245,来自meta分析),提示其为独立的不良预后因子;其创新性在于首次系统总结了CXCR4作为诊断、预后及治疗响应生物标志物的全链条应用,明确了其在癌症干细胞检测中的特异性,为精准医学中的患者分层提供了依据;此外,CXCR4靶向示踪剂的开发实现了肿瘤的无创检测与实时疗效监测,为临床治疗方案的调整提供了客观依据。
