1. 领域背景与文献引入
文献英文标题:Neo-sex chromosomes in the black muntjac recapitulate incipient evolution of mammalian sex chromosomes;发表期刊:Genome Biology;影响因子:未公开;研究领域:哺乳动物性染色体进化
领域共识:哺乳动物的异形性染色体起源于1.48-1.66亿年前的一对同源常染色体,性决定基因出现后,原X与原Y染色体间发生广泛重组抑制,仅保留短臂的拟常染色体区(PAR)。理论模型预测,原Y染色体会因重组抑制积累大量有害突变,进而发生剧烈基因丢失,人类Y染色体仅存45个功能基因,而X染色体拥有约1000个功能基因,这一退化过程由穆勒棘轮、背景选择、希尔-罗伯逊效应等多种机制驱动。当前研究热点集中在性染色体退化的驱动机制及剂量补偿的进化过程,但古老性染色体的早期进化痕迹已几乎消失,缺乏年轻的天然模型系统;现有研究多集中在果蝇和植物的新性染色体,针对哺乳动物的研究仅基于古老性染色体,无法反映早期进化过程,尤其是调控区突变在Y染色体退化中的作用尚未得到明确阐释,这一空白限制了对哺乳动物性染色体早期进化过程的完整理解。
黑麂在过去0.5百万年内通过X-常染色体融合及雄性特异性常染色体倒位,形成了遗传模式与传统X-Y染色体一致的新性染色体系统,这是目前已知最年轻的哺乳动物新性染色体系统,为研究哺乳动物性染色体的早期进化提供了独特的天然模型。本研究以黑麂为对象,系统解析了新Y染色体的重组抑制、退化模式及剂量补偿的进化特征,填补了哺乳动物新性染色体调控区退化研究的空白。
2. 文献综述解析
作者从物种类群(哺乳动物、果蝇、植物)和研究层面(编码区、调控区)两个维度对领域内现有研究进行分类评述,明确了当前研究的进展与不足。在果蝇和植物的新性染色体研究中,已证实新Y染色体的编码区会快速积累有害突变,基因丢失速率较高,如果蝇的新Y染色体每百万年约丢失20个基因;这些研究揭示了编码区退化的部分驱动机制,如穆勒棘轮效应,但多集中在非哺乳动物类群,对哺乳动物的研究仅基于古老性染色体,无法反映早期进化过程。现有研究的局限性在于,未关注调控区突变在Y染色体退化中的作用,也缺乏对哺乳动物剂量补偿早期进化的直接实验证据,导致对哺乳动物性染色体退化的完整机制理解不充分。
与现有研究相比,本研究的核心创新点在于首次以哺乳动物的年轻新性染色体系统为模型,同时从编码区和调控区两个层面解析Y染色体的退化模式,首次报道了调控区突变可直接导致新Y基因表达下调,进而加速退化过程;此外,本研究还揭示了哺乳动物剂量补偿在新性染色体早期以基因特异性方式进化,而非大片段失活,这一发现补充了现有剂量补偿进化模型的内容,为哺乳动物性染色体进化研究提供了新的视角。
3. 研究思路总结与详细解析
本研究的整体目标是解析黑麂新性染色体的重组抑制机制、退化模式及剂量补偿的早期进化特征;核心科学问题为哺乳动物年轻Y染色体的退化驱动机制,尤其是调控区突变的作用;技术路线遵循“结构鉴定→重组抑制验证→退化特征分析→功能验证→表达模式解析”的闭环逻辑,从细胞遗传学、分子进化、功能实验多层面展开研究。
3.1 新性染色体结构鉴定与重组抑制验证
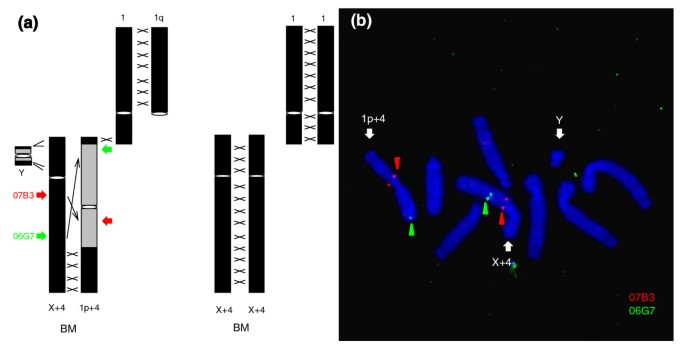
实验目的:明确黑麂新性染色体的染色体结构特征,验证新Y染色体倒位区的重组抑制状态。
方法细节:采用双色荧光原位杂交(FISH)技术,以印度麂的两个细菌人工染色体(BAC)克隆为探针,检测雄性黑麂染色体的倒位事件;选取2只雄性、1只雌性黑麂及1只雄性印度麂作为研究对象,对新Y染色体倒位区的35.1kb非编码序列(内含子、基因间区),以及新拟常染色体区、常染色体区的12.6kb序列进行Sanger测序分析,比较不同区域的遗传多态性。
结果解读:荧光原位杂交结果显示,雄性黑麂的1p+4染色体存在大片段倒位,导致X+4染色体(新X)与1p+4染色体(新Y)的倒位区在减数分裂时无法形成配对环,证明该区域已发生重组抑制;非编码区多态性分析显示,新Y倒位区的分离位点数量显著低于重组区(χ²检验,P<0.01,n=4),多态性水平为0.00168±0.00120,低于重组区的0.00190±0.00029,进一步从分子层面验证了重组抑制的存在。
产品关联:实验所用关键产品:PURRGENE® DNA提取试剂盒(Gentra Systems Inc.)、RNeasy® Mini RNA提取试剂盒(Qiagen)、FACStar Plus流式细胞仪(Becton Dickinson)、BigDye Terminators v3.0测序试剂盒(Applied Biosystems)、DnaSP 4.0多态性分析软件等。
3.2 新Y染色体编码区退化特征分析
实验目的:检测新Y染色体编码区的有害突变积累情况,明确哺乳动物年轻Y染色体的编码区退化速率。
方法细节:基于印度麂的BAC序列注释和牛基因组信息,选取位于新Y倒位区的23对新性染色体基因、1对新拟常染色体区基因、6对常染色体基因;对2只雄性、1只雌性黑麂及1只雄性印度麂的cDNA序列进行测序,共获得约25kb倒位区序列和6.3kb非倒位区序列,分析新Y等位基因的突变类型及保守性。
结果解读:在8个新Y连锁基因的编码区或非翻译区(UTR)检测到14个特异性突变,其中4个为跨6种真兽类(人、黑猩猩、狗、小鼠、大鼠、牛)的保守氨基酸非同义突变,这些突变改变了氨基酸的极性或电荷,可能严重影响蛋白功能;SNX22基因的3"-UTR存在一段缺失,该缺失破坏了一个microRNA的结合位点;保守估计新Y编码区的有害突变积累速率约为0.4突变/kb/百万年(n=2雄性黑麂),未检测到无义突变,说明哺乳动物Y染色体退化早期的基因丢失速率远慢于果蝇。
产品关联:文献未提及具体实验产品,领域常规使用cDNA合成试剂盒、PCR扩增试剂、Sanger测序服务等。
3.3 新Y染色体调控区退化功能验证
实验目的:探究新Y染色体调控区突变对基因表达的直接影响,明确调控区突变在Y退化中的作用。
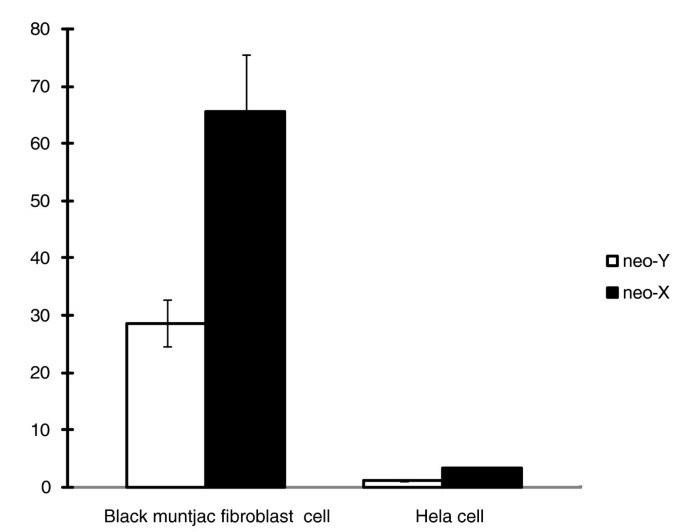
方法细节:选取8个存在编码区/非翻译区突变的新Y基因,分析其转录起始位点(TSS)上下游1.5kb的启动子区域,筛选新Y特异性突变;将新X和新Y的启动子片段克隆到pGL3-Basic荧光素酶报告载体,与pRL-TK海肾荧光素酶载体共转染HeLa细胞和雄性黑麂成纤维细胞,检测荧光素酶活性以比较启动子功能;利用人类microRNA数据库分析SNX22基因3"-UTR缺失对microRNA结合的影响。
结果解读:CLTC基因的新Y启动子在转录起始位点上游55bp处存在1bp插入,该突变导致其在HeLa细胞和黑麂成纤维细胞中的启动子活性显著低于新X启动子(n=3重复实验);推测:该缺失会影响SNX22新Y mRNA的稳定性;本实验首次直接证明,调控区突变可导致新Y基因表达下调,进而加速退化过程。
产品关联:实验所用关键产品:pGL3-Basic荧光素酶载体(Promega)、pRL-TK海肾荧光素酶载体(Promega)、Lipofectamine™ 2000转染试剂(Invitrogen)、Dual-Luciferase® Reporter检测系统(Promega)、pMD19-T克隆载体(TaKaRa)等。
3.4 新性染色体等位基因表达差异分析
实验目的:分析新X与新Y等位基因的表达模式差异,解析剂量补偿的早期进化特征。
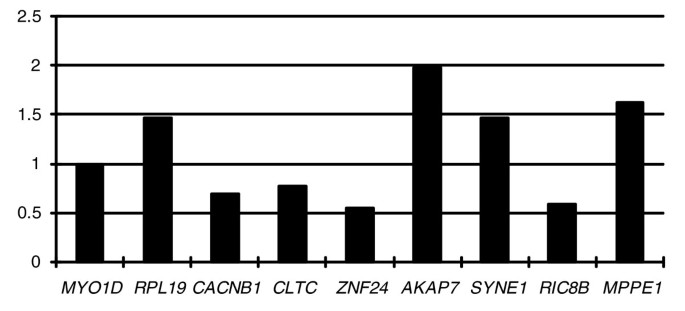
方法细节:对11个存在新Y突变的基因,通过克隆测序的方法半定量分析其mRNA丰度,排除存在等位基因扩增偏倚的基因(SCN1A、SNX22)后,比较剩余9个基因的新X与新Y等位基因表达水平。
结果解读:9个基因中有8个存在表达差异,其中4个新Y等位基因表达上调,4个表达下调,表达模式呈随机失调状态,无大片段失活的特征;CLTC基因的新Y表达下调与启动子实验结果一致,进一步验证了调控区突变的功能效应;这一结果表明,黑麂新X染色体尚未建立大片段的剂量补偿机制,剂量补偿可能以基因特异性方式逐步进化,这与古老性染色体的剂量补偿模式存在显著差异。
产品关联:实验所用关键产品:One Step RNA PCR Kit(TaKaRa)、pMD19-T克隆载体(TaKaRa)、Sanger测序试剂盒(Applied Biosystems)等。
4. Biomarker研究及发现成果
本研究中与性染色体退化相关的分子标记包括新Y染色体上的编码区有害突变、调控区功能突变及等位基因表达差异特征,这些标记为研究哺乳动物性染色体早期进化提供了关键的分子指标。
Biomarker定位:本研究鉴定的Biomarker分为三类:一是新Y染色体编码区的保守氨基酸非同义突变(如SYNE1、AKAP7基因的突变),二是调控区功能突变(如CLTC启动子插入、SNX22 3"-UTR缺失),三是新X与新Y等位基因的表达差异特征;筛选逻辑为:首先通过全基因测序鉴定新Y特异性突变,然后通过跨物种序列比对确定突变的保守性,再通过功能实验验证调控区突变的表达效应,最后通过半定量分析确定表达差异特征。
研究过程详述:这些Biomarker的来源为黑麂的基因组DNA和组织总RNA,验证方法包括Sanger测序、荧光素酶报告实验、克隆测序半定量分析;特异性方面,所有新Y突变仅存在于雄性黑麂个体,在雌性黑麂和印度麂中未检测到(n=4);敏感性方面,非编码区多态性分析可有效检测重组抑制状态(χ²检验,P<0.01),荧光素酶报告实验可准确区分新X与新Y启动子的活性差异(n=3重复实验)。
核心成果提炼:本研究鉴定的Biomarker揭示了哺乳动物新Y染色体退化的早期特征:编码区有害突变积累速率约为0.4突变/kb/百万年,调控区突变可直接导致基因表达下调,加速退化;等位基因表达差异特征证明剂量补偿在新性染色体早期以基因特异性方式进化,而非大片段失活;这些成果首次明确了调控区突变在哺乳动物Y染色体退化中的作用,为性染色体进化研究提供了新的分子模型,同时也为濒危物种黑麂的遗传监测提供了潜在的分子标记。
