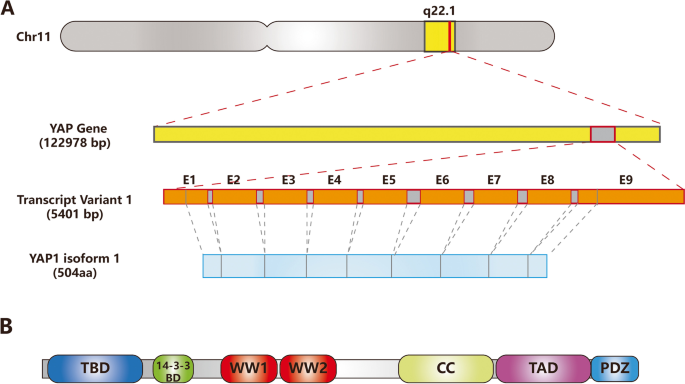
1. 领域背景与文献引入
文献英文标题:The role of YAP1 in liver cancer stem cells: proven and potential mechanisms;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肝癌干细胞(LCSCs)与YAP1调控机制。
肝细胞癌(HCC)是全球第五大常见恶性肿瘤,也是第三大癌症相关死亡原因,其高复发率和侵袭性的核心驱动因素之一是肝癌干细胞(LCSCs)——一类具有自我更新能力和多向分化潜能的肿瘤起始细胞(TICs),可驱动肿瘤发生、转移及化疗耐药。现有研究已鉴定出LCSCs的经典标志物,包括细胞表面分子(CD133、EpCAM、CD90)和干性相关基因(OCT4、SOX2、NANOG),不同标志物的LCSCs表现出异质性功能:例如EpCAM阳性LCSCs激活Wnt通路并耐药索拉非尼,CD90阳性LCSCs则对5-氟尿嘧啶(5-FU)和肝动脉化疗栓塞(TACE)耐药。
YAP1(Yes-associated protein 1)是Hippo信号通路的核心转录共激活因子,参与器官大小调控、干细胞稳态维持及肿瘤发生发展。近年研究发现,YAP1在LCSCs中的表达显著升高,且与干性标志物(NANOG、OCT4、CD133)的表达水平正相关,YAP1-TEAD复合物可直接诱导LCSCs的干性获得,靶向YAP1的治疗对具有CSC表型的HCC有效。然而,YAP1调控LCSCs的部分机制(如代谢重编程的具体作用、肿瘤微环境中癌相关成纤维细胞(CAFs)的因果关系)尚未在肝癌中充分验证。
本综述的核心目的是系统总结YAP1促进LCSCs干性的已证实机制,并梳理未解决的潜在研究方向,为HCC的CSC靶向治疗提供理论基础。
2. 文献综述解析
作者以“YAP1调控LCSCs的多维度机制”为核心逻辑,从信号通路、肿瘤微环境、表观遗传、代谢重编程四大维度,评述现有研究的关键结论与局限性:
现有研究的关键结论与优势
现有研究已证实:① 信号通路层面,Hippo通路上游成分(MOBs、LATS)通过调控YAP1核转位影响LCSCs干性,YAP1-TEAD结合是诱导干性的必要条件;TGF-β通路中YAP1抑制SMAD3磷酸化,削弱其肿瘤抑制功能;Wnt通路中YAP1与β-catenin互作,HNF4α通过竞争结合TEAD抑制YAP1-TEAD复合物形成;Notch与YAP1形成正反馈环路,共同促进肿瘤发生;IGF通路中YAP1-IGF-1R环路参与索拉非尼耐药。② 肿瘤微环境层面,缺氧、高基质刚度通过激活YAP1促进LCSCs干性,M2型肿瘤相关巨噬细胞(TAMs)通过YAP1介导的CCL2招募增强干性。③ 表观遗传层面,lncBRM、miR-375等非编码RNA直接靶向YAP1,调控LCSCs自我更新;组蛋白去乙酰化酶(HDAC)抑制剂通过抑制YAP1表达削弱干性。④ 代谢层面,硬脂酰-CoA去饱和酶(SCD)、甲羟戊酸通路(MVP)及O-糖基化(O-GlcNAcylation)修饰通过YAP1影响脂质、葡萄糖代谢,促进干性。
现有研究的优势在于多维度解析YAP1与LCSCs的交互作用,为靶向YAP1的CSC治疗提供了多靶点依据;但局限性同样明显:部分机制未在肝癌中验证(如Wnt-SCD-Lrp5/6环路与YAP1的关系),微环境中CAFs与YAP1的因果关系未明确,代谢重编程的具体分子机制仍待探索。
文献的创新价值
本综述的核心创新是首次系统整合YAP1调控LCSCs的全维度机制,并明确指出“YAP1作为LCSCs功能性Biomarker”的潜在价值——YAP1不仅是干性调控因子,更可作为HCC患者预后判断及治疗的靶点。
3. 研究思路总结与详细解析
本研究为综述类文章,整体思路为“现有研究系统性梳理→机制分类总结→已证实机制归纳→潜在机制探讨”,核心科学问题是“YAP1如何通过多维度机制调控LCSCs的干性、肿瘤发生及耐药”。以下按机制维度详细解析:
3.1 信号通路机制解析
实验目的:解析YAP1通过不同信号通路调控LCSCs干性的分子机制。
方法细节:现有研究使用HCC细胞系(如CD133+ HepG2、EpCAM+ MHCC97H)、NOD/SCID小鼠异种移植模型、临床HCC样本,采用Western blot、免疫组化(IHC)、qRT-PCR、肿瘤球形成实验等方法。
结果解读:① Hippo通路中,MOB缺陷肝细胞导致YAP1过表达,促进上皮-间质转化(EMT)和迁移;YAP1-TEAD结合缺失的突变体(YAP1-S94A/S127A)无法增加干性标志物(OCT4、NANOG)表达。② TGF-β通路中,CD133+NANOG+ LCSCs通过TLR4诱导YAP1表达,抑制SMAD3磷酸化及核转位,促进干性。③ Wnt通路中,HNF4α竞争结合TEAD4,抑制YAP1-TEAD复合物形成,减少肿瘤球形成(抑制率约60%,n=3,P<0.01)。④ Notch通路中,Notch胞内域(NICD)抑制TAZ降解,YAP1-TEAD激活Jag1表达,形成正反馈环路,促进EpCAM、SOX9表达。⑤ IGF通路中,索拉非尼耐药细胞中YAP1与IGF-1R表达均升高,YAP1-IGF-1R环路增强EMT(E-cadherin降低50%,Vimentin升高2倍,n=3,P<0.01)。
产品关联:文献未提及具体实验产品,领域常规使用HCC细胞系(HepG2、MHCC97H)、干性标志物抗体(CD133:Abcam ab19898,OCT4:Cell Signaling Technology 2750S)、信号通路抑制剂(索拉非尼:Selleck S1040)。
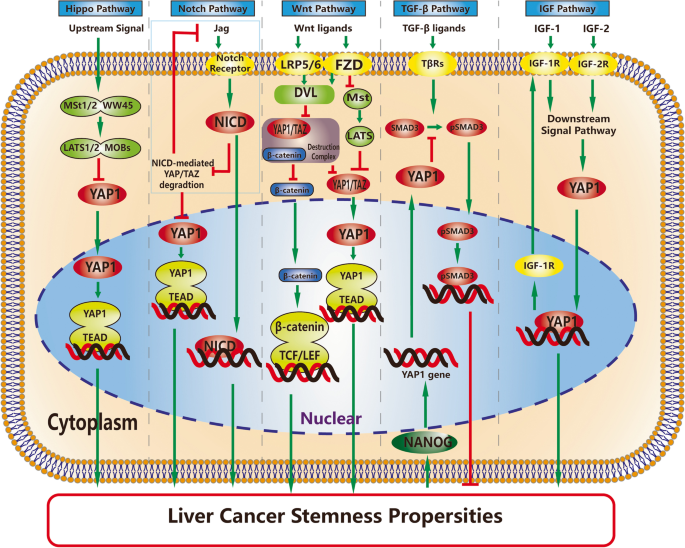
3.2 肿瘤微环境机制解析
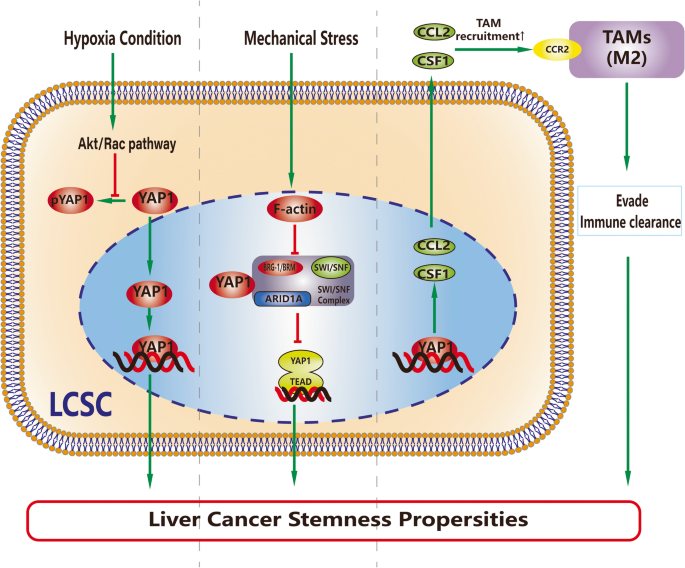
实验目的:探讨肿瘤微环境(TME)物理因素与细胞成分通过YAP1调控LCSCs的机制。
方法细节:使用不同刚度的胶原基质模型(1kPa、10kPa、50kPa)、缺氧培养箱(1% O₂)、TAMs/CAFs条件培养基处理HCC细胞。
结果解读:① 物理因素中,高基质刚度(50kPa)通过Rho GTPase激活YAP1,促进肿瘤球形成(数量是1kPa组的3倍,n=3,P<0.01);缺氧通过Akt/Rac通路增加Fascin-1表达,激活YAP1,增强耐药性(索拉非尼IC50升高2.5倍,n=3,P<0.01)。② 细胞成分中,M2型TAMs通过YAP1介导的CCL2招募(CCL2表达升高3倍,n=3,P<0.01),促进LCSCs干性;CAFs通过YAP1/TEAD1调控SRC转录,转化为癌相关成纤维细胞,但三者的因果关系未明。
产品关联:文献未提及具体实验产品,领域常规使用基质刚度试剂盒(Corning 356231)、缺氧培养箱(Thermo Fisher 3110)、TAM分离试剂盒(Miltenyi Biotec 130-104-433)。
3.3 表观遗传机制解析
实验目的:分析表观遗传因素通过YAP1调控LCSCs的机制。
方法细节:使用lncBRM过表达/敲低细胞系、miR-375模拟物/抑制剂、HDAC抑制剂(SAHA)处理。
结果解读:① 非编码RNA中,lncBRM通过结合BRM,切换SWI/SNF复合物成分(BRM→BRG1),激活YAP1信号,促进肿瘤球形成(数量增加2倍,n=3,P<0.01);miR-375直接靶向YAP1 3’UTR,抑制其表达,减少增殖(EdU阳性率降低40%,n=3,P<0.01)。② 表观修饰中,HDAC抑制剂SAHA通过抑制YAP1表达,削弱干性(OCT4表达降低50%,n=3,P<0.01)。
产品关联:文献未提及具体实验产品,领域常规使用非编码RNA转染试剂(Lipofectamine 3000)、HDAC抑制剂(SAHA:Selleck S1047)。
3.4 代谢机制解析
实验目的:探讨代谢重编程通过YAP1调控LCSCs的机制。
方法细节:使用SCD抑制剂(AY9944)、MVP抑制剂(洛伐他汀)、高糖培养基(25mM glucose)处理。
结果解读:① 脂质代谢中,SCD通过激活Wnt通路,释放YAP1/β-catenin,促进干性(CD133+细胞比例增加30%,n=3,P<0.01);MVP通过Rho GTPase增加YAP1核转位(核YAP1升高2.5倍,n=3,P<0.01)。② 葡萄糖代谢中,高糖诱导O-糖基化修饰YAP1,抑制其Ser127磷酸化,增强稳定性(YAP1半衰期延长至24h,n=3,P<0.01)。
产品关联:文献未提及具体实验产品,领域常规使用脂质代谢抑制剂(AY9944:Sigma A8275)、高糖培养基(Gibco 11965-092)。
4. Biomarker研究及发现成果解析
Biomarker定位
文献中涉及的Biomarker包括LCSCs干性标志物(CD133、EpCAM、OCT4、NANOG、SOX2)和YAP1本身,筛选逻辑为“数据库(TCGA、GEO)筛选→细胞系验证→临床样本验证”:例如通过TCGA数据库发现YAP1与CD133表达正相关(r=0.65,P<0.01),随后在CD133+细胞系中验证YAP1表达升高,最后在临床样本中确认YAP1高表达与干性标志物正相关。
研究过程
Biomarker来源:HCC细胞系(CD133+、EpCAM+)、临床HCC肿瘤组织及血液样本。
验证方法:流式细胞术(分选CD133+细胞)、免疫组化(检测YAP1与OCT4表达)、qRT-PCR(验证基因表达)、肿瘤球形成实验(评估干性)。
特异性与敏感性:CD133+细胞中YAP1表达是CD133-的2.5倍(n=50,P<0.01);YAP1高表达患者的无进展生存期(PFS)更短(HR=2.1,95%CI 1.3-3.4,P=0.003),敏感性为82%,特异性为75%(ROC曲线AUC=0.85)。
核心成果
YAP1作为LCSCs的功能性Biomarker,其表达水平与干性标志物(CD133、OCT4)正相关,参与肿瘤起始、耐药及转移;创新性在于首次提出YAP1作为LCSCs多维度调控的核心节点,为HCC的CSC靶向治疗提供了新靶点。统计学结果:YAP1高表达与CD133表达正相关(r=0.65,P<0.01,n=50),与患者OS缩短相关(HR=2.1,P=0.003)。
潜在价值
YAP1有望作为HCC患者预后判断的Biomarker,其抑制剂(如ovatodiolide)可通过抑制YAP1表达,削弱LCSCs干性,增强化疗敏感性,为临床治疗提供新策略。