1. 领域背景与文献引入
文献英文标题:Polydatin up-regulates clara cell secretory protein to suppress phospholipase A2 of lung induced by LPS in vivo and in vitro;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:急性肺损伤(ALI)/急性呼吸窘迫综合征(ARDS)的发病机制与药物干预。
急性肺损伤(ALI)及其严重形式急性呼吸窘迫综合征(ARDS)是儿童脓毒症的主要致死原因之一,全球范围内ALI死亡率达18%-27%,ARDS更是高达29%-50%。其核心病理特征为中性粒细胞大量浸润肺组织、促炎介质过量释放,以及肺上皮-内皮屏障破坏。现有治疗聚焦于抑制炎症瀑布或增强机体自身防御,但脓毒症诱导的ALI疗效仍有限,关键机制尚未完全阐明。
磷脂酶A2(PLA2)是水解细胞膜磷脂的关键酶,可释放花生四烯酸、前列腺素等炎症介质,直接加剧肺损伤;克拉拉细胞分泌蛋白(CCSP,又称克拉拉细胞16kDa蛋白)是支气管非纤毛上皮细胞(克拉拉细胞)分泌的内源性PLA2抑制剂,通过结合PLA2的钙辅因子或磷脂底物发挥抗炎作用。然而,LPS等炎症刺激会显著下调CCSP表达,削弱其保护功能。
虎杖苷(PD)是从传统中药虎杖中提取的多酚类化合物,此前研究证实其能抑制LPS诱导的PLA2活性及sPLA2-IIA mRNA表达,减轻肺损伤,但PD是否通过上调CCSP发挥作用这一核心机制尚未明确。本研究正是针对这一空白,通过体内外实验系统验证PD对CCSP的调控及下游PLA2抑制效应,为PD治疗ALI提供理论支撑。
2. 文献综述解析
作者围绕“ALI病理机制”“PLA2与CCSP的相互作用”“PD药理活性”三方面梳理现有研究,明确本研究的创新边界:
现有研究核心结论
- ALI与炎症介质:LPS诱导ALI时,肺组织CCSP表达显著下降,PLA2(包括分泌型sPLA2和胞浆型cPLA2)活性升高,导致膜磷脂水解和炎症介质爆发;
- CCSP的保护作用:CCSP作为内源性PLA2抑制剂,可减少炎症损伤,但LPS对CCSP的下调会削弱这一自我防御机制;
- PD的药理潜力:PD具有抗氧化、改善微循环、抑制血小板聚集等活性,此前研究发现其能降低PLA2活性,但未涉及CCSP的调控。
现有研究局限性
缺乏PD对CCSP表达的系统研究,未明确CCSP在PD抑制PLA2中的中介作用,且缺乏体内外的协同验证。
本研究创新点
首次通过体内大鼠模型和体外BEAS-2B支气管上皮细胞模型,系统验证PD对CCSP的上调作用及剂量依赖关系,明确CCSP是PD抑制PLA2的关键机制,为PD治疗ALI提供了直接的机制证据。
3. 研究思路总结与详细解析
本研究以“PD上调CCSP→抑制PLA2→减轻ALI”为核心假设,采用“体内+体外”双模型、“mRNA+蛋白+血清+细胞表型”多维度检测,形成“假设-验证-结论”的闭环。
3.1 体内实验设计与动物模型构建
实验目的:建立LPS诱导的大鼠ALI模型,探究PD“预处理”(LPS前0.5h给药)与“治疗”(LPS后1h给药)对CCSP和PLA2的影响,分析剂量依赖关系。
方法细节:选取7周龄雄性SD大鼠(200-250g),随机分为5组(n=10):假手术组(生理盐水)、内毒素休克组(LPS 10mg/kg)、PD治疗组(LPS后1h给PD)、PD预处理组(LPS前0.5h给PD)、PD对照组(仅PD)。PD治疗/预处理组进一步按剂量(1、5、10、30 mg·kg⁻¹)分为4个亚组(n=6)。大鼠麻醉后监测平均动脉压(MAP),LPS注射后6h处死,收集肺组织和血液。
结果解读:LPS组MAP显著下降(休克状态),PD预处理/治疗组MAP下降幅度减小;假手术组CCSP表达稳定,内毒素休克组CCSP mRNA/蛋白显著降低(P<0.01),PD组随剂量增加CCSP表达逐步升高(P<0.05或0.01),且预处理组效果优于治疗组。
产品关联:LPS购自Sigma;MAP检测使用MS302生物信号记录分析系统(广东药学院);PD为自行制备的0.5%溶液(1 mg/kg)。
3.2 体内CCSP与PLA2 mRNA表达检测
实验目的:检测PD对LPS诱导肺组织CCSP、sPLA2、cPLA2 mRNA表达的影响。
方法细节:Trizol法提取肺组织总RNA,经RNeasy Mini Kit纯化、DNase I处理后,用SuperScript III反转录合成cDNA。通过实时PCR(ABI Prism 7000)和RT-PCR检测目标基因mRNA水平,以β-actin为内参。
结果解读:内毒素休克组CCSP mRNA较假手术组下降约50%(P<0.01),PD预处理组(30 mg·kg⁻¹)CCSP mRNA较LPS组升高约2倍(P<0.01),且呈剂量依赖(10 mg·kg⁻¹及以上剂量效果显著,P<0.01 vs 1 mg·kg⁻¹组);sPLA2和cPLA2 mRNA在LPS组显著升高(P<0.01),PD组随剂量增加而降低(30 mg·kg⁻¹组较LPS组下降约40%,P<0.01),预处理组效果更优。
产品关联:Trizol试剂(Invitrogen);RNeasy Mini Kit、DNase I(Qiagen);SuperScript III First-Strand Synthesis System(Invitrogen);ABI Prism 7000序列检测系统(Applied Biosystems)。
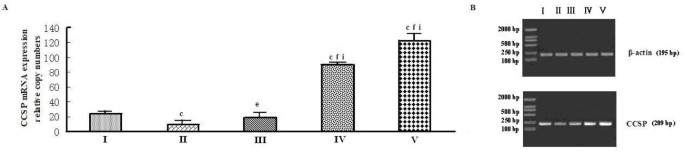
(图2:PD对大鼠肺组织CCSP mRNA表达的影响,预处理组效果优于治疗组)
3.3 体内CCSP蛋白与血清水平检测
实验目的:验证CCSP蛋白表达与mRNA的一致性,及PD对血清CCSP(反映肺屏障完整性)的影响。
方法细节:肺组织蛋白经SDS-PAGE电泳后转膜,用兔抗人CCSP多克隆抗体(Abcam,ab40873)进行Western blot检测,以GAPDH为内参;血清CCSP用ELISA试剂盒(Westang,F15255)检测。
结果解读:内毒素休克组CCSP蛋白较假手术组下降约60%(P<0.01),PD预处理组(30 mg·kg⁻¹)蛋白水平升高约1.8倍(P<0.01),与mRNA水平完全一致;血清CCSP在LPS组显著升高(P<0.05),PD组随剂量增加而降低(30 mg·kg⁻¹组较LPS组下降约40%,P<0.01),提示PD改善了肺屏障完整性,减少CCSP漏出。
产品关联:兔抗人CCSP抗体(Abcam,ab40873);ELISA试剂盒(Westang,F15255);化学发光底物(Thermo 34077)。
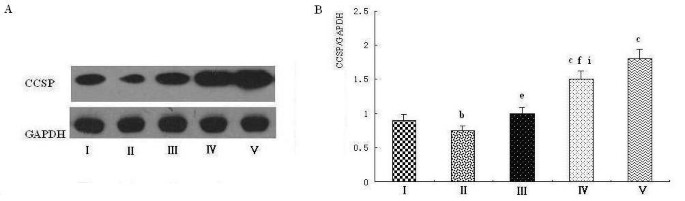
(图7:PD对大鼠肺组织CCSP蛋白表达的影响,蛋白与mRNA趋势一致)
3.4 体内CCSP阳性细胞比例分析
实验目的:检测PD对肺组织克拉拉细胞(CCSP阳性细胞)数量的影响。
方法细节:肺组织石蜡切片经Bouin液固定,用CCSP抗体(Abcam,ab40873)进行免疫组化染色,计数支气管上皮中CCSP阳性细胞比例。
结果解读:内毒素休克组CCSP阳性细胞比例较假手术组下降约30%(P<0.01),PD预处理组(30 mg·kg⁻¹)阳性细胞比例升高约25%(P<0.01),提示PD可能增加了克拉拉细胞数量或其CCSP分泌能力。
3.5 体外细胞模型构建与CCSP表达检测
实验目的:在BEAS-2B支气管上皮细胞中验证PD对LPS诱导CCSP表达的调控。
方法细节:BEAS-2B细胞(ATCC)分为5组:正常对照组、LPS组(100 ng/ml,28h)、PD治疗组(LPS后4h给0.5 mmol/L PD)、PD预处理组(PD预处理4h后给LPS)、PD对照组。通过实时PCR和Western blot检测CCSP mRNA/蛋白。
结果解读:LPS组CCSP mRNA/蛋白显著降低(P<0.01),PD预处理组CCSP表达较LPS组升高约1.5倍(P<0.01),治疗组升高约1.2倍(P<0.05),与体内实验完全一致,证实PD对CCSP的上调作用具有细胞自主性。
4. Biomarker研究及发现成果解析
Biomarker定位与验证逻辑
本研究的核心Biomarker为克拉拉细胞分泌蛋白(CCSP),属于“组织+体液”双维度蛋白 Biomarker。筛选逻辑为“LPS诱导ALI→CCSP下调→PD上调CCSP→抑制PLA2”;验证逻辑覆盖体内(大鼠模型)和体外(BEAS-2B细胞),多层面检测CCSP的mRNA、蛋白、血清水平及阳性细胞比例。
研究过程与数据
- 来源与检测方法:
- 组织层面:大鼠肺组织(实时PCR/RT-PCR检测mRNA,Western blot检测蛋白,免疫组化检测阳性细胞);
- 体液层面:大鼠血清(ELISA检测CCSP漏出水平);
细胞层面:BEAS-2B支气管上皮细胞(实时PCR/Western blot检测细胞内CCSP)。
特异性与敏感性:
- 特异性:LPS组肺组织CCSP mRNA/蛋白显著低于假手术组(P<0.01),血清CCSP显著高于假手术组(P<0.05);PD组随剂量增加,肺组织CCSP升高、血清CCSP降低(30 mg·kg⁻¹组差异最显著,P<0.01)。
- 敏感性:PD对CCSP的上调呈剂量依赖,10 mg·kg⁻¹及以上剂量效果显著(P<0.01 vs 1 mg·kg⁻¹组);预处理方式(LPS前给药)较治疗方式更敏感(P<0.05)。
核心成果与创新
- 功能关联:CCSP是PD抑制PLA2的关键中介,PD通过上调CCSP表达(剂量依赖),显著抑制sPLA2和cPLA2活性,减轻LPS诱导的肺损伤。
- 临床意义:预处理方式(LPS前给药)较治疗方式更有效,提示PD可能作为ALI的预防性药物使用。
- 创新性:首次明确CCSP在PD肺保护机制中的核心作用,为ALI的药物干预提供了新靶点(CCSP)和策略(PD预处理)。
本研究通过体内外系统验证,首次揭示PD通过上调CCSP抑制PLA2的分子机制,为传统中药虎杖苷治疗ALI提供了科学依据,也为ALI的药物开发提供了新的靶点方向。
