1. 领域背景与文献引入
文献英文标题:Identification of potential binding pocket on viral oncoprotein HPV16 E6: a promising anti-cancer target for small molecule drug discovery;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:HPV相关宫颈癌靶向药物研发、分子建模与药物靶点发现
宫颈癌是全球女性发病率最高的恶性肿瘤之一,高危型人乳头瘤病毒(HPV)感染是其主要致病因素,其中HPV16是致癌性最强的亚型,超过50%的宫颈癌病例与HPV16感染相关。领域共识:HPV的致癌机制主要依赖其编码的E6和E7癌蛋白,E6通过结合细胞内的Fas相关死亡结构域(FADD)分子,抑制外源性凋亡通路的激活,导致感染细胞逃避凋亡、发生永生化。目前临床预防HPV感染的主要手段是HPV疫苗,但其存在价格昂贵、仅能预防未感染人群、对已感染患者无治疗作用的局限性。已有研究报道了少量靶向HPV16 E6的小分子抑制剂,如黄酮类化合物,可通过阻断E6与FADD的结合恢复细胞凋亡,但这些研究均未明确E6上与抑制剂结合的具体位点,导致无法通过理性设计优化抑制剂的活性与特异性。针对这一核心空白,本研究通过系统的分子建模流程,结合已知抑制剂的活性数据,定位HPV16 E6上的潜在结合口袋,为新型抗宫颈癌小分子药物的研发提供关键靶点信息。
2. 文献综述解析
作者围绕HPV致癌机制、现有干预手段的局限性、已报道E6抑制剂的研究现状展开综述,明确了“缺乏E6抑制剂结合位点解析”这一核心研究空白,为本文的分子建模研究提供了必要性支撑。
现有研究中,HPV疫苗的优势在于能有效预防高危型HPV的初次感染,降低宫颈癌的发病风险,但局限性是生产成本高、在发展中国家的可及性差,且无法逆转已感染细胞的致癌进程;已报道的E6抑制剂主要通过高通量筛选获得,包括黄酮类、黄酮醇类化合物,这些抑制剂能在细胞水平阻断E6的致癌功能,但由于缺乏对结合位点的结构解析,无法基于靶点结构进行药物分子的理性优化,导致抑制剂的活性提升空间有限。
与现有研究相比,本文的核心创新点在于首次将分子建模技术与已知抑制剂的活性数据相结合,通过“盲对接-聚类分析-精准对接”的系统流程,明确了HPV16 E6上介导抑制剂结合的关键氨基酸残基,填补了E6抑制剂结合位点解析的空白,为后续的药物理性设计提供了结构基础,突破了现有研究仅能通过高通量筛选发现抑制剂的局限性。
3. 研究思路总结与详细解析
本研究的整体目标是定位HPV16 E6上与黄酮类抑制剂结合的潜在功能口袋,核心科学问题是明确E6上介导抑制剂结合的关键氨基酸残基,技术路线遵循“全面筛选-精准验证-核心鉴定”的闭环逻辑,通过多轮分子对接与数据分析,最终得到具有活性相关性的结合口袋信息。
3.1 盲对接筛选潜在结合口袋
实验目的是全面识别HPV16 E6蛋白表面的所有可能结合位点,避免遗漏潜在的功能口袋。方法细节为使用SwissDock在线分子对接工具,选取HPV16 E6的晶体结构(PDB:4GIZ)的C链作为受体,将6种已知的黄酮类抑制剂(杨梅素、桑色素、高良姜素、山奈酚、6-羟基黄酮醇、槲皮素)作为配体进行盲对接,工具会生成配体在受体表面的所有可能结合构象,并将构象相似的结合模式聚类为独立的结合口袋。结果解读:盲对接共得到345个独立聚类,每个聚类代表一个潜在的结合口袋,预测文件提供了每个聚类的排名、结合自由能(ΔG)等数据,为后续筛选提供了基础。文献未提及具体实验产品,领域常规使用SwissDock、Discovery Studio等分子建模与可视化软件。
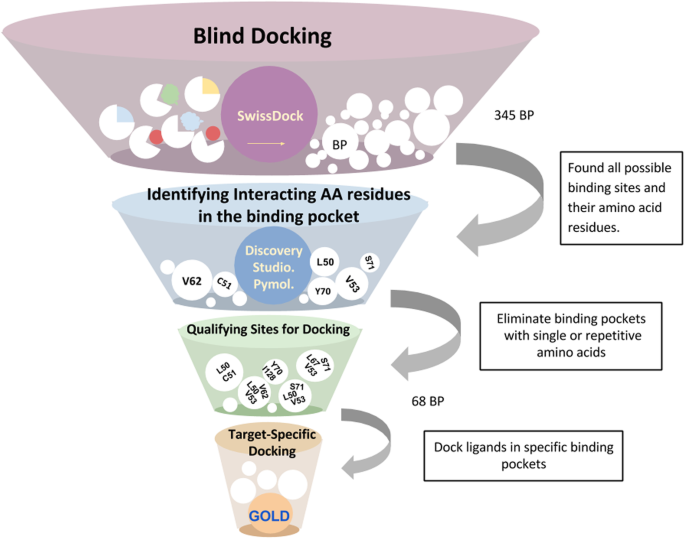
3.2 聚类可视化与受体-配体相互作用分析
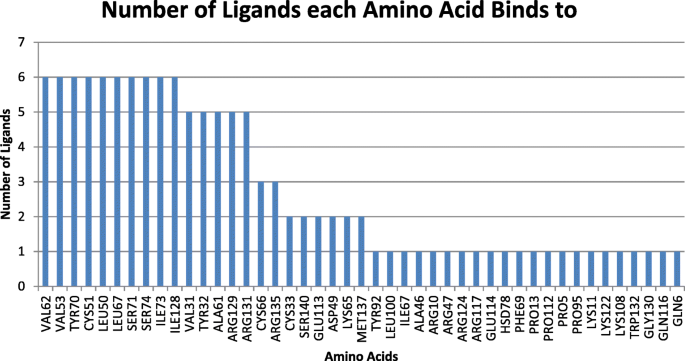
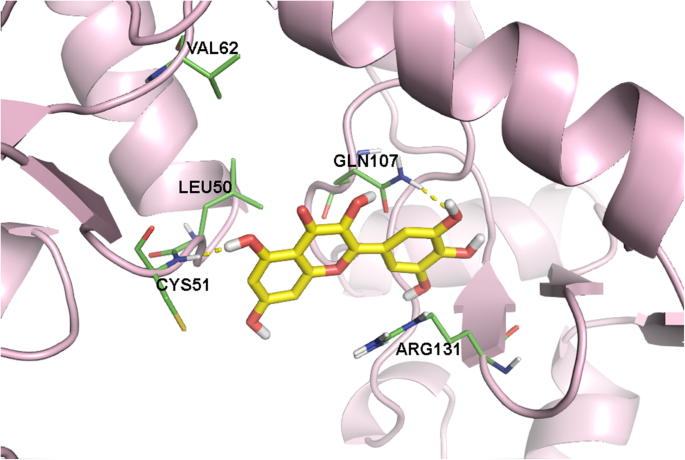
实验目的是从盲对接得到的大量潜在口袋中筛选出具有生物学意义的结合位点,排除非特异性结合的聚类。方法细节为使用Discovery Studio可视化工具,逐一分析每个聚类中配体与E6蛋白的相互作用,记录参与结合的氨基酸残基、键合类型(如氢键、疏水相互作用)及原子间距离。结果解读:分析发现,Cys51和Leu50是与所有6种配体发生相互作用最频繁的氨基酸残基,提示这两个残基可能位于E6抑制剂的核心结合区域;此外,Ala61、Arg131和Gln107也频繁出现在不同的结合口袋中,可能参与辅助结合。文献未提及具体实验产品,领域常规使用Discovery Studio等分子可视化软件。
3.3 聚类去重与精准对接验证
实验目的是进一步筛选出与抑制剂活性相关的结合口袋,明确结合亲和力与实验活性的相关性。方法细节为首先对盲对接得到的聚类进行去重处理,去除重复或重叠度极高的口袋,最终得到68个潜在的独立结合口袋;随后使用GOLD分子对接工具,将6种抑制剂分别对接至这68个口袋,以GOLD评分衡量配体与口袋的结合亲和力,并将评分与实验测得的IC50数据进行相关性分析。结果解读:24个口袋的GOLD评分高于40,代表这些口袋与配体的结合亲和力较高;其中6个口袋的GOLD评分与IC50数据呈现显著的正相关趋势(杨梅素>桑色素>槲皮素=6-羟基黄酮醇=高良姜素>山奈酚),与实验中抑制剂的活性顺序完全一致,提示这些口袋是具有功能相关性的结合位点。文献未提及具体实验产品,领域常规使用GOLD等分子对接软件。
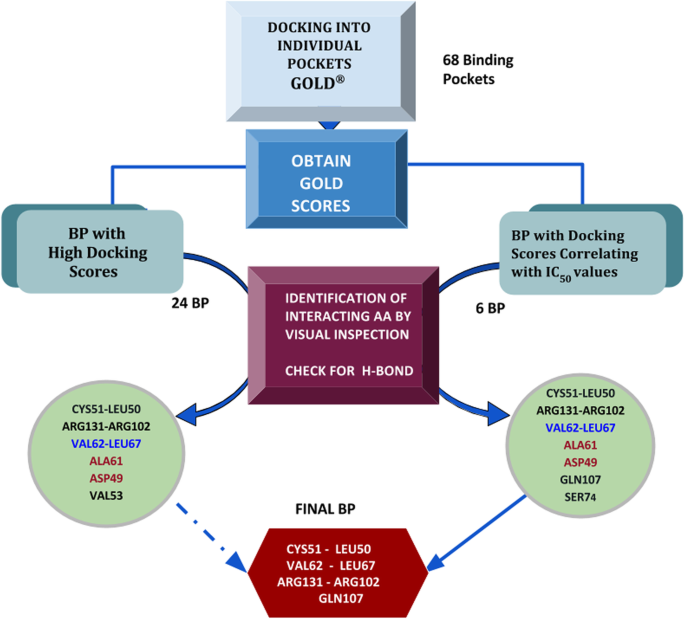
3.4 关键结合残基鉴定与结合口袋定位
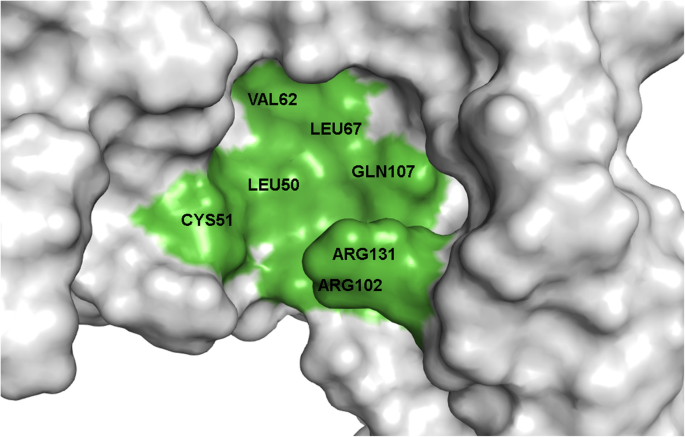
实验目的是明确E6上介导抑制剂结合的核心氨基酸残基,定义潜在的功能结合口袋。方法细节为对与IC50数据相关的6个口袋进行深入的相互作用分析,重点关注配体与氨基酸残基的氢键结合、疏水相互作用等关键相互作用类型。结果解读:最终鉴定出Cys51、Leu50、Arg102、Arg131、Leu67、Val62、Gln107为E6抑制剂结合的关键氨基酸残基;其中Cys51是所有抑制剂形成氢键结合的必需残基,Leu50则主要参与疏水相互作用,对高亲和力结合至关重要;杨梅素作为活性最高的抑制剂,还额外与Gln107形成氢键,这可能是其活性更高的结构基础。文献未提及具体实验产品,领域常规使用分子建模与可视化软件组合。
4. Biomarker研究及发现成果解析
本研究中涉及的Biomarker为HPV16 E6蛋白上的小分子抑制剂结合口袋,属于治疗性靶点Biomarker,通过系统的分子建模流程筛选并验证,为抗宫颈癌药物的研发提供了关键结构基础。
该Biomarker的类型为蛋白质结合口袋(由Cys51、Leu50等关键氨基酸残基构成),筛选与验证逻辑为“基于晶体结构的盲对接全面筛选潜在口袋→聚类去重与可视化分析缩小范围→精准对接结合实验IC50数据验证活性相关性→关键残基鉴定定义功能口袋”,逻辑链条完整,从全面筛选到精准验证,确保了结合口袋的功能相关性。
该Biomarker的来源为HPV16 E6的晶体结构(PDB:4GIZ),验证方法包括SwissDock盲对接、GOLD精准对接及Discovery Studio可视化分析;特异性方面,Cys51在21个高亲和力口袋中与至少4种配体发生相互作用,Leu50的出现频率接近Cys51,提示这两个残基是结合口袋的核心特异性位点;敏感性方面,与IC50数据相关的口袋中,杨梅素的GOLD评分最高,与其实验IC50=0.85μM的高活性一致,山奈酚的GOLD评分最低,与其实验IC50>40μM的低活性一致,显示出良好的敏感性。
该结合口袋的功能关联是作为HPV16 E6抑制剂的作用位点,通过结合抑制剂阻断E6与FADD的相互作用,恢复感染细胞的凋亡通路,从而发挥抗癌作用;创新性在于首次系统鉴定了HPV16 E6上与黄酮类抑制剂结合的关键氨基酸残基,填补了E6抑制剂结合位点解析的空白,为理性设计更高效的抗宫颈癌药物提供了结构基础;统计学结果方面,GOLD评分与IC50数据的相关性未明确给出P值,但趋势一致(n=6)。
