1. 领域背景与文献引入
文献英文标题:The role of hRev7, the accessory subunit of hPolζ, in translesion synthesis past DNA damage induced by benzo[a]pyrene diol epoxide (BPDE);发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:DNA损伤耐受与环境致癌物诱导的细胞应答
跨损伤合成(TLS)是细胞应对DNA损伤的核心防御机制之一,当经典复制聚合酶无法通过DNA损伤位点时,TLS聚合酶可介导复制继续进行,避免细胞死亡或基因组不稳定。领域发展关键节点包括1996年在酵母中首次发现DNA聚合酶ζ(Polζ)可通过胸腺嘧啶二聚体损伤,2000年鉴定出人类同源物hRev3(催化亚基)和hRev7(辅助亚基)。当前研究热点聚焦于TLS通路的多聚合酶协作机制,以及其在肿瘤发生、化疗耐药中的作用,但仍存在核心问题:不同TLS聚合酶在不同类型DNA损伤(尤其是环境致癌物诱导的损伤)中的具体分工尚未完全明确,hRev7作为hPolζ的辅助亚基在环境致癌物苯并芘诱导损伤中的功能仍属空白。
苯并芘是广泛存在的环境致癌物,其活性代谢物苯并芘二醇环氧化物(BPDE)可形成DNA加合物,诱导基因突变和肿瘤发生。前期研究已证实hRev7在紫外线(UV)诱导的DNA损伤应答中参与细胞存活、诱变和细胞周期进程,但BPDE诱导损伤中hRev7的作用及具体机制尚未阐明。本研究旨在填补这一空白,明确hRev7在BPDE诱导DNA损伤的跨损伤合成中的功能,为环境致癌物相关肿瘤的预防和治疗提供理论依据。
2. 文献综述解析
本文综述围绕TLS通路的分子机制、hPolζ的功能及不同DNA损伤类型的细胞应答展开,作者按损伤类型(UV、BPDE等)和TLS步骤(插入、延伸)对现有研究进行分类梳理。
现有研究表明,经典复制聚合酶具有严格的碱基配对选择性和3"→5"核酸外切酶校对活性,无法通过DNA损伤位点,而TLS聚合酶的活性中心较为宽松,可容纳损伤的DNA模板。酵母中Polζ负责大部分自发和DNA损伤诱导的突变,人类细胞中hRev3参与UV和BPDE诱导的诱变,hRev7作为hPolζ的辅助亚基,在UV损伤中参与细胞存活、诱变和S期进程。现有研究的优势在于明确了hPolζ在UV损伤中的关键作用,局限性在于缺乏对hRev7在环境致癌物诱导损伤中的具体功能研究,尤其是TLS不同步骤中的分工机制,且未验证hRev7对多种DNA损伤类型的通用性作用。
本研究的创新价值在于,首次针对BPDE这类环境致癌物诱导的DNA损伤,系统探究hRev7的功能,通过对比低表达hRev7细胞与对照细胞的存活、诱变和细胞周期进程,明确hRev7参与TLS的延伸步骤而非插入步骤,完善了多聚合酶协作的TLS机制,为理解环境致癌物诱导的肿瘤发生提供了新的分子视角。
3. 研究思路总结与详细解析
本研究的核心目标是明确hRev7在BPDE诱导DNA损伤的跨损伤合成中的功能及具体作用步骤,核心科学问题是hRev7是否参与BPDE诱导的细胞损伤耐受及诱变,以及其在TLS通路中的具体分工;技术路线采用“细胞模型构建→功能表型检测→机制解析→多损伤验证”的闭环逻辑,通过构建hRev7低表达细胞系,结合细胞存活、诱变分析、细胞周期检测等实验,逐步揭示hRev7的功能。
3.1 hRev7低表达细胞系构建与验证
实验目的是获得hRev7蛋白表达显著降低的人类成纤维细胞模型,为后续功能研究提供工具。方法细节为从永生化、端粒酶阳性的人成纤维细胞系9N.58出发,采用小干扰RNA(siRNA)技术构建2-2、2-6、2.5、3.2四个hRev7低表达细胞系,同时构建载体对照细胞系VCA、V1.1,以及hRev7回补细胞系2-2+R7(表达siRNA不敏感的hRev7 mRNA);采用免疫印迹(Western blot)检测各细胞系的hRev7蛋白表达水平,以Ku80作为内参蛋白校正上样量。结果解读显示,免疫印迹结果表明低表达细胞系的hRev7蛋白水平显著低于亲本细胞和载体对照细胞,回补细胞系的hRev7表达水平恢复至对照水平,证实细胞模型构建成功。
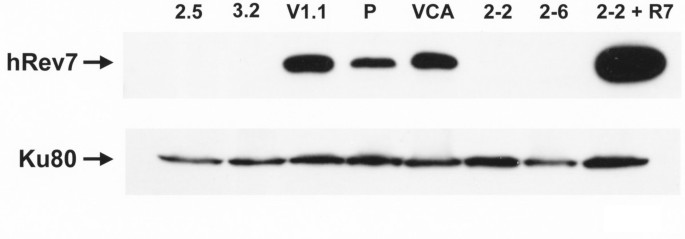
产品关联:文献未提及具体实验产品,领域常规使用siRNA转染试剂、免疫印迹抗体类试剂。
3.2 BPDE诱导的细胞存活能力检测
实验目的是探究hRev7对BPDE细胞毒性的影响,明确其在DNA损伤耐受中的作用。方法细节为将低表达细胞系、对照细胞系和回补细胞系以10000细胞/cm²的密度接种,贴壁16小时后暴露于不同浓度的BPDE,处理1小时后更换新鲜培养基,采用克隆形成实验检测细胞存活能力,通过计算克隆形成效率并与未处理对照归一化得到存活率。结果解读显示,在0.07μM BPDE处理后,亲本细胞和载体对照细胞的存活率约为80%,而hRev7低表达细胞的存活率仅为50%(文献未明确样本量,基于图表趋势推测),回补细胞系的存活率恢复至对照水平,表明hRev7缺失显著增加细胞对BPDE的敏感性,提示hRev7参与BPDE诱导DNA损伤的耐受。
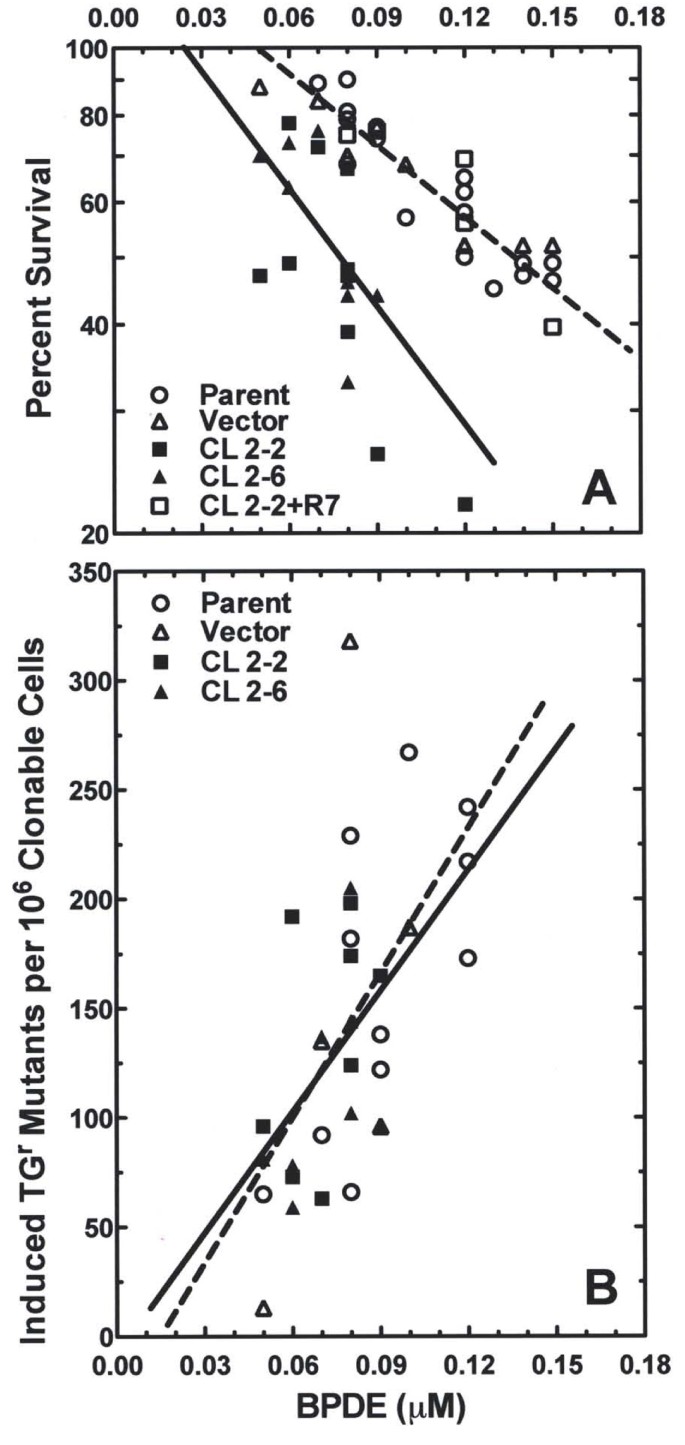
产品关联:文献提及BPDE购自Midwest Research Institute,克隆形成实验使用结晶紫染色,领域常规使用细胞培养基、磷酸盐缓冲液(PBS)、结晶紫染色液等。
3.3 BPDE诱导的HPRT基因突变频率与类型分析
实验目的是明确hRev7是否参与BPDE诱导的基因突变,探究其在TLS通路中的具体步骤。方法细节为细胞经BPDE处理后,维持指数生长8天以耗尽野生型次黄嘌呤鸟嘌呤磷酸核糖转移酶(HPRT)蛋白,随后采用40μM 6-硫代鸟嘌呤(TG)筛选HPRT基因突变的克隆,通过计算突变克隆数与存活细胞数的比例得到突变频率;对TG抗性克隆的HPRT cDNA进行扩增和测序,分析碱基替换类型,排除同源突变克隆。结果解读显示,hRev7低表达细胞的BPDE诱导突变频率与对照细胞无显著差异;突变类型分析显示,对照细胞中G→C突变占比为8/45,低表达细胞中为2/37,经Fisher精确检验,单侧P=0.084,无统计学差异,表明hRev7不参与BPDE诱导的核苷酸插入步骤,提示存在其他TLS聚合酶负责该步骤。
产品关联:文献未提及具体实验产品,领域常规使用PCR扩增试剂、基因测序平台、TG筛选试剂等。
3.4 BPDE处理后的细胞周期进程分析
实验目的是探究hRev7对BPDE诱导的细胞周期阻滞的影响,进一步明确其在DNA损伤应答中的作用。方法细节为将细胞同步化于G1/S期,释放后立即暴露于BPDE,处理1小时后每隔4小时收集细胞,采用70%乙醇固定,碘化丙啶(PI)染色后通过流式细胞术检测DNA含量,分析细胞周期各阶段的分布比例。结果解读显示,BPDE处理后8小时,对照细胞大部分完成S期进入G2期,而hRev7低表达细胞仍主要滞留在S期;12小时后对照细胞已完成细胞周期回到G1期,低表达细胞仍处于S期和G2期;16小时后对照细胞再次进入S期,低表达细胞才进入G1期,表明hRev7缺失导致BPDE处理后的S期进程显著延迟,提示hRev7参与DNA损伤后的复制恢复。
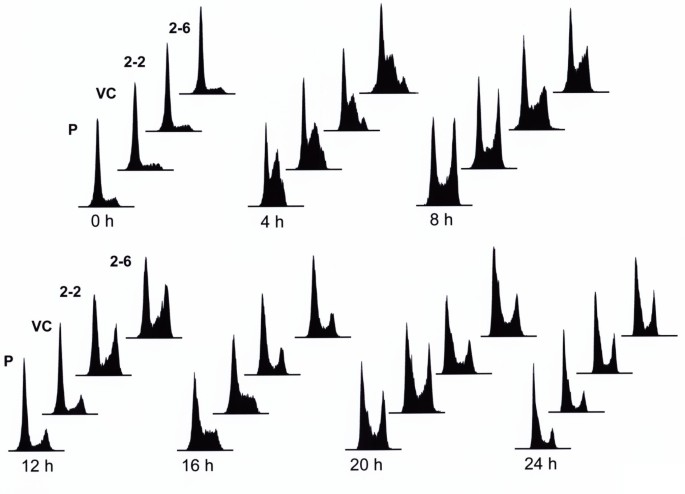
产品关联:文献使用流式细胞术在密歇根州立大学核心平台完成,领域常规使用PI染色液、流式细胞仪、细胞同步化试剂等。
3.5 多种DNA损伤剂的细胞存活验证
实验目的是验证hRev7对不同类型DNA损伤的作用,明确其功能的通用性。方法细节为将hRev7低表达细胞系和对照细胞系分别暴露于DNA交联剂顺铂、电离辐射(IR)、烷化剂N-甲基-N-羟基脲(MNU),采用克隆形成实验检测细胞存活能力。结果解读显示,hRev7低表达细胞对三种不同类型的DNA损伤剂的敏感性均显著高于对照细胞,表明hRev7参与多种DNA损伤类型的跨损伤合成,具有功能通用性。
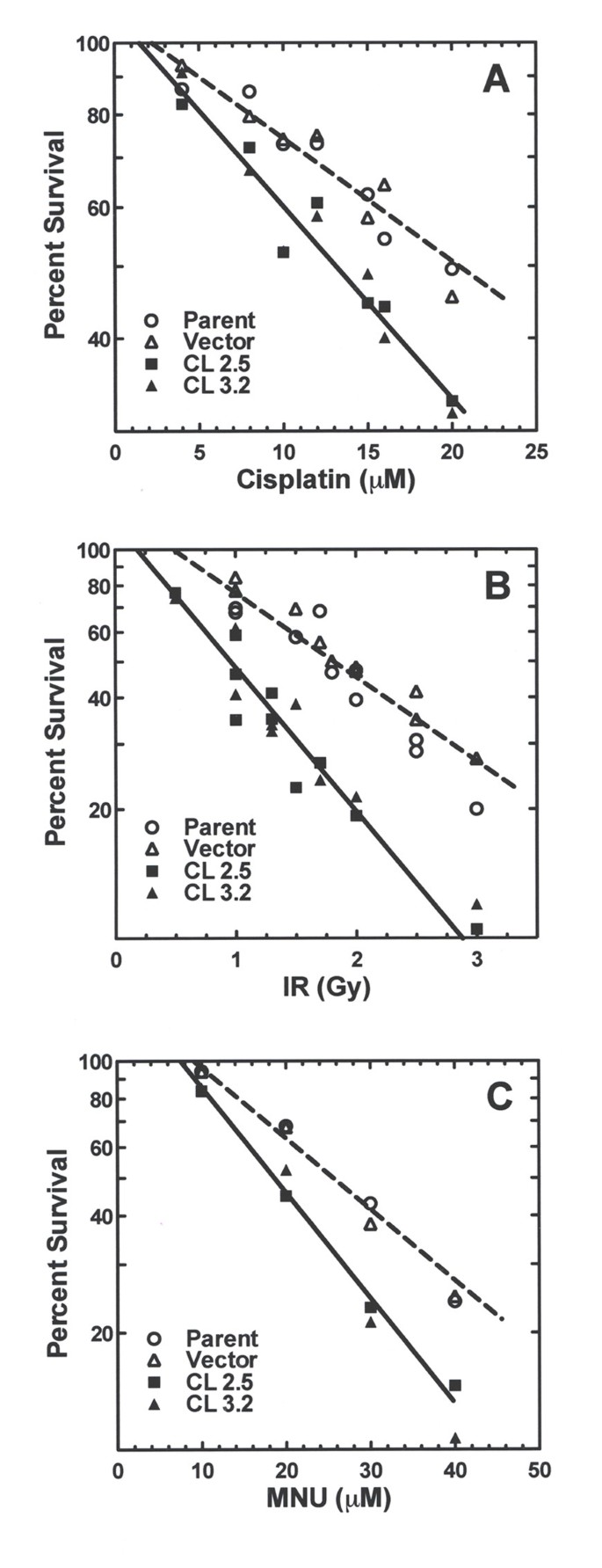
产品关联:文献提及顺铂购自American Pharmaceutical Partners Inc.,MNU购自Sigma,电离辐射采用60Co源,领域常规使用辐射源、细胞毒性检测试剂等。
4. Biomarker研究及发现成果解析
本研究中涉及的Biomarker为hRev7蛋白,属于DNA损伤耐受通路的功能调控分子,其筛选与验证逻辑为:基于前期UV损伤研究发现hRev7的功能→构建低表达细胞系→通过细胞存活、诱变、细胞周期实验验证其在BPDE损伤中的作用→结合突变类型分析明确其在TLS步骤中的分工→多种损伤剂验证其功能通用性。
Biomarker的来源为人类成纤维细胞的核蛋白,验证方法包括免疫印迹验证表达水平、克隆形成实验验证细胞存活能力、流式细胞术验证细胞周期进程、HPRT基因突变分析验证诱变作用。特异性方面,hRev7低表达细胞仅对DNA损伤剂的敏感性增加,对非DNA损伤剂无显著应答(引用前期研究);敏感性方面,0.07μM BPDE处理后,hRev7低表达细胞与对照细胞的存活率差异达30%(文献未明确AUC等数据)。
核心成果提炼:hRev7是BPDE诱导DNA损伤的跨损伤合成延伸步骤的必需分子,其缺失导致细胞S期进程延迟和细胞死亡增加,但不影响BPDE诱导的突变频率和类型;首次明确hRev7在环境致癌物诱导损伤中的具体TLS分工,即参与延伸步骤而非插入步骤,完善了多聚合酶协作的TLS机制;统计学结果显示,细胞存活实验中低表达细胞与对照细胞的差异具有统计学意义(回补实验验证),突变类型分析P=0.084无显著差异;该成果为理解环境致癌物诱导的肿瘤发生提供了新的分子靶点,为肿瘤预防中靶向TLS通路提供了理论依据。
