1. 领域背景与文献引入
文献英文标题:Rapid regulation of protein activity in fission yeast;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:裂变酵母(Schizosaccharomyces pombe)分子生物学(真核细胞蛋白质功能调控方向)。
裂变酵母作为经典模式生物,被广泛用于细胞周期、基因组稳定性及细胞形态等真核细胞过程的研究。尽管其具备完善的遗传、生化及细胞生物学工具,但缺乏快速、可逆且低背景的蛋白质活性调控方法,严重限制了蛋白质功能的动态研究。现有调控策略存在明显局限:①条件突变体(如温度敏感突变体)依赖温度变化,易引发细胞应激,且部分突变体在非许可温度下仍保留残留活性或失活后不可逆;②转录调控启动子(如nmt1)需消耗细胞内维生素库以解除抑制,诱导过程长达数代,且存在漏表达,对稳定蛋白质的“关闭”实验效率极低;③蛋白质降解标签(如degron)仍需温度刺激,可能影响目标蛋白的天然结构。
针对上述空白,本研究提出利用雌激素受体(ER)的激素结合域(HBD)构建融合蛋白的策略:将目标蛋白与ER HBD融合,无雌二醇时Hsp90复合物结合HBD抑制融合蛋白活性,添加雌二醇后HBD构象变化,释放Hsp90从而快速激活目标蛋白。该策略旨在实现蛋白质活性的“分钟级”调控,避免现有方法的间接性与延迟性,为裂变酵母研究提供新型工具。
2. 文献综述解析
文献综述以“现有蛋白质调控方法的局限性”为核心逻辑,系统评述了三类主流策略的优缺点:
1. 条件突变体(如温度敏感突变体):是研究必需蛋白功能的经典工具,但依赖温度变化会引发细胞应激,且部分突变体在非许可温度下仍保留残留活性,或失活后不可逆;
2. 转录调控启动子(如nmt1):虽能实现基因表达的开关,但诱导过程缓慢(需数代),且存在漏表达,无法满足快速调控需求;
3. 蛋白质降解标签(如degron):通过调控蛋白稳定性实现功能关闭,但仍需温度刺激,且可能影响目标蛋白的天然结构。
本研究的创新价值在于突破“间接调控”瓶颈:现有方法多通过调控转录或降解间接改变蛋白水平,而本研究直接调控蛋白质活性——通过HBD与目标蛋白的融合,利用雌二醇快速诱导构象变化,解除Hsp90的抑制,实现蛋白活性的“即开即关”。与现有方法相比,该系统具备三大优势:①快速性(分钟级激活);②可逆性(移除雌二醇后蛋白重新失活);③低背景(无雌二醇时融合蛋白几乎无活性,避免漏表达)。
3. 研究思路总结与详细解析
本研究以“ER HBD融合蛋白能否在裂变酵母中实现蛋白质活性的快速调控”为核心目标,选择4种功能不同的蛋白质(Cdc13-des2、Psf2、HO、Wee1)构建HBD融合体,通过生长表型、细胞周期分析及蛋白水平检测验证调控效果,技术路线遵循“构建融合蛋白→表型验证→机制确认”的闭环逻辑。
3.1 Cdc13-des2-HBD融合蛋白的构建与验证
实验目的:验证ER HBD标签能否调控非降解型细胞周期蛋白Cdc13(Cdc13-des2,缺失APC降解序列)的活性,避免细胞周期依赖的蛋白降解干扰。
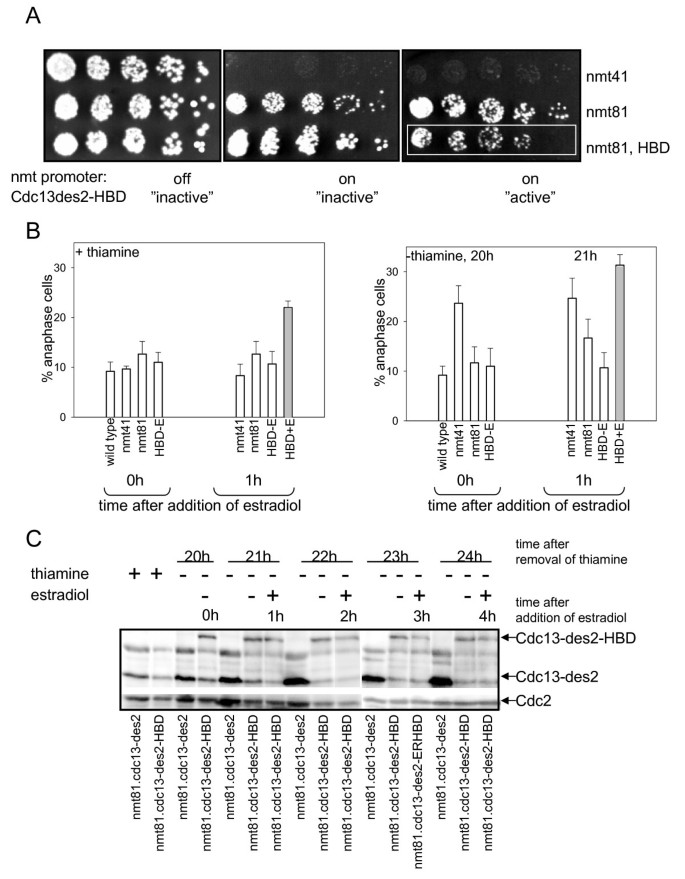
方法细节:通过PCR将cdc13-des2基因与ER HBD序列融合,插入弱启动子nmt81驱动的质粒pREP82中;将重组质粒转化裂变酵母,通过斑点实验(spot test)观察细胞在“有/无雌二醇”条件下的生长情况;诱导nmt81启动子后,通过计数中期指数(anaphase index)量化细胞周期延迟;采用免疫印迹(Western blot)检测Cdc13-des2-HBD的蛋白水平(使用SP4 anti-Cdc13抗体和anti-PSTAIRE抗体作为内参)。
结果解读:斑点实验显示,有雌二醇时(融合蛋白“激活”),表达Cdc13-des2-HBD的细胞生长显著受阻(图2A);中期指数分析表明,添加雌二醇1小时后,中期指数从野生型水平(约10%)升至与nmt41启动子驱动的Cdc13-des2相似的水平(约30%,n=3,P<0.01)(图2B);免疫印迹结果显示,雌二醇处理不影响Cdc13-des2-HBD的蛋白水平(排除转录调控的干扰)(图2C)。这些结果证明,ER HBD标签可通过雌二醇快速激活Cdc13-des2的活性,且调控效果优于nmt启动子的转录调控(无雌二醇时融合蛋白无活性,背景更低)。
实验所用关键产品:SP4 anti-Cdc13抗体、Santa Cruz的anti-PSTAIRE抗体。
3.2 Psf2-HBD融合蛋白的构建与验证
实验目的:验证ER HBD标签能否调控DNA复制必需蛋白Psf2(GINS复合物亚基)的活性,评估系统对染色体整合型蛋白的调控效果。
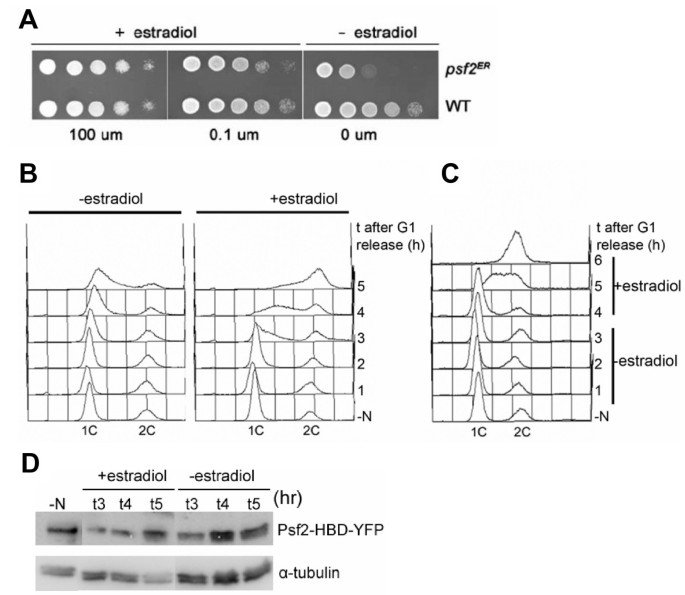
方法细节:通过PCR介导的基因靶向技术,将ER HBD序列整合至裂变酵母染色体的psf2+基因3’端(构建Psf2-HBD融合蛋白);观察单倍体细胞在“有/无雌二醇”条件下的生长表型;通过氮饥饿同步化细胞,释放后用流式细胞术检测DNA含量(SYTOX Green染色)分析DNA复制情况;免疫印迹检测Psf2-HBD的蛋白水平(抗YFP标签抗体)。
结果解读:生长表型显示,有雌二醇时Psf2-HBD细胞存活,无雌二醇时死亡(图3A);同步化实验中,无雌二醇时细胞DNA含量保持1C(未复制),添加雌二醇1小时后DNA快速复制(图3B);可逆性实验显示,无雌二醇处理4小时后添加雌二醇,细胞在1小时内启动DNA复制,6小时内完成(图3C);免疫印迹结果表明,雌二醇处理不影响Psf2-HBD的蛋白水平(图3D)。这些结果证明,ER HBD标签可有效调控染色体整合型Psf2的活性,且调控具有可逆性。
实验所用关键产品:流式细胞术试剂SYTOX Green、抗YFP标签抗体。
3.3 系统局限性分析
实验目的:验证ER HBD标签对不同功能蛋白的普适性,分析系统的局限性。
方法细节:构建HO-HBD(DNA内切酶)和Wee1-HBD(细胞周期激酶)融合蛋白,通过Southern blot检测HO的DNA切割活性,通过细胞形态观察和中期指数计数评估Wee1的调控效果。
结果解读:HO-HBD融合蛋白即使在有雌二醇时,DNA切割活性也极低(远低于未标签的HO);Wee1-HBD融合蛋白在无雌二醇时仍能诱导细胞周期延迟(细胞变长,中期指数升高),表明Hsp90无法有效抑制Wee1的激酶活性。局限性的可能原因:HO的内切酶活性依赖特定结构域,HBD融合可能破坏其活性;Wee1的激酶域无法被Hsp90复合物有效结合,导致融合蛋白无雌二醇时仍有活性。
文献未提及HO-HBD和Wee1-HBD实验的具体产品,领域常规使用Southern blot试剂(如限制性内切酶、探针)、细胞形态分析试剂(如DAPI)。
4. Biomarker研究及发现成果解析
本研究未涉及生物标志物(Biomarker)的筛选或验证,其核心成果为建立了一套基于ER HBD融合蛋白的裂变酵母蛋白质活性快速调控系统。该系统的关键特征包括:
① 快速性:雌二醇处理分钟级激活蛋白活性;
② 可逆性:添加/移除雌二醇实现蛋白活性的开关;
③ 低背景:无雌二醇时融合蛋白几乎无活性,避免漏表达;
④ 直接性:无需温度变化或转录调控,直接调控蛋白活性。
尽管系统对部分蛋白(如HO、Wee1)的调控效果不佳,但对Cdc13-des2和Psf2的有效调控证明,该系统可作为裂变酵母研究的新型工具,尤其适用于需要快速、可逆调控蛋白活性的实验(如细胞周期同步化、DNA复制机制研究)。
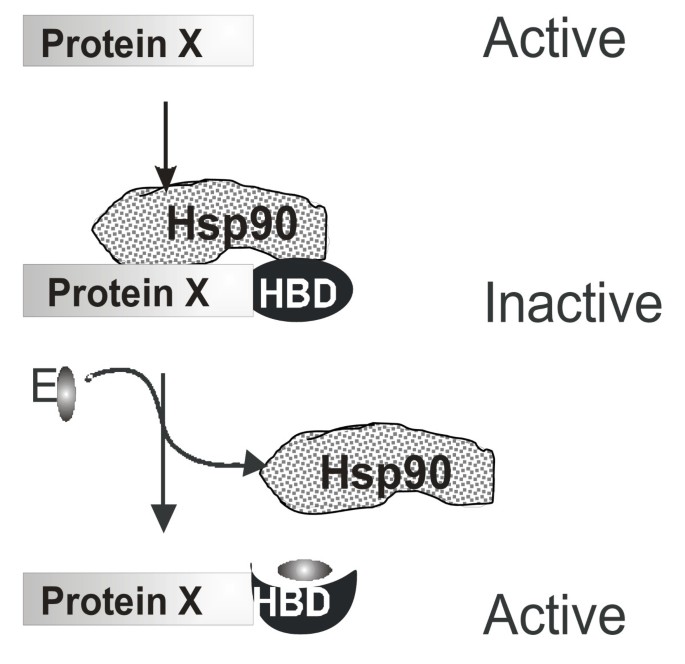
(图1:ER HBD融合蛋白的调控原理——无雌二醇时Hsp90抑制融合蛋白活性,添加雌二醇后释放Hsp90激活蛋白)
