1. 领域背景与文献引入
文献英文标题:Uncarboxylated osteocalcin promotes proliferation and metastasis of MDA-MB-231 cells through TGF-β/SMAD3 signaling pathway;发表期刊:BMC Molecular and Cell Biology;影响因子:未公开;研究领域:三阴性乳腺癌(TNBC)骨转移机制研究。
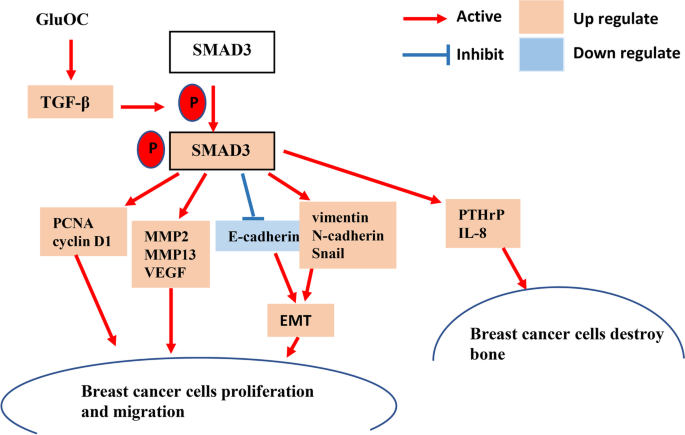
乳腺癌是全球女性最常见的恶性肿瘤,其中TNBC占15%-20%,因缺乏雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2(HER2)表达,对内分泌治疗和靶向治疗不敏感,易早期复发转移,骨转移是其主要死亡原因之一(患者生存期约18个月)。现有研究表明,肿瘤转移涉及多个关键过程:基质金属蛋白酶(MMPs)降解细胞外基质(ECM)、血管内皮生长因子(VEGF)促进血管生成、上皮-间质转化(EMT)增强细胞迁移能力,以及甲状旁腺激素相关蛋白(PTHrP)和白细胞介素-8(IL-8)诱导破骨细胞活化导致骨溶解。转化生长因子-β(TGF-β)/SMAD3信号通路是调控肿瘤增殖、转移的重要通路,通过磷酸化SMAD3(p-SMAD3)激活下游基因表达。此外,临床研究发现乳腺癌骨转移患者血清骨钙素( osteocalcin)水平显著升高,但未羧化骨钙素(GluOC,骨钙素的未完全羧化形式)对TNBC细胞增殖和转移的作用及机制尚未明确,这为本文的研究提供了核心切入点。
2. 文献综述解析
文献综述围绕“TNBC临床挑战→肿瘤转移关键机制→TGF-β/SMAD3通路作用→GluOC研究现状”的逻辑展开评述。作者首先强调TNBC因缺乏特异性靶点,治疗手段有限,骨转移是其预后差的核心原因;接着总结肿瘤转移的核心分子事件:MMPs降解ECM、VEGF促血管生成、EMT增强细胞迁移、PTHrP/IL-8诱导骨溶解;随后阐述TGF-β/SMAD3通路通过调控SMAD3磷酸化,参与肿瘤细胞增殖、转移及EMT过程;最后指出GluOC在前列腺癌、胰腺癌等癌症中具有促瘤作用,且乳腺癌骨转移患者血清骨钙素升高,但GluOC对TNBC的具体作用及机制尚未报道。
现有研究的关键结论包括:TGF-β/SMAD3通路是肿瘤转移的重要调控轴;GluOC与多种癌症的发展密切相关;乳腺癌骨转移患者血清骨钙素水平异常升高。其局限性在于未明确GluOC对TNBC细胞的功能影响及分子机制。本研究的创新价值在于首次证明GluOC通过TGF-β/SMAD3信号通路促进MDA-MB-231细胞增殖和转移,并上调PTHrP、IL-8等骨溶解相关因子的表达,为TNBC骨转移的治疗提供了新的潜在靶点。
3. 研究思路总结与详细解析
本研究的整体框架为:以TNBC高转移细胞系MDA-MB-231和低转移细胞系MCF7为模型,通过细胞实验明确GluOC的表型作用→利用分子技术解析TGF-β/SMAD3通路机制→通过抑制剂验证通路必要性。核心科学问题是“GluOC是否通过TGF-β/SMAD3通路调控TNBC细胞的增殖、转移及骨溶解相关因子表达”;技术路线形成“表型检测→机制探索→抑制剂验证”的闭环。
3.1 细胞模型选择与处理
实验目的是通过对比不同转移潜能的乳腺癌细胞系,明确GluOC的作用特异性。方法细节:选用MDA-MB-231(TNBC高转移细胞系)和MCF7(ER阳性低转移细胞系),细胞培养于含10%胎牛血清的DMEM培养基(Gibco),处理前用无血清培养基饥饿12 h,随后用不同浓度GluOC(10、20、40、100、160 ng/mL)处理。结果解读:MDA-MB-231细胞对GluOC处理更敏感,而MCF7细胞无明显响应,说明GluOC的作用具有“TNBC高转移细胞系特异性”。实验所用关键产品:细胞系购自中国科学院上海细胞库;胎牛血清(Gibco,cat. no. 10270–106)。
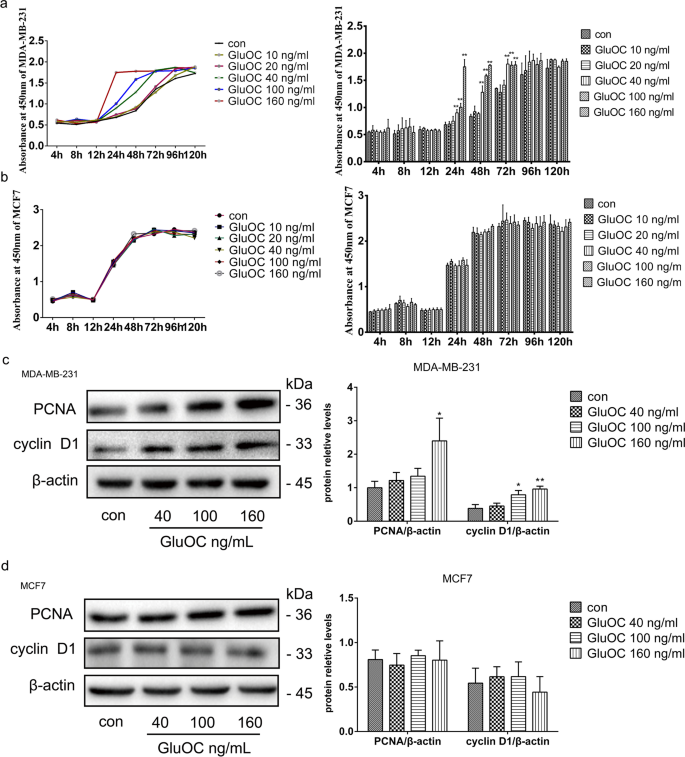
3.2 细胞增殖能力检测
实验目的是验证GluOC对乳腺癌细胞增殖的促进作用。方法细节:采用CCK8试剂盒(Dojindo,cat. no. CK04)检测不同浓度GluOC处理后(4、8、12、24、48、72、96、120 h)的细胞活力;通过Western blot检测增殖标志物增殖细胞核抗原(PCNA)和细胞周期蛋白D1(cyclin D1)的表达。结果解读:GluOC处理24 h后,MDA-MB-231细胞活力显著升高(100 ng/mL组活力较对照组增加约30%,n=3,P<0.05);Western blot显示,100、160 ng/mL GluOC处理后PCNA和cyclin D1表达分别上调2.1倍和1.8倍(n=3,P<0.01),而MCF7细胞中无明显变化。实验所用关键产品:PCNA抗体(Abcam,cat. no. ab92552);cyclin D1抗体(Cohesion,cat. no. CPA4263);β-actin抗体(Cell Signaling Technology,cat. no. 13E5);二抗(Lablead Biotech,cat. no. S0101、S0100)。
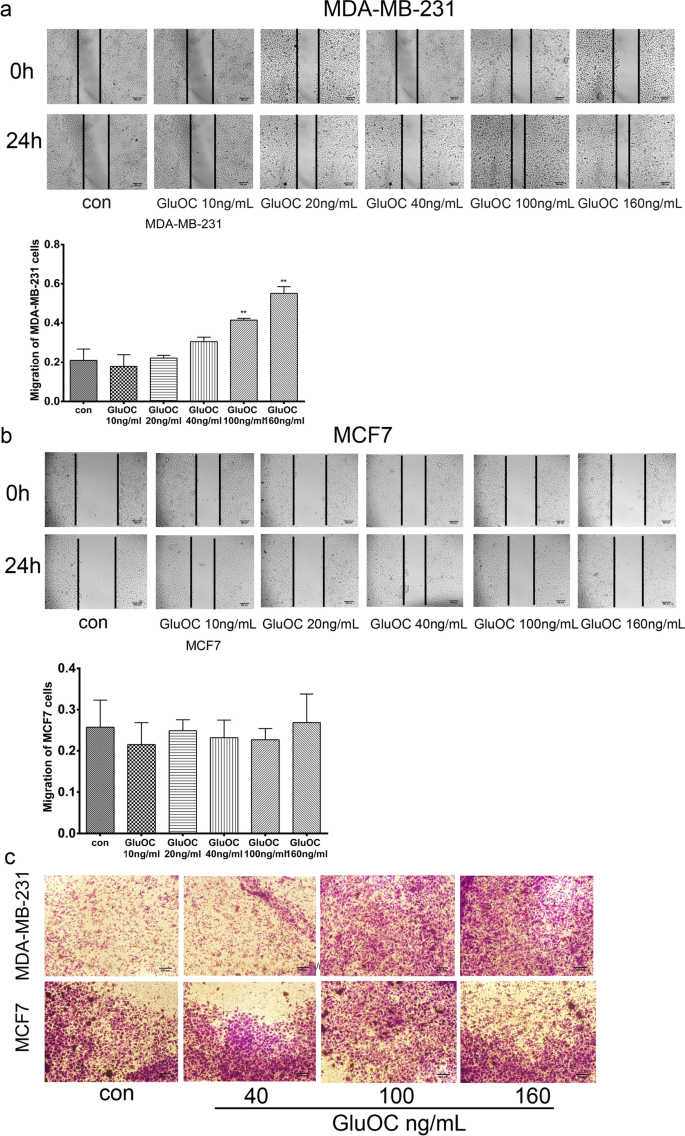
3.3 细胞迁移能力检测
实验目的是验证GluOC对乳腺癌细胞迁移的促进作用。方法细节:采用划痕实验(划痕后24 h计算伤口愈合率)和Transwell实验(检测细胞穿膜能力)。结果解读:划痕实验显示,100、160 ng/mL GluOC处理后,MDA-MB-231细胞伤口愈合率较对照组分别增加45%和60%(n=3,P<0.01);Transwell实验显示,GluOC处理组穿膜细胞数是对照组的2.5倍(160 ng/mL组,n=3,P<0.01),而MCF7细胞迁移能力无明显变化。实验所用关键产品:Transwell小室(Corning Costar);结晶紫溶液(Solarbio,cat. no. G1064)。
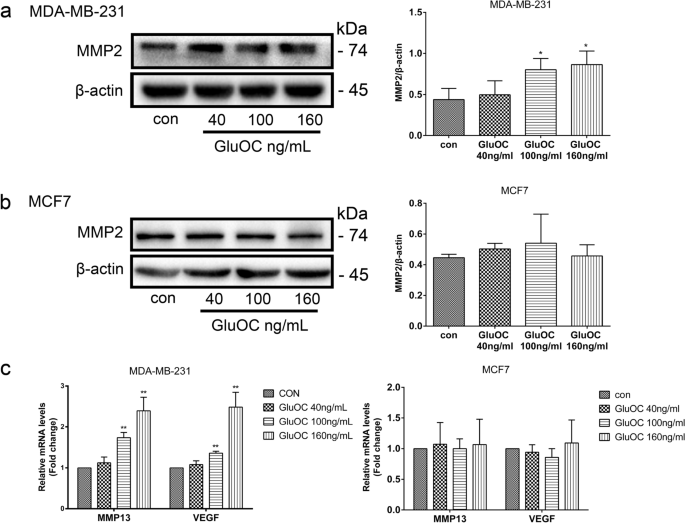
3.4 转移相关分子表达检测
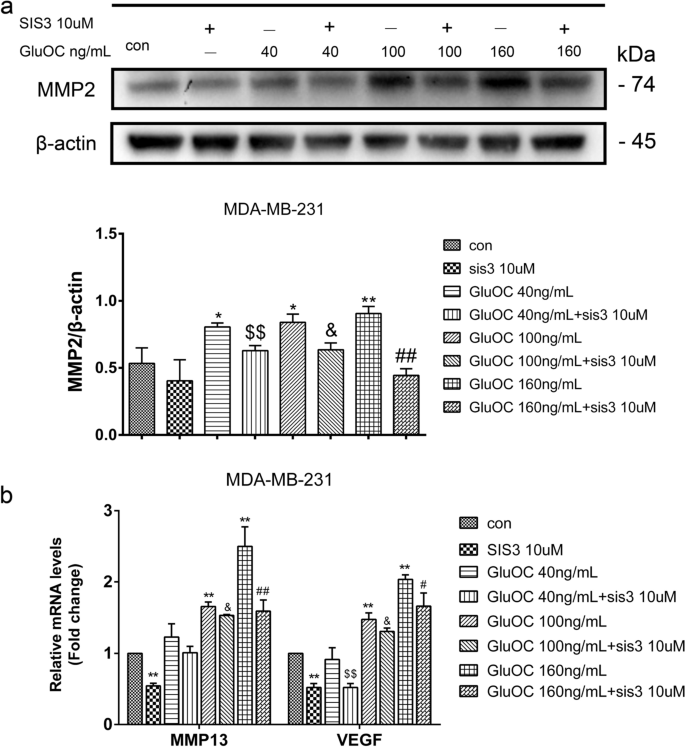
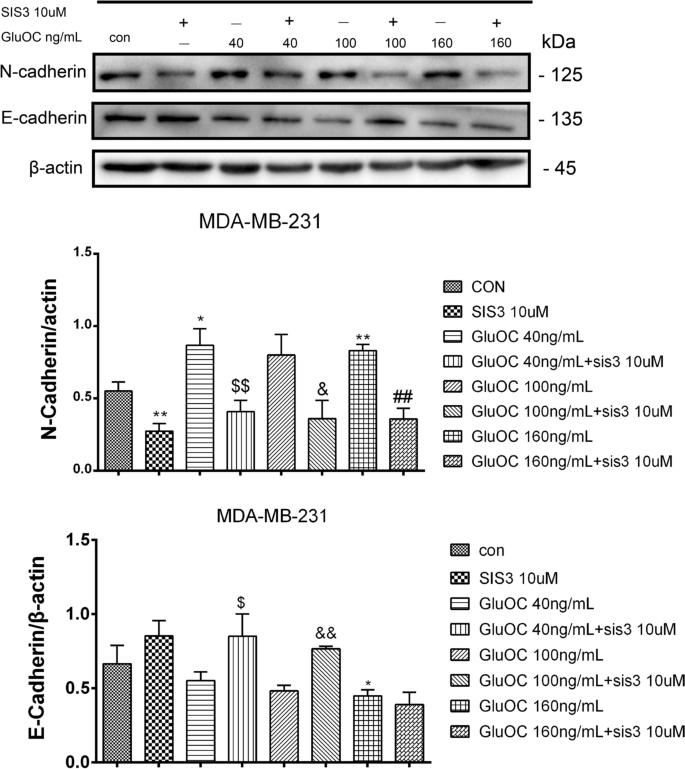
实验目的是探索GluOC促进迁移的分子机制。方法细节:通过Western blot检测MMP2的蛋白表达;qRT-PCR检测MMP13、VEGF的mRNA水平;Western blot检测EMT标志物(vimentin、N-cadherin、Snail、E-cadherin)的表达。结果解读:GluOC处理后,MDA-MB-231细胞中MMP2蛋白表达上调1.9倍(100 ng/mL组,n=3,P<0.05);MMP13和VEGF的mRNA水平分别升高2.3倍和1.7倍(n=3,P<0.01);EMT标志物中,vimentin、N-cadherin、Snail分别上调2.0倍、1.8倍、1.5倍,E-cadherin下调50%(n=3,P<0.01),而MCF7细胞中无明显变化。实验所用关键产品:MMP2抗体(Abcam,cat. no. ab2536);vimentin抗体(Abcam,cat. no. ab92547);N-cadherin抗体(Abcam,cat. no. ab76011);Snail抗体(Abcam,cat. no. ab216347);E-cadherin抗体(Abcam,cat. no. ab231303);qRT-PCR试剂盒(TransGen Biotech,cat. no. AQ132–24)。
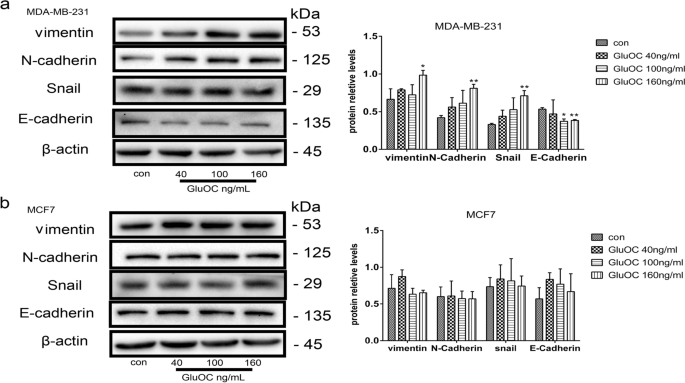
3.5 骨溶解相关因子检测
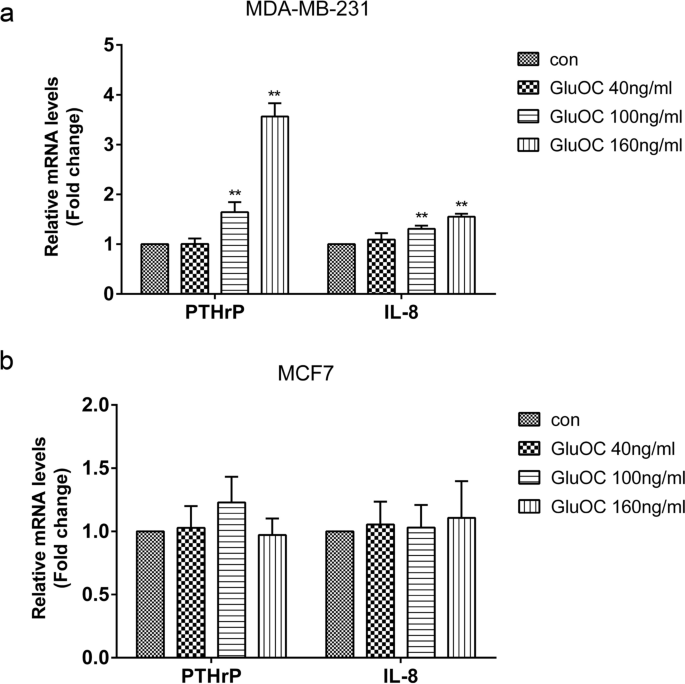
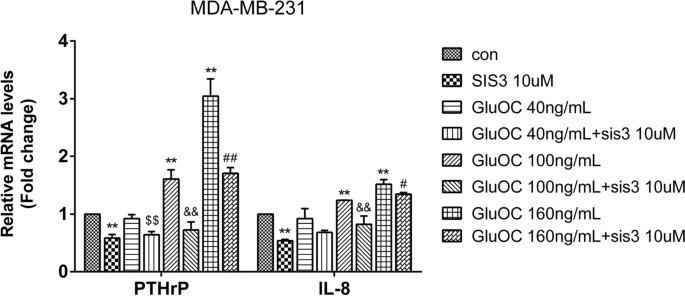
实验目的是明确GluOC对骨溶解相关因子的影响。方法细节:采用qRT-PCR检测PTHrP、IL-8的mRNA水平。结果解读:GluOC处理后,MDA-MB-231细胞中PTHrP和IL-8的mRNA水平分别升高2.1倍和1.8倍(100 ng/mL组,n=3,P<0.01),而MCF7细胞中无明显变化。实验所用关键产品:qRT-PCR试剂盒(TransGen Biotech,cat. no. AQ132–24)。
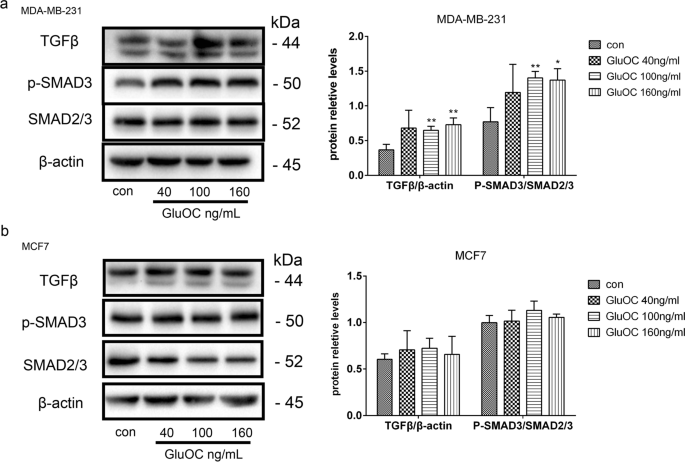
3.6 TGF-β/SMAD3通路激活检测
实验目的是验证GluOC对TGF-β/SMAD3通路的激活作用。方法细节:通过Western blot检测TGF-β、SMAD2/3总量及p-SMAD3的表达。结果解读:100、160 ng/mL GluOC处理后,MDA-MB-231细胞中TGF-β蛋白表达上调1.7倍(n=3,P<0.05);SMAD2/3总量无明显变化,但p-SMAD3表达增加2.2倍(n=3,P<0.01),而MCF7细胞中无明显变化。实验所用关键产品:TGF-β抗体(Abcam,cat. no. ab215715);SMAD2/3抗体(Abcam,cat. no. ab202445);p-SMAD3抗体(Abcam,cat. no. ab52903)。
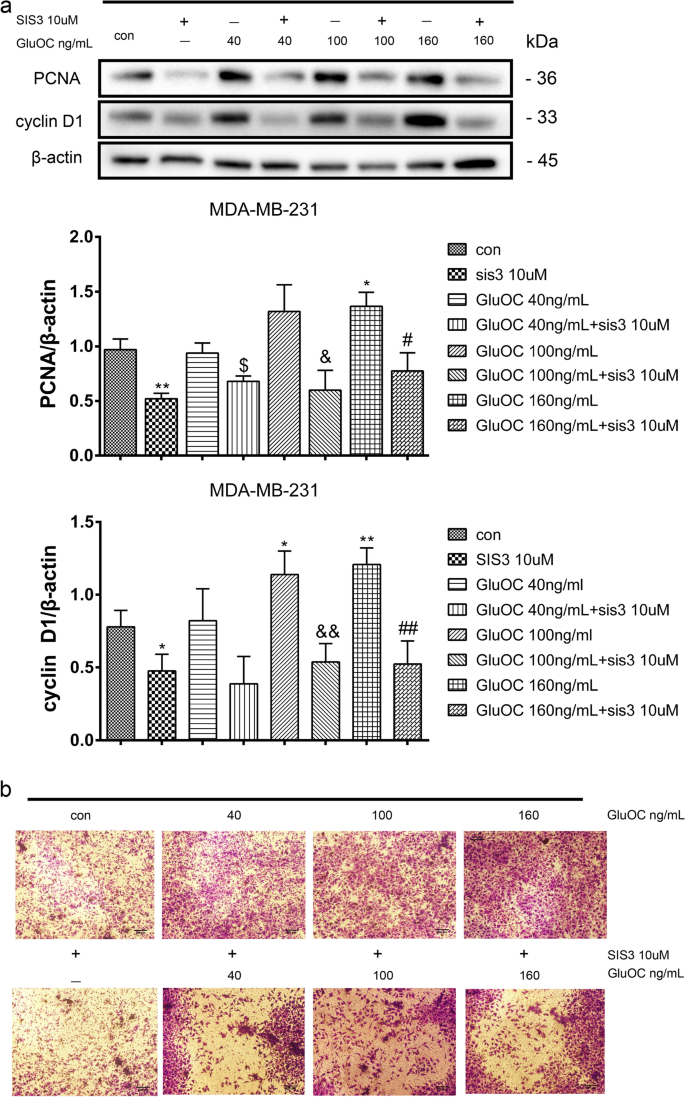
3.7 通路抑制剂验证
实验目的是确认GluOC的作用依赖于TGF-β/SMAD3通路。方法细节:用SMAD3磷酸化抑制剂SIS3(10 μM)处理MDA-MB-231细胞,分为“对照组、SIS3组、SIS3+GluOC(40、100、160 ng/mL)组”,处理24 h后通过Western blot检测增殖、转移及通路分子的表达,Transwell实验检测迁移能力。结果解读:SIS3处理后,GluOC诱导的PCNA、cyclin D1上调被逆转(100 ng/mL GluOC+SIS3组较GluOC组降低40%,n=3,P<0.05);MMP2、MMP13、VEGF的表达也被抑制(MMP2较GluOC组降低50%,n=3,P<0.01);Transwell实验显示,SIS3+GluOC组穿膜细胞数较GluOC组减少60%(n=3,P<0.01);同时,p-SMAD3的表达较GluOC组降低70%(n=3,P<0.01)。实验所用关键产品:SIS3(TargetMoL,cat. no. T3636);DMSO(Macklin Biochemical,cat. no. D6258)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究的核心Biomarker为未羧化骨钙素(GluOC),类型为“循环蛋白类Biomarker”(源于血清骨钙素的未完全羧化形式)。其筛选与验证逻辑为:临床现象(乳腺癌骨转移患者血清骨钙素升高)→细胞表型验证(GluOC促进MDA-MB-231增殖、转移)→分子机制解析(激活TGF-β/SMAD3通路)→抑制剂验证(SIS3阻断通路后作用消失),形成完整的“临床-细胞-分子”验证链条。
研究过程与数据
Biomarker来源:临床血清样本(文献提及乳腺癌骨转移患者血清骨钙素水平显著升高);验证方法:细胞活力检测(CCK8)、迁移实验(划痕、Transwell)、分子表达检测(Western blot、qRT-PCR)及抑制剂验证(SIS3)。
- 特异性:GluOC仅对TNBC高转移细胞系MDA-MB-231有显著作用,对低转移细胞系MCF7无明显影响;
- 敏感性:GluOC在40 ng/mL及以上浓度时即可显著促进细胞增殖(n=3,P<0.05),100 ng/mL时作用最显著;
- 量化数据:GluOC处理后,p-SMAD3表达增加2.2倍(n=3,P<0.01),PTHrP和IL-8的mRNA水平分别升高2.1倍和1.8倍(n=3,P<0.01);SIS3处理后,GluOC诱导的增殖、转移及分子表达均被逆转(p-SMAD3较GluOC组降低70%,n=3,P<0.01)。
核心成果与创新
本研究首次揭示GluOC作为TNBC骨转移的潜在治疗靶点,其核心功能是通过激活TGF-β/SMAD3信号通路,调控以下生物学过程:
1. 促进增殖:上调PCNA、cyclin D1的表达;
2. 促进转移:增加MMPs(MMP2、MMP13)、VEGF的表达,诱导EMT(vimentin、N-cadherin、Snail上调,E-cadherin下调);
3. 诱导骨溶解:上调骨溶解相关因子PTHrP、IL-8的表达。
这些结果为TNBC骨转移的治疗提供了新的靶点方向——通过抑制GluOC或TGF-β/SMAD3通路,有望抑制TNBC的骨转移进程。