1. 领域背景与文献引入
文献英文标题:Molecular targets and signaling pathways regulated by nuclear translocation of syndecan-1;发表期刊:BMC Cell Biology;影响因子:3.417(2017年);研究领域:肿瘤细胞生物学(纤维肉瘤中 Syndecan-1 核转位的功能机制)。
Syndecan-1 是一类跨膜硫酸乙酰肝素蛋白聚糖(HSPG),作为生长因子、细胞因子的共受体,调控细胞增殖、迁移、黏附等功能。其亚细胞定位对功能至关重要——除细胞膜外,Syndecan-1 可通过胞质域的 RMKKK 核定位信号(NLS)转位至核,但核内功能尚不明确。此前研究构建了表达全长 Syndecan-1(FLs1,可核转位)和缺失 NLS 的突变体(NLSdel,不可核转位)的纤维肉瘤细胞系,发现 FLs1 能核转位但 NLSdel 不能,但核转位的分子机制和功能未阐明。领域空白在于:核 Syndecan-1 对肿瘤细胞增殖、周期的调控机制,及涉及的分子靶点和信号通路不清楚。
本研究旨在用 FLs1/NLSdel 模型结合多组学与功能实验,分离核与细胞膜功能,解析核 Syndecan-1 的功能及分子机制,为阐明其亚细胞定位与肿瘤细胞命运的关联提供证据。
2. 文献综述解析
作者梳理现有研究框架:① 亚细胞定位的功能差异:细胞膜 Syndecan-1 作为共受体传递信号,核内 Syndecan-1 调控转录或染色质修饰;② 核转位的结构基础:RMKKK 基序是核定位关键,缺失则阻断核转位;③ 核内功能的现有证据:核 Syndecan-1 抑制组蛋白乙酰转移酶(HAT)、调控转录因子(如 NFκβ)。
现有研究的局限:① 未区分核与细胞膜功能,难以明确核转位的特异性作用;② 缺乏核转位对肿瘤增殖、周期的系统机制解析;③ 未系统鉴定核 Syndecan-1 的分子靶点。
本文创新点:利用 FLs1/NLSdel 模型分离核与细胞膜功能,结合多组学与功能实验,首次解析核 Syndecan-1 抑制增殖、诱导周期阻滞的分子机制,鉴定出 EGR1、NEK11、DOCK8 等靶点及 TGF-β 通路的核心作用。
3. 研究思路总结与详细解析
本研究目标是阐明核 Syndecan-1 对纤维肉瘤细胞增殖、周期的调控机制及分子靶点,核心科学问题是“核 Syndecan-1 通过哪些分子靶点和信号通路抑制增殖、诱导周期阻滞”。技术路线为:构建细胞模型→功能表型分析→多组学筛选靶点→验证靶点→解析信号通路→总结机制。
3.1 细胞模型构建与验证
实验目的:获得 Syndecan-1 表达一致但核转位能力不同的细胞系,分离核与细胞膜功能。
方法细节:将 FLs1、NLSdel 及空载体质粒稳定转染至 B6FS 细胞;通过 FACS 和 Western blot 验证 Syndecan-1 表达(要求为对照的 1.5-2 倍);免疫细胞化学(抗 Syndecan-1 抗体+Alexa 488 二抗,核染用 Bisbenzimide H33342)验证亚定位。
结果解读:FLs1 和 NLSdel 细胞的 Syndecan-1 水平为对照的 1.5-2 倍(n=3,P<0.05);免疫染色显示 FLs1 定位于核,NLSdel 定位于胞质/细胞膜,成功构建模型。
实验所用关键产品:抗 Syndecan-1 抗体(Santa Cruz,SC-7099)、Alexa 488 二抗(Molecular Probes,A-11001)。
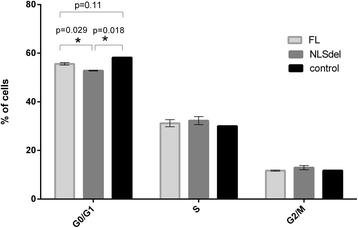
3.2 增殖与细胞周期分析
实验目的:明确核 Syndecan-1 对增殖、周期的影响。
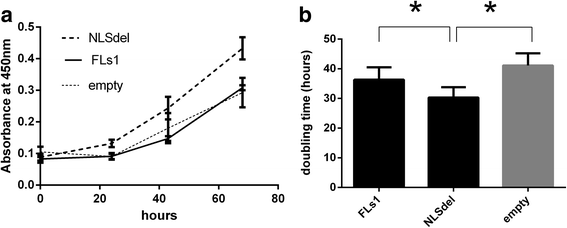
方法细节:① 增殖实验:WST-1 法检测 FLs1、NLSdel 及空载体细胞的吸光度(450nm),计算倍增时间;② 周期分析:PI 染色后流式检测细胞周期分布(10000 细胞/样本)。
结果解读:① NLSdel 细胞的倍增时间显著短于 FLs1(32.3h vs 38.9h,n=3,P=0.018),提示核 Syndecan-1 抑制增殖;② FLs1 细胞的 G0/G1 期比例显著高于 NLSdel(n=3,P≤0.05),提示核 Syndecan-1 诱导 G1/S 阻滞。
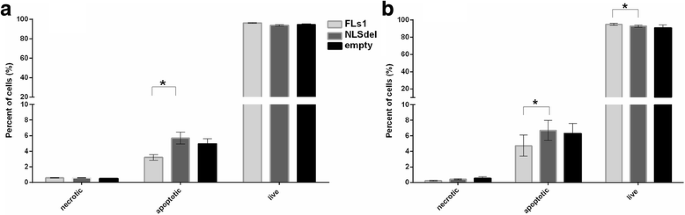
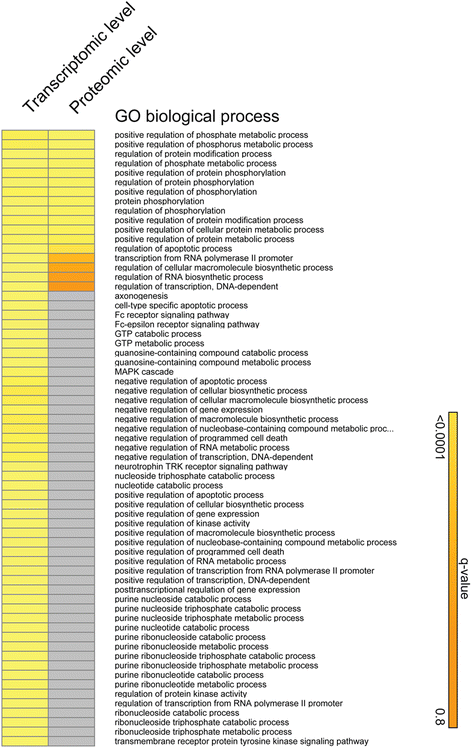
3.3 转录组与蛋白质组学分析
实验目的:筛选核 Syndecan-1 调控的差异基因和蛋白,鉴定分子靶点。
方法细节:① 转录组:Affymetrix 芯片检测基因表达,OCplus 差异分析(fold change > |1.5|,q < 0.05);② 蛋白质组:TMT-10plex 标记、HiRIEF 分离后 LC-MS/MS 分析,Proteome Discoverer 鉴定蛋白(FDR < 1%);③ 验证:RT-qPCR 验证差异基因(EGR1、NEK11、DOCK8)。
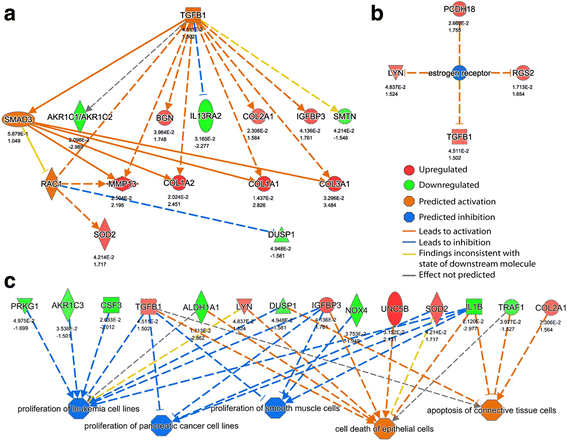
结果解读:① 转录组显示 FLs1 与 NLSdel 有 20 个差异基因,其中 EGR1、NEK11、DOCK8 经 RT-qPCR 验证显著上调(n=3,P<0.05);② 蛋白质组鉴定 8963 蛋白,IPA 发现 TGF-β 通路被激活(Z-score=2.62,P=1.42e-06);③ 差异基因参与周期调控,差异蛋白参与信号转导。
实验所用关键产品:Affymetrix 芯片、TMT-10plex 试剂(Thermo)、Q Exactive 质谱仪(Thermo)。
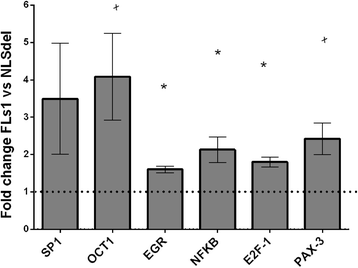
3.4 转录因子活性检测
实验目的:检测核 Syndecan-1 对增殖相关转录因子的影响。
方法细节:提取核提取物,用 TranSignal 阵列检测 20 种转录因子的 DNA 结合活性,计算 FLs1 与 NLSdel 的信号比值(阈值 1.5 倍)。
结果解读:核 Syndecan-1 显著激活 NFκβ、E2F-1、EGR1(fold change > 1.5,n=3,P<0.05),OCT-1、Pax-3、Sp1 有变化但不显著。提示核 Syndecan-1 通过激活多个转录因子协同调控增殖和周期。
4. Biomarker 研究及发现成果解析
本研究的 Biomarker 为核 Syndecan-1 调控的分子靶点(EGR1、NEK11、DOCK8),其功能与机制如下:
4.1 Biomarker 定位与筛选逻辑
EGR1、NEK11、DOCK8 是“转录组芯片筛选→RT-qPCR 验证”得到的核 Syndecan-1 特异性靶点。筛选逻辑:① 基于 FLs1/NLSdel 的转录组差异,筛选核 Syndecan-1 调控的基因;② 选择与增殖、周期直接相关的基因(EGR1 调控 G0/G1 转换,NEK11 参与 DNA 损伤响应,DOCK8 调控细胞分裂)验证。
4.2 研究过程详述
- 来源:纤维肉瘤细胞的转录组数据;
- 验证方法:RT-qPCR(GAPDH 为内参);
- 特异性:EGR1、NEK11、DOCK8 在 FLs1 中的表达显著高于 NLSdel(fold change 2.3、1.8、1.6,n=3,P<0.05),是核 Syndecan-1 的特异性靶点。
4.3 核心成果提炼
- 功能关联:EGR1 诱导 G0/G1 阻滞,NEK11 诱导 G2/M 阻滞,核 Syndecan-1 通过上调这些基因抑制增殖;
- 创新性:首次鉴定核 Syndecan-1 调控的靶点及 TGF-β 通路的作用;
- 统计学结果:EGR1(fold change=2.3,P=0.02)、NEK11(1.8,P=0.03)、DOCK8(1.6,P=0.04)。
本研究通过系统解析核 Syndecan-1 的功能和分子靶点,明确了其“抑制增殖、诱导周期阻滞”的机制,为 Syndecan-1 亚细胞定位与肿瘤细胞命运的关联提供了关键证据,也为肿瘤治疗靶点选择提供了新方向。
