1. 领域背景与文献引入
文献英文标题:EHMT2 promotes the pathogenesis of hepatocellular carcinoma by epigenetically silencing APC expression;发表期刊:Cell & Bioscience;影响因子:5.7(2021年);研究领域:肝细胞癌的表观遗传调控与信号通路机制。
肝细胞癌(HCC)是全球第二大癌症死亡原因,中国每年新增病例和死亡人数均占全球一半以上(2009-2011年平均年 incidence 466,100例,死亡422,100例)。由于发病机制复杂(涉及病毒感染、酒精性肝硬化、非酒精性脂肪性肝炎等多因素),早期诊断困难,5年相对生存率仅10.1%,且缺乏针对性有效疗法。Wnt–β-catenin通路是HCC发病的关键驱动因素:40–70%的HCC患者存在β-catenin核积累,但部分病例无CTNNB1(β-catenin编码基因)、APC(腺瘤性息肉病 coli)或AXIN1突变,其激活机制尚未完全阐明。
EHMT2(又称G9a)是一种组蛋白赖氨酸甲基转移酶,可催化组蛋白H3K9单甲基化(H3K9me1)和二甲基化(H3K9me2),通过表观沉默抑癌基因参与肿瘤发生。已有研究显示EHMT2在食管癌、肺癌、卵巢癌等中高表达,与不良预后相关,但在HCC中的作用及与Wnt通路的关联尚未明确。此外,EHMT2特异性抑制剂UNC0642在黑色素瘤、膀胱癌等中显示抗瘤活性,但在HCC中的疗效及机制未被探索。本研究旨在揭示EHMT2在HCC中的表达特征、临床意义及分子机制,为HCC的靶向治疗提供新靶点。
2. 文献综述解析
作者通过三类研究维度梳理领域现状:EHMT2在肿瘤中的作用、Wnt通路在HCC中的激活机制、EHMT2抑制剂的抗肿瘤潜力。
现有研究总结
- EHMT2与肿瘤的关联:EHMT2在多种肿瘤(如食管癌、肺癌、卵巢癌)中高表达,通过表观沉默抑癌基因(如RARRES3、LATS2)促进细胞增殖、转移;其表达水平与患者不良预后正相关,但在HCC中的功能尚未报道。
- Wnt通路在HCC中的作用:Wnt–β-catenin通路激活是HCC发生的核心事件,可促进 Myc、CCND1等靶基因表达,但约30%的HCC无经典突变(CTNNB1/APC/AXIN1),通路激活的非突变机制待阐明。
- EHMT2抑制剂的研究:UNC0642等EHMT2抑制剂可通过降低H3K9me2水平,抑制黑色素瘤、膀胱癌等细胞增殖,但在HCC中的疗效及依赖性未被验证。
研究创新与必要性
现有研究的局限性:① EHMT2在HCC中的表达特征、临床意义及分子机制未知;② Wnt通路在HCC中的非突变激活机制未完全阐明;③ EHMT2抑制剂在HCC中的作用及靶点未明确。本研究的创新点:① 首次证实EHMT2通过表观沉默APC(Wnt通路负调控因子)激活Wnt–β-catenin通路,促进HCC发生;② 首次报道EHMT2抑制剂UNC0642通过靶向EHMT2发挥抗HCC作用,且疗效依赖于EHMT2的表达。
3. 研究思路总结与详细解析
本研究采用“表达特征-临床意义-功能验证-机制探索-靶点验证”的闭环逻辑,逐步揭示EHMT2在HCC中的作用及机制。以下按关键实验环节解析:
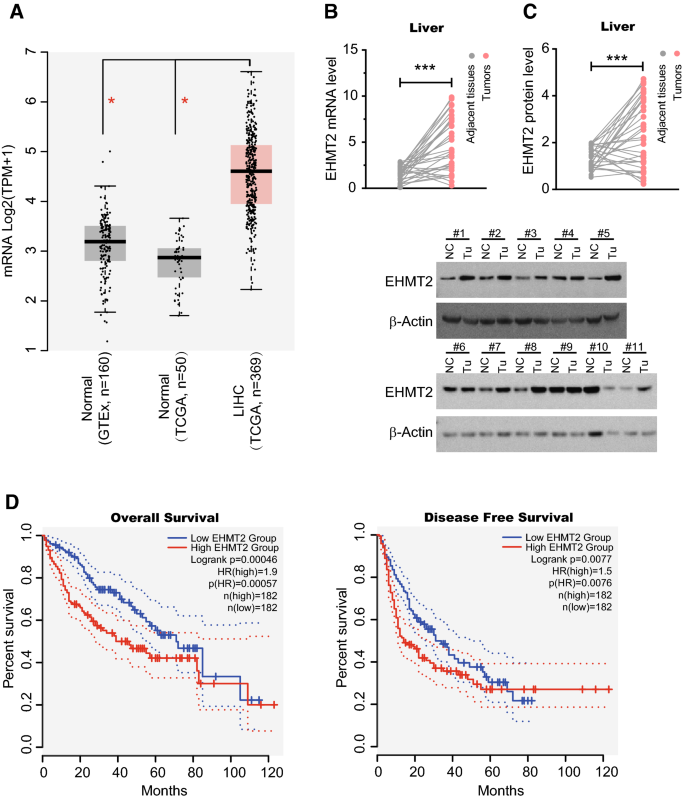
3.1 EHMT2在肝癌中的表达及临床意义
实验目的:明确EHMT2在HCC中的表达差异及临床预后价值。
方法细节:① 利用TCGA(肿瘤n=369,正常n=50)和GTEx(正常n=160)数据库分析EHMT2 mRNA水平;② 收集33例HCC患者的肿瘤及癌旁正常组织,通过RT-qPCR(Takara试剂盒)和Western blot(Cell Signaling Technology的EHMT2抗体#3306)检测mRNA及蛋白表达;③ 以EHMT2 mRNA中位数为 cutoff,用GEPIA工具分析总生存(OS)和无病生存(DFS)。
结果解读:① TCGA/GTEx分析显示,HCC中EHMT2 mRNA水平显著高于正常组织(p<0.01);② 临床样本中,EHMT2 mRNA(n=31,p<0.001)及蛋白(n=31,p<0.001)水平均显著高于癌旁;③ 高EHMT2表达预示不良OS(HR=1.9,p=0.00057)和DFS(HR=1.5,p=0.0076),尤其在iClust2/3亚型中OS的HR>2.7(p<0.05)。
产品关联:实验所用关键产品包括Cell Signaling Technology的EHMT2抗体(#3306)、Takara的RT-qPCR试剂盒(RR036B、RR430B)。
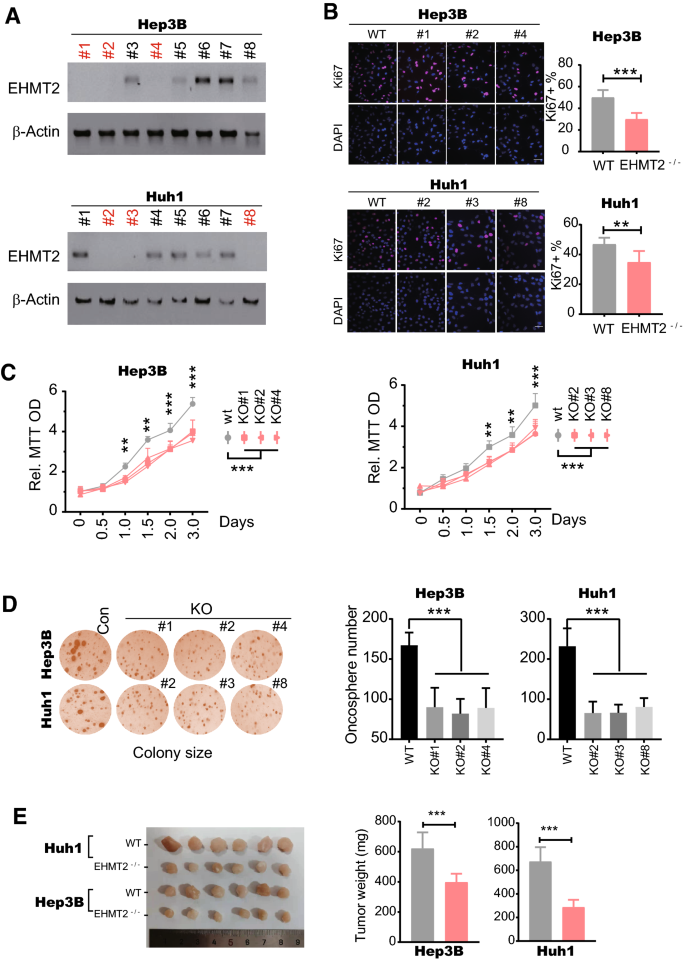
3.2 EHMT2对肝癌细胞增殖与肿瘤发生的影响
实验目的:验证EHMT2对HCC细胞增殖及体内肿瘤发生的必要性。
方法细节:① 用CRISPR/Cas9技术构建EHMT2基因敲除(EHMT2−/−)的Hep3B和Huh1细胞系(pX459质粒转染,sgRNA序列靶向EHMT2,嘌呤霉素筛选单克隆);② 通过Ki67免疫荧光(Proteintech抗体27309-1-AP)、MTT、软琼脂克隆形成实验检测细胞增殖;③ 裸鼠异种移植实验(n=6/组)检测体内肿瘤生长。
结果解读:① EHMT2−/−细胞的Ki67阳性率显著降低(Hep3B:p<0.01;Huh1:p<0.001);② MTT显示EHMT2−/−细胞生长速度较野生型减慢(1.0–1.5天开始,p<0.05);③ 软琼脂克隆形成能力显著下降(p<0.001);④ 异种移植肿瘤重量减轻(p<0.001)。
产品关联:实验所用关键产品包括New England Biolabs的BbsI酶(R0539V)、ThermoFisher的嘌呤霉素(A1113803)、Proteintech的Ki67抗体(27309-1-AP)。
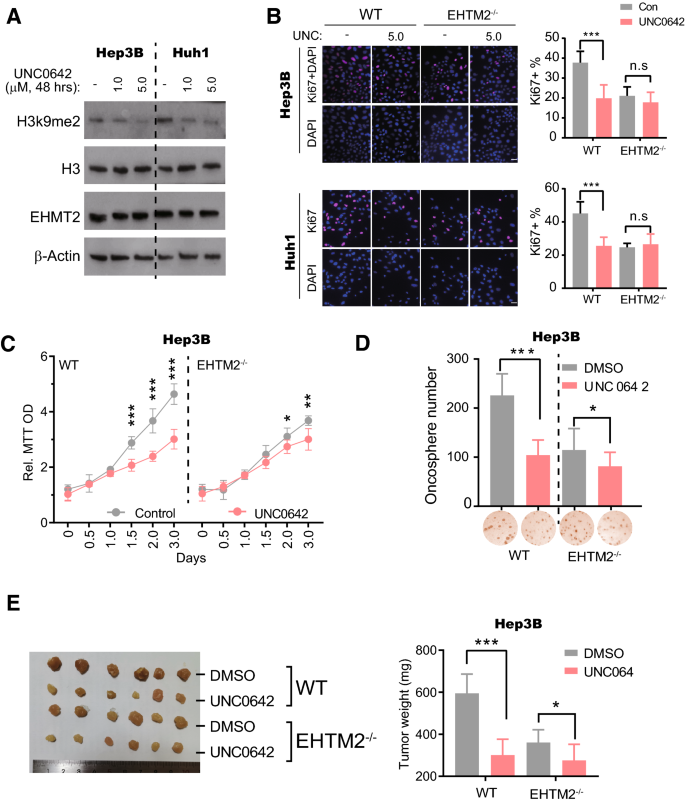
3.3 EHMT2抑制剂UNC0642的抗肝癌作用
实验目的:验证UNC0642对HCC的抑制作用及对EHMT2的依赖性。
方法细节:① 用1.0μM UNC0642处理野生型和EHMT2−/−细胞48h,Western blot检测H3K9me2水平(ThermoFisher抗体49-1007);② 通过Ki67免疫荧光、MTT、软琼脂实验检测细胞增殖;③ 裸鼠异种移植实验(5mg/kg UNC0642腹腔注射,n=6/组)检测体内疗效。
结果解读:① UNC0642可降低H3K9me2水平(不影响EHMT2蛋白);② 野生型细胞的Ki67阳性率显著降低(p<0.001),但EHMT2−/−细胞无显著变化;③ 野生型细胞生长被显著抑制(p<0.05),EHMT2−/−细胞的抑制作用减弱;④ 异种移植肿瘤重量显著减轻(野生型:p<0.001;EHMT2−/−:p<0.05)。
产品关联:实验所用关键产品包括ThermoFisher的H3K9me2抗体(49-1007)、Cell Signaling Technology的β-Actin抗体(#3700)。
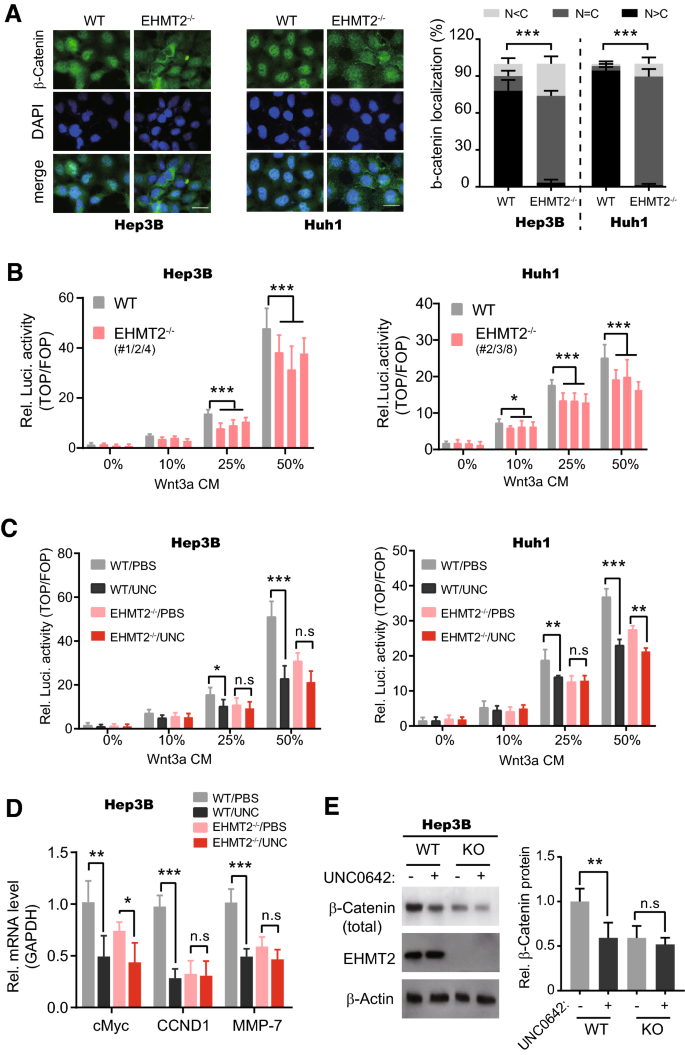
3.4 EHMT2对Wnt–β-catenin通路的调控
实验目的:探索EHMT2对Wnt通路活性的影响。
方法细节:① 免疫荧光(Cell Signaling Technology的β-catenin抗体#8480)检测β-catenin亚细胞定位;② TOP/FOP luciferase报告基因检测通路活性(Wnt3a条件培养基处理);③ RT-qPCR检测Wnt靶基因(Myc、CCND1、MMP-7)表达;④ Western blot检测核β-catenin水平。
结果解读:① EHMT2−/−细胞中β-catenin从核内转移至胞质;② 通路活性显著降低(Hep3B:p<0.05;Huh1:p<0.01);③ 靶基因mRNA水平显著下降(Myc:p<0.05;CCND1:p<0.01;MMP-7:p<0.001);④ 核β-catenin蛋白水平降低(p<0.01)。UNC0642处理可抑制野生型细胞的通路活性(p<0.05),但EHMT2−/−细胞的抑制作用减弱。
产品关联:实验所用关键产品包括Cell Signaling Technology的β-catenin抗体(#8480)、Takara的RT-qPCR试剂盒(RR430B)。
3.5 EHMT2与APC启动子的结合及表观调控
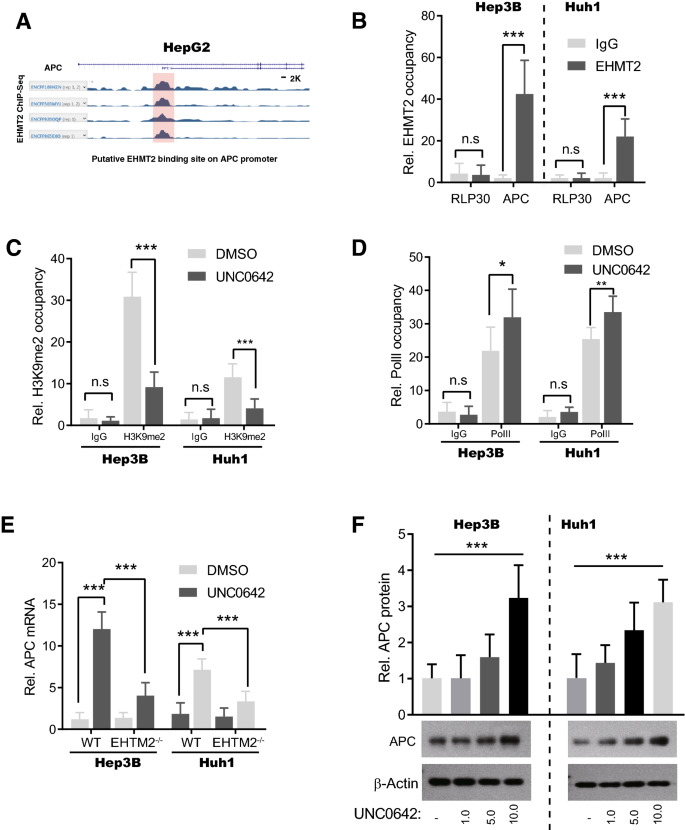
实验目的:揭示EHMT2调控Wnt通路的分子机制。
方法细节:① 分析ENCODE数据库中HepG2细胞的EHMT2 ChIP-seq数据,筛选靶基因;② ChIP-PCR验证EHMT2与APC启动子的结合(Cell Signaling Technology的EHMT2抗体#3306);③ ChIP-PCR检测UNC0642处理后APC启动子的H3K9me2水平;④ RT-qPCR和Western blot检测APC表达。
结果解读:① ENCODE数据显示EHMT2在APC启动子区有显著结合峰;② ChIP-PCR证实EHMT2特异性结合APC启动子(p<0.001);③ UNC0642处理可降低APC启动子的H3K9me2水平(p<0.001),增加RNA聚合酶II(PolII)结合(p<0.05);④ APC mRNA(p<0.001)及蛋白水平(p<0.001)显著升高。
产品关联:实验所用关键产品包括Cell Signaling Technology的EHMT2抗体(#3306)、ThermoFisher的H3K9me2抗体(49-1007)。
3.6 APC介导EHMT2的致癌功能
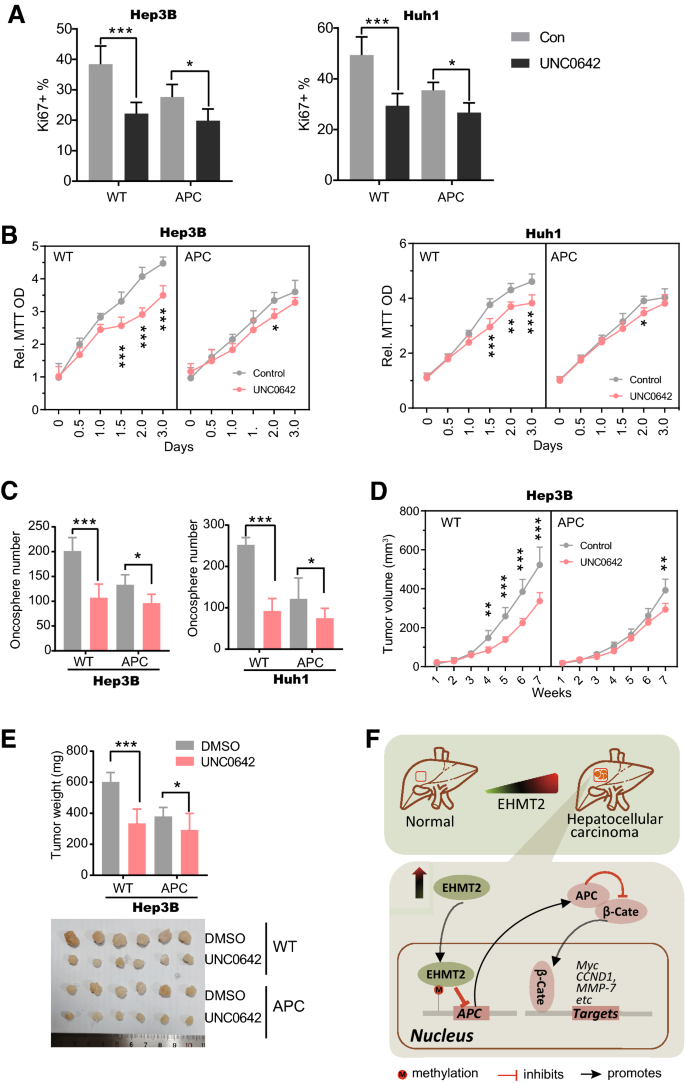
实验目的:验证APC在EHMT2功能中的介导作用。
方法细节:① 慢病毒过表达APC于Hep3B和Huh1细胞;② 检测UNC0642对Ki67阳性率、MTT、软琼脂克隆形成的影响;③ 裸鼠异种移植实验(1mg/kg UNC0642腹腔注射,n=6/组)验证体内作用。
结果解读:① 过表达APC可减弱UNC0642对Ki67阳性率的抑制(p<0.05);② 细胞生长抑制作用显著缓解(p<0.05);③ 软琼脂克隆形成能力部分恢复(p<0.05);④ 异种移植肿瘤生长抑制作用延迟(野生型在第4周出现差异,过表达组在第7周出现差异),最终肿瘤重量增加(p<0.05)。
产品关联:文献未提及具体慢病毒载体品牌,领域常规使用Sigma-Aldrich或ThermoFisher的慢病毒包装系统。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究的核心 Biomarker 为EHMT2(分子标志物),筛选与验证遵循“数据库筛选-临床验证-功能确认”的逻辑:① 通过TCGA/GTEx数据库筛选出EHMT2在HCC中高表达;② 用临床样本的RT-qPCR和Western blot验证表达差异;③ 通过生存分析确认其预后价值;④ 通过功能实验验证其对HCC细胞增殖、肿瘤发生的调控作用。
研究过程详述
Biomarker来源:临床HCC患者的肿瘤组织、癌旁正常组织,及TCGA/GTEx数据库的公开数据。
验证方法:① 表达验证:RT-qPCR(检测mRNA水平)、Western blot(检测蛋白水平);② 预后验证:GEPIA生存分析(OS和DFS);③ 功能验证:CRISPR/Cas9敲除、抑制剂处理、过表达实验。
特异性与敏感性:① OS分析中,高EHMT2表达组的死亡风险是低表达组的1.9倍(HR=1.9,p=0.00057);② DFS分析中,高表达组的复发风险是低表达组的1.5倍(HR=1.5,p=0.0076);③ 在iClust3亚型中,OS的HR高达2.8(p=0.0043),显示更强的特异性。
核心成果提炼
① 预后价值:EHMT2是HCC的独立预后 Biomarker,高表达预示不良OS和DFS;② 功能机制:EHMT2通过直接结合APC启动子,催化H3K9me2甲基化,表观沉默APC表达,进而激活Wnt–β-catenin通路;③ 治疗靶点:EHMT2抑制剂UNC0642通过靶向EHMT2发挥抗HCC作用,且疗效依赖于EHMT2的表达及APC的介导。
本研究明确了EHMT2在HCC中的作用及机制,为HCC的预后判断和靶向治疗提供了新的 Biomarker 和靶点。
