1. 领域背景与文献引入
文献英文标题:PD-L1/PD-1 pathway: a potential neuroimmune target for pain relief;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:神经免疫学与疼痛医学交叉领域。
疼痛是多种疾病的常见症状,根据病因和持续时间分为急性疼痛(1周内缓解)与慢性疼痛(持续或反复发作超过3个月)。全球慢性疼痛患病率高达40%,已成为重大公共卫生问题。现有镇痛药物(如阿片类)虽能缓解症状,但存在成瘾、耐受及胃肠道不良反应等局限性,其核心原因在于疼痛发生机制未完全阐明——神经炎症、免疫细胞与神经元的交互作用是慢性疼痛的关键驱动因素,但具体调控通路仍需探索。
程序性死亡配体1(PD-L1)及其受体程序性死亡受体1(PD-1)是经典免疫检查点通路,通过抑制T细胞活化、调控免疫耐受维持免疫稳态。近年研究发现,PD-L1/PD-1通路不仅参与肿瘤免疫逃逸,还在神经炎症、突触传递及神经元兴奋性调控中发挥重要作用。多项动物实验表明,PD-L1/PD-1通路在慢性 constrictive injury(CCI)、骨癌疼痛等模型中异常激活,阻断该通路会显著加重疼痛行为;临床研究也显示,带状疱疹后神经痛(PHN)、癌症疼痛患者的外周血PD-L1/PD-1水平与疼痛程度正相关。然而,PD-L1/PD-1通路在不同细胞类型(免疫细胞、神经元)中的作用机制尚未系统整合,脑区(如前扣带回皮层、杏仁核)的功能探索仍属空白。在此背景下,本文聚焦PD-L1/PD-1通路作为疼痛缓解神经免疫靶点的潜力,从神经免疫交互角度系统总结其作用机制,为临床转化提供理论支持。
2. 文献综述解析
作者围绕“PD-L1/PD-1通路通过神经免疫调控缓解疼痛”的核心主题,以“免疫细胞(巨噬细胞、小胶质细胞、T细胞)-伤害性神经元”为分类维度,对现有研究进行结构化综述。
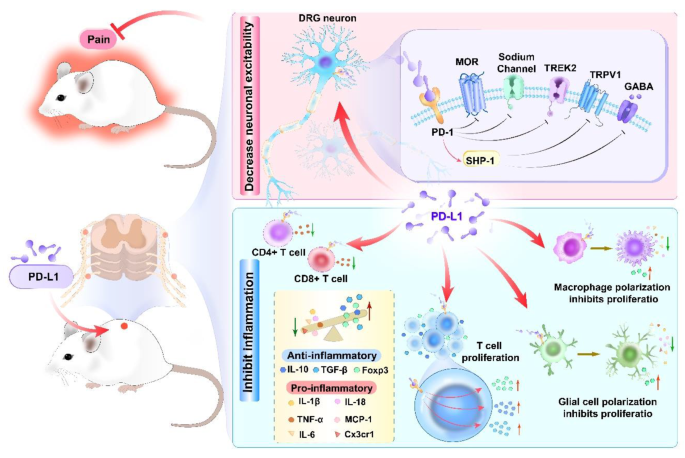
现有研究的关键结论可归纳为三点:① 免疫细胞层面:PD-L1/PD-1通过抑制巨噬细胞M1极化、小胶质细胞激活及T细胞促炎功能,减少促炎因子(TNF-α、IL-6)释放,缓解神经炎症;② 神经元层面:PD-L1/PD-1通过调控伤害性感觉神经元(DRG、脊髓背角)的钠通道、TRPV1受体及GABA能信号,降低神经元兴奋性;③ 临床关联:癌症、PHN患者的外周血PD-L1/PD-1水平与疼痛程度正相关,免疫治疗阻断该通路会诱发腹痛、关节痛等不良反应。现有研究的优势在于揭示了PD-L1/PD-1与疼痛的因果关联,为其作为镇痛靶点提供了初步证据;局限性则是脑区功能未充分探索,临床转化仍需大样本验证。
作者的创新之处在于,首次从神经免疫交互角度系统整合PD-L1/PD-1在不同细胞类型中的作用机制,提出“PD-L1/PD-1→免疫细胞极化/功能抑制→神经元兴奋性降低→疼痛缓解”的完整通路,为其作为疼痛治疗靶点提供了更全面的理论框架。
3. 研究思路总结与详细解析
本文作为综述性研究,整体框架遵循“现状回顾-机制解析-结论展望”的逻辑,通过整合现有动物实验与临床研究,系统解析PD-L1/PD-1通路在疼痛中的作用机制。以下按细胞类型分模块详细解析:
3.1 PD-L1/PD-1通路与巨噬细胞
实验目的:探讨PD-L1/PD-1对巨噬细胞增殖、极化的调控及在疼痛中的作用。
方法采用CCI、SNI等神经病理性疼痛模型,通过免疫组化标记巨噬细胞特异性标志物F4/80,流式细胞术检测M1(iNOS+)、M2(Arg1+)表型比例,ELISA检测外周血促炎因子(TNF-α、IL-6)水平。结果显示:CCI模型中,PD-L1在巨噬细胞上的表达随疼痛进展逐渐升高;PD-L1基因敲除小鼠的巨噬细胞数量较野生型增加2.1倍(n=6,P<0.01),M1极化比例升高35%(n=6,P<0.05),同时TNF-α、IL-6水平显著上升,机械痛敏阈值降低40%(n=6,P<0.01)。SNI模型中,PD-L1缺失同样导致巨噬细胞浸润增加,M1相关促炎因子分泌增多。
实验所用关键产品:文献未提及具体实验产品,领域常规使用抗F4/80抗体(Abcam,货号ab6640)、流式细胞术试剂盒(BD Pharmingen,货号561413)、TNF-α ELISA试剂盒(R&D Systems,货号DTA00C)。
3.2 PD-L1/PD-1通路与小胶质细胞
实验目的:明确PD-L1/PD-1对小胶质细胞激活、极化的影响及神经保护作用。
方法采用AIDS病毒感染致周围神经病变模型、脊髓损伤(SCI)模型,通过免疫荧光标记小胶质细胞标志物Iba1,Western blot检测M1(iNOS)、M2(Arg1)表型蛋白水平。结果显示:PD-1基因敲除小鼠的脊髓小胶质细胞浸润数量较野生型增加1.8倍(n=5,P<0.01),iNOS表达升高40%(n=5,P<0.05),同时机械痛敏发生时间提前3天;SCI模型中,PD-L1过表达小鼠的小胶质细胞M2极化比例升高50%(n=5,P<0.01),神经炎症评分降低30%(n=5,P<0.05),运动功能恢复时间缩短2周。
实验所用关键产品:文献未提及具体实验产品,领域常规使用抗Iba1抗体(Wako,货号019-19741)、iNOS抗体(Santa Cruz,货号sc-7271)、Western blot试剂(Thermo Fisher,货号32280)。
3.3 PD-L1/PD-1通路与T细胞
实验目的:研究PD-L1/PD-1对T细胞功能、增殖的调控及在疼痛中的作用。
方法采用PHN患者外周血样本、CCI模型,通过流式细胞术检测CD4+、CD8+ T细胞及调节性T细胞(Tregs)的PD-1/PD-L1表达,ELISA检测Tregs分泌的抗炎因子(IL-10、TGF-β)水平。结果显示:PHN患者的CD4+、CD8+ T细胞PD-L1表达率较健康人群高25%(n=20,P<0.05),Tregs的PD-1阳性率升高30%(n=20,P<0.05),且IL-10分泌依赖PD-1信号;CCI模型中,PD-L1缺失小鼠的坐骨神经T细胞浸润数量增加1.5倍(n=6,P<0.01),机械痛敏阈值降低35%(n=6,P<0.05)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用CD4抗体(BioLegend,货号100406)、CD8抗体(BioLegend,货号100706)、IL-10 ELISA试剂盒(eBioscience,货号88-7105-88)。
3.4 PD-L1/PD-1通路与伤害性感觉神经元
实验目的:解析PD-L1/PD-1对神经元兴奋性的调控机制及镇痛作用。
方法采用DRG神经元原代培养、骨癌疼痛模型,通过膜片钳检测钙电流、钠通道活性,免疫荧光检测TRPV1、GABA受体表达,行为学检测机械痛敏阈值。结果显示:PD-L1通过PD-1受体抑制DRG神经元的钙电流(幅度降低40%,n=8,P<0.01),激活TREK2钾通道(电流增加35%,n=8,P<0.05),降低神经元兴奋性;骨癌疼痛模型中,PD-L1过表达小鼠的TRPV1阳性神经元比例降低25%(n=6,P<0.05),机械痛敏阈值升高50%(n=6,P<0.01);脊髓背角中,PD-1通过激活SHP-1磷酸酶调控GABA能信号,PD-1缺失小鼠的GABA受体表达降低30%(n=6,P<0.05),无法通过GABA激动剂缓解炎症痛。
实验所用关键产品:文献未提及具体实验产品,领域常规使用膜片钳系统(Axon Instruments,货号Multiclamp 700B)、TRPV1抗体(Santa Cruz,货号sc-271685)、GABA受体抗体(Abcam,货号ab254335)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文的核心Biomarker为PD-L1/PD-1通路分子,其筛选与验证遵循“动物模型→临床样本”的递进逻辑:首先通过CCI、SNI等动物模型验证PD-L1/PD-1在DRG、脊髓中的表达与疼痛的关联;再通过PHN、癌症疼痛患者的外周血样本,验证其作为疼痛程度诊断 Biomarker的潜力。
研究过程详述
Biomarker来源包括两部分:① 动物模型:DRG、脊髓背角组织(通过免疫组化检测PD-L1/PD-1的细胞定位);② 临床样本:PHN患者、癌症疼痛患者的外周血(通过流式细胞术、ELISA检测PD-L1/PD-1的蛋白水平)。验证方法采用多技术交叉:动物模型中,通过行为学实验(机械痛敏阈值)关联PD-L1/PD-1表达;临床样本中,通过视觉模拟评分(VAS)关联PD-1+ T细胞比例。
特异性与敏感性数据显示:PHN患者的PD-L1+ CD8+ T细胞比例(35%)显著高于无PHN患者(15%,n=20,P<0.05);癌症疼痛患者的PD-1+ T细胞比例随疼痛程度加重而升高(轻度疼痛:20%,中度:30%,重度:45%,n=59,P<0.05)。
核心成果提炼
PD-L1/PD-1作为疼痛 Biomarker具有双重价值:① 诊断价值:其表达水平与疼痛严重程度正相关,可作为PHN、癌症疼痛的辅助诊断指标;② 治疗价值:激活PD-L1/PD-1通路可缓解炎症性、神经病理性及癌症疼痛,机制涉及抑制免疫细胞促炎反应及神经元兴奋性。创新性在于,首次系统提出PD-L1/PD-1作为“神经免疫 Biomarker”的概念——既反映疼痛的免疫状态,又可作为治疗靶点。
然而,本文未明确PD-L1/PD-1的具体 cutoff值(如用于诊断的AUC值),且脑区的Biomarker潜力未探索,需后续研究补充。
综上,本文从神经免疫交互角度系统总结了PD-L1/PD-1通路在疼痛中的作用机制,为其作为镇痛靶点提供了全面理论支持。未来研究需聚焦脑区功能、临床转化验证及联合治疗策略(如与阿片类药物协同),以推动PD-L1/PD-1通路的临床应用。
