1. 领域背景与文献引入
文献英文标题:Phosphodiesterase inhibition and Gucy2C activation enhance tyrosine hydroxylase Ser40 phosphorylation and improve 6-hydroxydopamine-induced motor deficits;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:帕金森病的神经退行性疾病治疗
帕金森病(Parkinson’s disease, PD)是全球第二大神经退行性疾病,全球患病率约为1%(60岁以上人群达3%),核心病理特征是中脑黑质致密部(substantia nigra pars compacta, SNpc)多巴胺能神经元进行性丢失,导致纹状体多巴胺(dopamine, DA)水平显著降低(丢失≥70%时出现临床症状),引发静止性震颤、肌强直、运动迟缓等运动障碍。目前临床一线治疗药物L-3,4-二羟基苯丙氨酸(L-DOPA)通过补充DA前体缓解症状,但长期使用(≥5年)会出现运动波动(如“开关现象”)和异动症(dyskinesia)等严重副作用,且无法阻止神经元退行性变。因此,促进内源性DA合成、延缓疾病进展是PD治疗领域的关键需求。
酪氨酸羟化酶(tyrosine hydroxylase, TH)是DA合成途径的限速酶,催化L-酪氨酸生成L-DOPA,其活性受Ser40位点磷酸化的严格调控——Ser40磷酸化能解除儿茶酚胺的反馈抑制,将酶活性提高5-10倍,直接决定内源性DA合成能力。Cyclic nucleotide(环腺苷酸cAMP、环鸟苷酸cGMP)信号通路是调控TH Ser40磷酸化的核心机制:cAMP激活蛋白激酶A(PKA),进而磷酸化TH Ser40;cGMP也可通过激活cGMP依赖性蛋白激酶(PKG)参与调控。而细胞内cyclic nucleotide水平由两类酶平衡:磷酸二酯酶(PDE)负责降解cyclic nucleotide(如PDE2A降解cAMP/cGMP),鸟苷酸环化酶C(GUCY2C)负责合成cGMP(在DA能神经元中高表达)。
现有研究已证实cAMP信号能促进TH磷酸化,但针对PDE抑制(减少cyclic nucleotide降解)和GUCY2C激活(增加cGMP合成)的联合验证较少,且缺乏在DA能神经元丢失模型(如Pitx3缺陷小鼠)和PD经典体内模型(如6-羟基多巴胺(6-OHDA)模型)中的系统评估。本研究的初衷是填补这一空白,验证PDE抑制和GUCY2C激活对TH Ser40磷酸化的调控作用,以及对PD小鼠运动功能的改善效果,为开发新型PD治疗策略提供实验依据。
2. 文献综述解析
作者的综述逻辑围绕“PD核心问题→TH调控机制→cyclic nucleotide信号→PDE/GUCY2C的治疗潜力”展开,核心评述如下:
(1)现有研究的关键结论
- PD的核心矛盾是DA能神经元丢失导致的内源性DA合成不足,L-DOPA仅能“补充外源性前体”,无法修复内源性合成能力;
- TH Ser40磷酸化是内源性DA合成的“开关”,其水平直接决定TH活性和DA产量;
- Cyclic nucleotide信号通路是调控TH Ser40磷酸化的核心:cAMP-PKA轴是经典通路,cGMP-PKG轴也参与调控;
- PDE2A是脑内DA能神经元中主要的cyclic nucleotide降解酶,GUCY2C是DA能神经元中主要的cGMP合成酶,两者均为调控cyclic nucleotide水平的关键靶点。
(2)现有研究的局限性
- 多聚焦于单一信号通路(如仅PDE抑制或仅GUCY2C激活),缺乏两者的对比验证;
- 多采用细胞/组织模型,缺乏在DA能神经元丢失的体内模型(如Pitx3缺陷小鼠)中的验证;
- 未系统评估治疗策略对TH蛋白水平的影响(部分研究提示Ser40磷酸化可能加速TH降解,需澄清这一风险)。
(3)本研究的创新价值
- 首次同时验证PDE抑制和GUCY2C激活两种策略对TH Ser40磷酸化的调控;
- 首次在Pitx3缺陷小鼠中验证病理状态下TH磷酸化的可调控性;
- 首次在6-OHDA模型中系统评估两种策略对运动功能的改善效果;
- 澄清了Ser40磷酸化对TH蛋白水平的影响(无降解风险,反而有升高趋势)。
3. 研究思路总结与详细解析
本研究以“cyclic nucleotide信号→TH Ser40磷酸化→DA合成→运动功能改善”为核心逻辑,采用“离体模型→基因缺陷模型→疾病模型”的分层验证策略,逐步明确治疗潜力。
3.1 离体纹状体脑片模型的建立与TH磷酸化调控验证
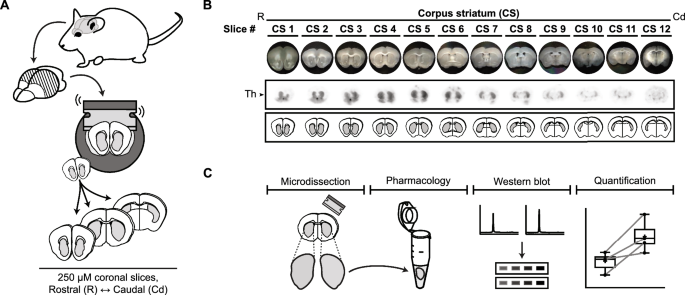
实验目的:建立能精准研究纹状体TH Ser40磷酸化的离体模型,避免相邻脑区污染。
方法细节:取成年C57/Bl6/J小鼠脑组织,用振动切片机制备250μm厚的纹状体冠状脑片;冰上显微切割分离纹状体区域(避免周边脑区污染),将脑片分为左右半球(随机一侧用药物处理,另一侧用vehicle对照);孵育60分钟后,用Wes自动化毛细管蛋白印迹系统检测TH总蛋白(TH)、Ser40磷酸化TH(p-TH Ser40)和内参β-actin。
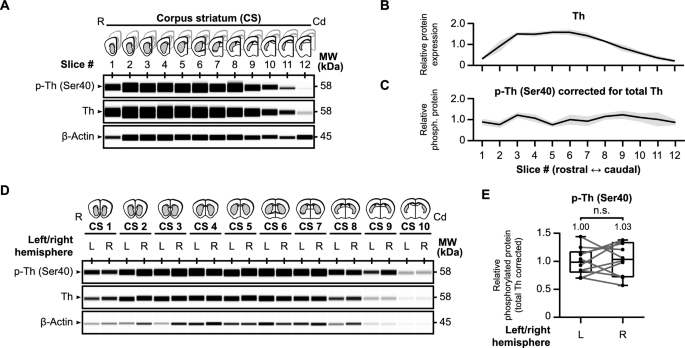
结果解读:
- 纹状体TH总蛋白在头尾轴呈右偏峰分布(前侧纹状体TH水平更高),但Ser40相对磷酸化水平(p-TH Ser40/TH)在头尾轴均匀分布;
- 左右半球的TH总蛋白和Ser40相对磷酸化水平无显著差异(p>0.05),说明半球间一致性良好;
- Forskolin(cAMP激活剂,10μM)处理后,Ser40相对磷酸化水平较vehicle组升高1.94倍(n=10,p<0.01);pCPT-cAMP(cAMP类似物,500μM)处理后升高1.30倍(n=6,p<0.05),验证了cAMP信号对TH Ser40磷酸化的促进作用。
产品关联:实验所用关键产品:Wes自动化毛细管蛋白印迹系统(Protein Simple);兔抗TH抗体(Pel-Freez,货号P40101);兔抗p-TH Ser40抗体(Cell Signaling Technology,货号2791S);兔抗β-actin抗体(Cell Signaling Technology,货号4907S);forskolin(Cell Signaling Technology,货号3828);pCPT-cAMP(Sigma-Aldrich,货号C3912)。
3.2 Pitx3缺陷小鼠模型中TH磷酸化的可调控性研究
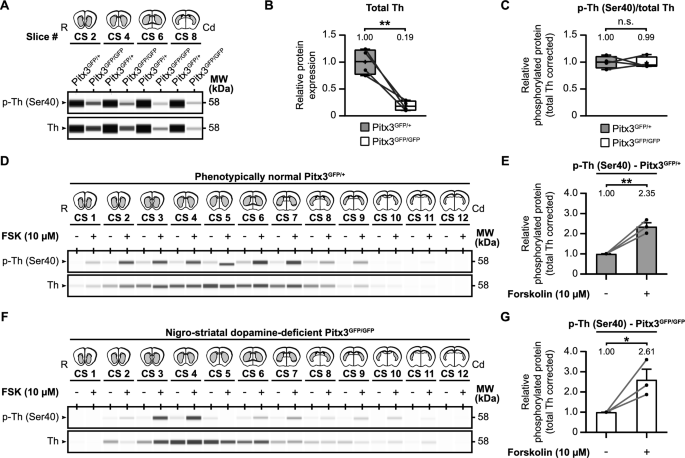
实验目的:验证在DA能神经元丢失的病理状态下,TH Ser40磷酸化是否仍可被cyclic nucleotide信号调控。
方法细节:选择Pitx3GFP/GFP小鼠(纯合子,SNpc DA能神经元选择性丢失,纹状体TH水平降至正常19%)和Pitx3GFP/+小鼠(杂合子,DA能系统正常);制备纹状体脑片,用forskolin(10μM)处理60分钟,检测p-TH Ser40和TH总蛋白。
结果解读:
- Pitx3GFP/GFP小鼠纹状体TH总蛋白仅为Pitx3GFP/+的19%(n=3,p<0.01),模拟了PD的DA能神经元丢失状态;
- 两组小鼠的Ser40相对磷酸化水平无显著差异(p>0.05);
- Forskolin处理后,Pitx3GFP/+小鼠p-TH Ser40升高2.35倍(n=3,p<0.01),Pitx3GFP/GFP小鼠升高2.61倍(n=3,p<0.05),说明即使DA能神经元大量丢失,TH Ser40仍可被cAMP信号激活。
3.3 MN9D细胞中PDE2A抑制对cAMP水平和TH磷酸化的影响
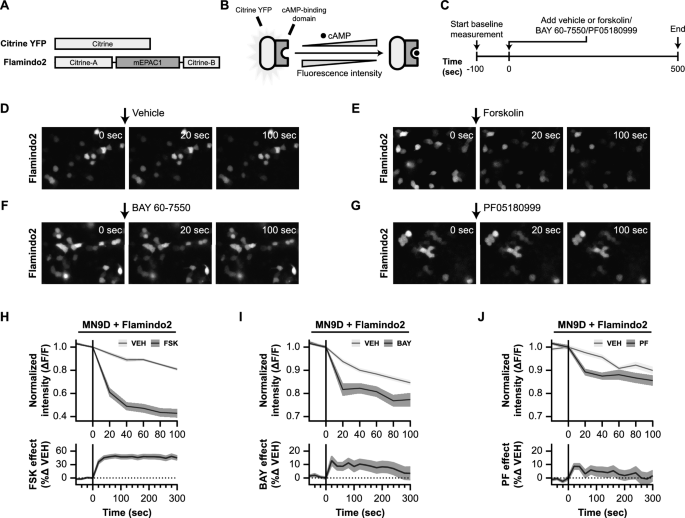
实验目的:在DA能细胞模型中验证PDE2A抑制对cyclic nucleotide水平和TH Ser40磷酸化的调控。
方法细节:使用MN9D细胞(DA能神经细胞系,内源性表达TH和PDE2A);转染Flamindo2质粒(cAMP荧光探针)检测cAMP水平;用PDE2A抑制剂(BAY 60-7550、PF05180999)处理,检测p-TH Ser40。
结果解读:
- BAY 60-7550(10μM)和PF05180999(100μM)处理后,Flamindo2荧光强度显著降低(提示cAMP水平升高),效果与forskolin相当;
- BAY 60-7550(10μM)处理5分钟即可升高p-TH Ser40 2.09倍(n=4,p<0.01),且呈浓度(10μM、30μM)和时间(5-240分钟)依赖性;
- PF05180999(10μM)处理30分钟后,p-TH Ser40升高1.37倍(n=4,p<0.01)。
产品关联:实验所用关键产品:MN9D细胞系(Dr. Thomas Perlmann馈赠);Flamindo2质粒(Addgene,货号73938);Lipofectamine 3000(Invitrogen,货号L3000001);BAY 60-7550(Santa Cruz Biotechnology,货号sc-396772);PF05180999(ToCris,货号6405)。
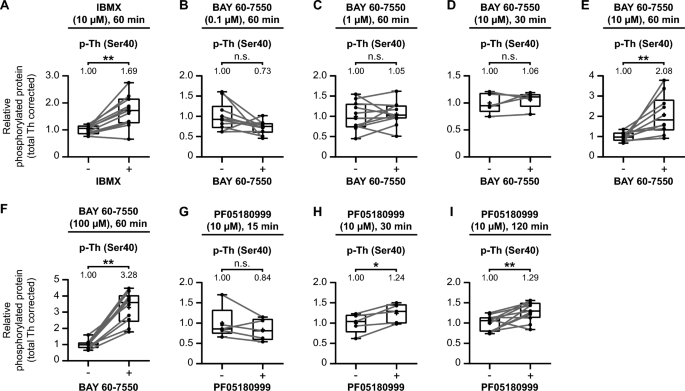
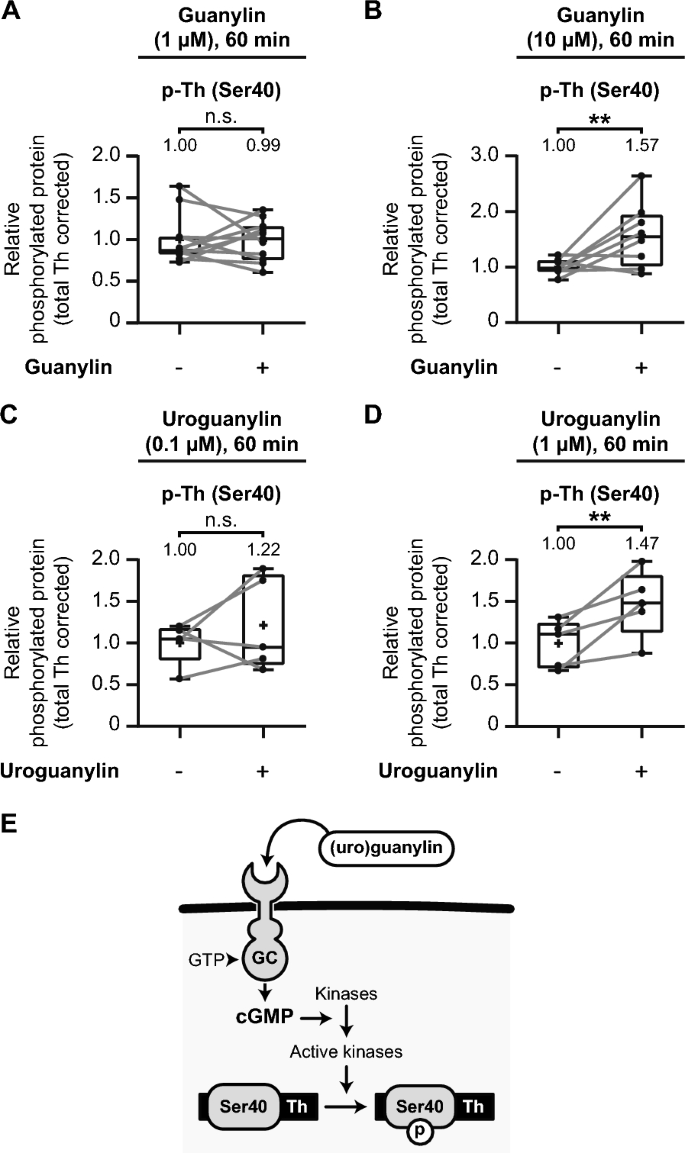
3.4 小鼠纹状体中PDE抑制与GUCY2C激活对TH磷酸化的调控
实验目的:在体内纹状体组织中验证PDE抑制和GUCY2C激活对TH Ser40磷酸化的影响。
方法细节:取C57/Bl6/J小鼠纹状体脑片,分别用PDE抑制剂(IBMX、BAY 60-7550、PF05180999)或GUCY2C配体(guanylin、uroguanylin)处理,检测p-TH Ser40。
结果解读:
- 非选择性PDE抑制剂IBMX(10μM)处理60分钟,p-TH Ser40升高1.69倍(n=11,p<0.01);
- BAY 60-7550(10μM、100μM)处理60分钟,p-TH Ser40分别升高2.08倍(n=10,p<0.01)、3.28倍(n=10,p<0.01);
- PF05180999(10μM)处理30分钟、120分钟,p-TH Ser40分别升高1.24倍(n=5,p<0.05)、1.29倍(n=11,p<0.01);
- GUCY2C配体guanylin(10μM)处理60分钟,p-TH Ser40升高1.57倍(n=8,p<0.05);uroguanylin(1μM)处理60分钟,升高1.47倍(n=5,p<0.05)。
产品关联:实验所用关键产品:IBMX(ToCris,货号2845);guanylin(Santa Cruz Biotechnology,货号sc-203067);uroguanylin(Biosynth,货号PUG-4354-S)。
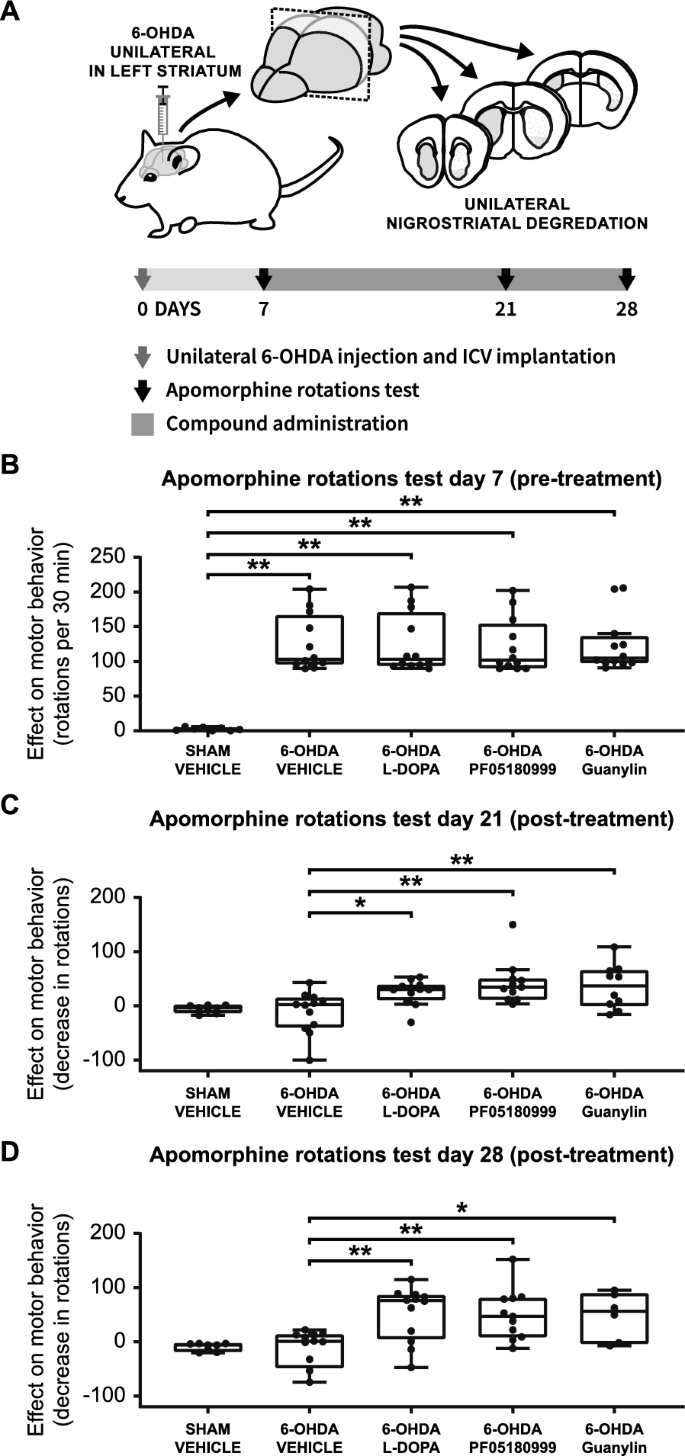
3.5 6-OHDA帕金森病小鼠模型的运动功能验证
实验目的:验证PDE抑制和GUCY2C激活对PD小鼠运动功能的改善效果。
方法细节:建立单侧6-OHDA纹状体注射模型(损伤DA能神经元,导致对侧旋转行为);将小鼠分为5组:假手术组、模型组、L-DOPA组(20mg/kg)、PF05180999组(30mg/kg)、guanylin组(0.53μg,脑室内);术后7天(基线)、21天、28天进行阿扑吗啡旋转实验。
结果解读:
- 基线时,所有6-OHDA模型组旋转次数显著高于假手术组(p<0.01),验证模型成功;
- 治疗21天后,L-DOPA组、PF05180999组、guanylin组旋转次数较模型组分别减少36.92次(n=12,p<0.05)、54.60次(n=11,p<0.01)、47.22次(n=10,p<0.01);
- 治疗28天后,三组仍保持显著改善(分别减少76.25次、74.37次、71.58次,p<0.01),效果与L-DOPA相当。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究的核心Biomarker是TH Ser40磷酸化(p-TH Ser40)(功能型Biomarker,反映DA合成能力),同时PDE2A和GUCY2C作为靶点Biomarker(反映cyclic nucleotide信号活性)。筛选逻辑如下:
1. 基于已有理论(TH Ser40调控DA合成),通过离体脑片验证cAMP/cGMP对p-TH Ser40的调控;
2. 在Pitx3缺陷小鼠中验证病理状态下p-TH Ser40的可调控性;
3. 通过细胞模型验证PDE2A抑制对p-TH Ser40的影响;
4. 在纹状体组织中验证PDE抑制和GUCY2C激活对p-TH Ser40的调控;
5. 在6-OHDA模型中验证p-TH Ser40与运动功能的相关性。
研究过程与核心成果
Biomarker来源:小鼠纹状体组织、MN9D细胞的蛋白提取物。
验证方法:Wes自动化蛋白印迹(检测p-TH Ser40和TH总蛋白)、Flamindo2荧光探针(检测cAMP水平)。
特异性与敏感性:
- 在MN9D细胞中,BAY 60-7550(10μM)处理5分钟即可显著升高p-TH Ser40(敏感性高),且呈浓度依赖性(特异性好);
- 在纹状体组织中,guanylin(10μM)处理60分钟可升高p-TH Ser40 1.57倍(统计显著,p<0.05)。
核心成果:
1. p-TH Ser40是反映DA合成能力的功能Biomarker:其水平与cyclic nucleotide信号活性正相关,可作为评估治疗效果的关键指标;
2. PDE2A和GUCY2C是调控p-TH Ser40的靶点Biomarker:抑制PDE2A或激活GUCY2C能显著升高p-TH Ser40水平;
3. p-TH Ser40与运动功能改善显著相关:在6-OHDA模型中,PF05180999组p-TH Ser40升高1.29倍,旋转次数减少74.37次(p<0.01),说明p-TH Ser40的升高直接改善运动功能。
本研究通过系统验证,明确了PDE抑制和GUCY2C激活作为PD治疗策略的潜力,为开发“促进内源性DA合成”的新型疗法提供了实验依据。
