1. 领域背景与文献引入
文献英文标题:HnRNP M expression rescues neurodegeneration in neuronal intranuclear inclusion disease mouse model by restoring dysregulated RNA splicing and transcription;发表期刊:Cell & Bioscience;影响因子:6.8(2023年);研究领域:神经元核内包涵体病(NIID)的发病机制与治疗靶点研究。
神经元核内包涵体病(NIID)是一种罕见神经退行性疾病,核心病理为中枢及内脏器官广泛分布的泛素阳性核内包涵体,临床表型高度异质,涵盖认知障碍、小脑共济失调、帕金森样症状等。2019年,NOTCH2NLC基因5"UTR区GGC重复扩展被鉴定为致病原因,扩展序列可翻译为毒性多聚甘氨酸(polyG)肽,形成核内包涵体并诱导神经元死亡。此外,RNA加工异常(可变剪接、转录失调)是NIID的关键分子病理,在患者组织、诱导多能干细胞及动物模型中均有证实。
异质核核糖核蛋白M(hnRNP M)是RNA结合蛋白家族成员,作为剪接体组分参与RNA可变剪接与转录调控。前期研究发现,hnRNP M会被polyG包涵体隔离,可能导致功能缺陷,但具体作用及机制尚未明确,缺乏体内实验验证其作为治疗靶点的潜力。本文针对这一空白,利用NOTCH2NLC-98GGC转基因小鼠模型(忠实再现NIID核心病理),探讨AAV介导的hnRNP M表达对NIID病理、行为及RNA加工的影响,揭示其通过恢复突触相关基因转录与剪接发挥神经保护的机制。
2. 文献综述解析
作者对NIID领域的评述逻辑围绕“临床病理-致病基因-分子机制-潜在靶点”展开,分类维度包括:
1. NIID的临床与病理特征:总结NIID的泛核内包涵体病理及异质临床表型;
2. NOTCH2NLC GGC重复的致病机制:涵盖polyG肽毒性、RNA加工异常等理论;
3. hnRNP家族的功能关联:重点阐述hnRNP M在RNA剪接中的作用,及被polyG包涵体隔离的研究结果。
现有研究的关键结论:NIID由NOTCH2NLC GGC重复扩展引起,polyG包涵体是核心病理;RNA加工异常是重要分子特征;hnRNP M被隔离可能导致功能缺陷。局限性:缺乏体内实验验证hnRNP M的功能,未明确其作为治疗靶点的潜力,对下游靶基因知之甚少。
本文创新价值:首次在NIID小鼠模型中证明外源性hnRNP M可缓解神经病理与行为缺陷,明确其通过恢复突触基因的转录/剪接发挥作用,为RNA加工靶向治疗提供实验依据。
3. 研究思路总结与详细解析
整体框架:研究目标是探讨hnRNP M在NIID中的治疗作用及机制;核心科学问题是hnRNP M是否通过恢复RNA加工异常缓解神经退行性变;技术路线为“载体构建→体内给药→病理/行为评估→转录组分析→分子验证”的闭环。
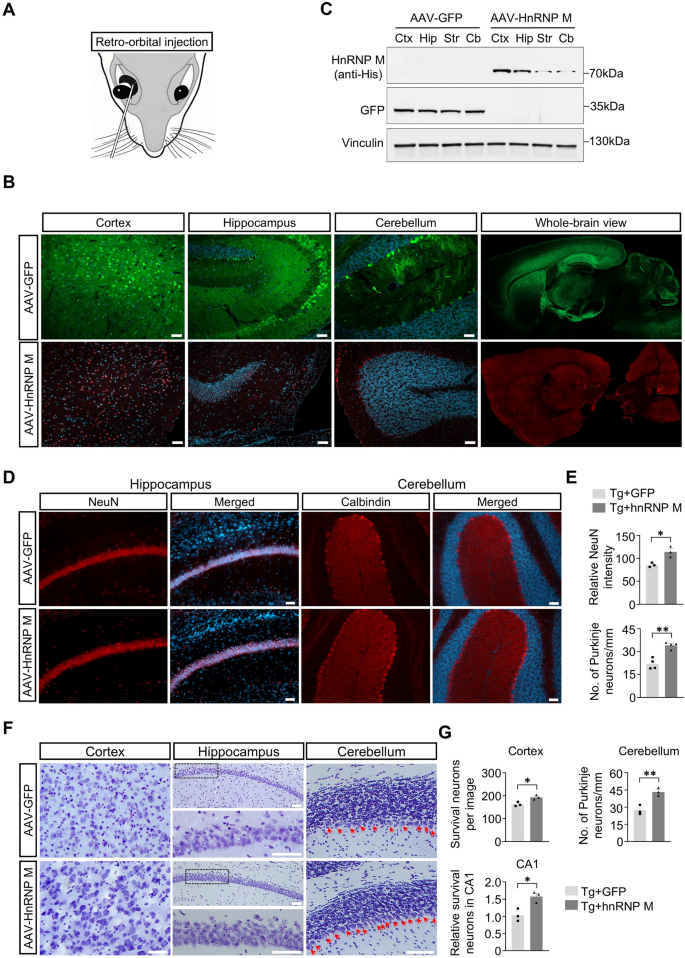
3.1 AAV-hnRNP M载体构建与小鼠给药
实验目的:在NIID小鼠体内实现外源性hnRNP M的高效表达。
方法细节:构建CMV启动子驱动的人hnRNP M/GFP AAV质粒,包装为PHP.eB血清型(穿越血脑屏障);局部给药为P15小鼠皮层立体定位注射(0.5×10⁹ GC),对侧注射GFP对照;全身给药为P15小鼠眶后注射(1×10¹¹ GC)。
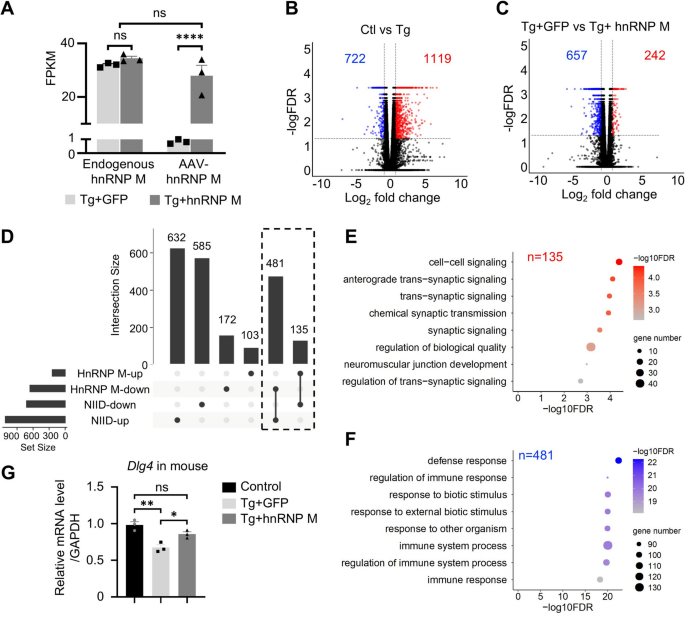
结果解读:局部注射无载体泄漏(hnRNP M侧无GFP信号);全身注射后,脑内皮层、海马等区域广泛表达hnRNP M/GFP,外源性表达水平与内源性相当。
产品关联:AAV载体由PackGene Biotech包装;抗体包括Flag(Sigma,F1804)、Calbindin(Sigma,C9848)等。
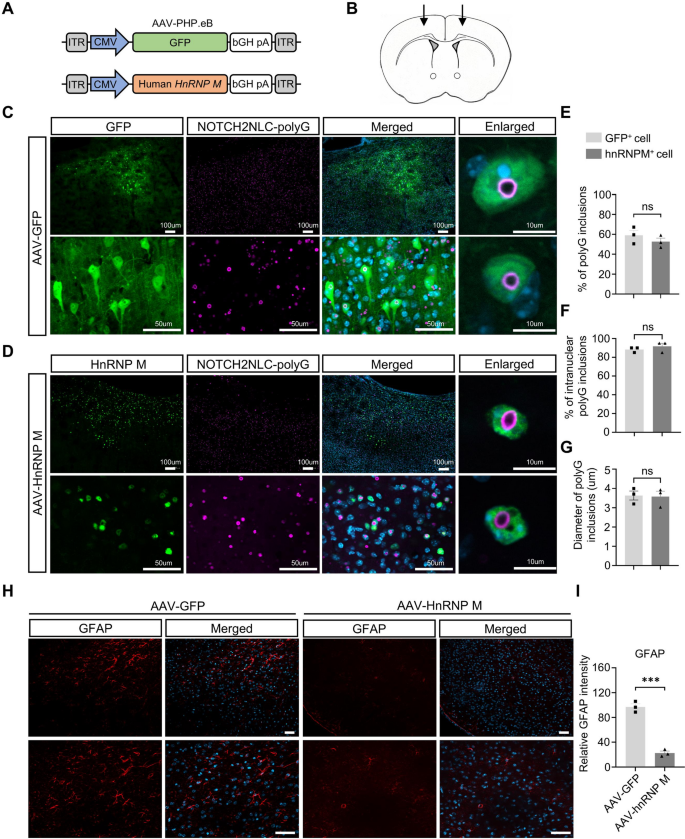
3.2 神经病理表型评估
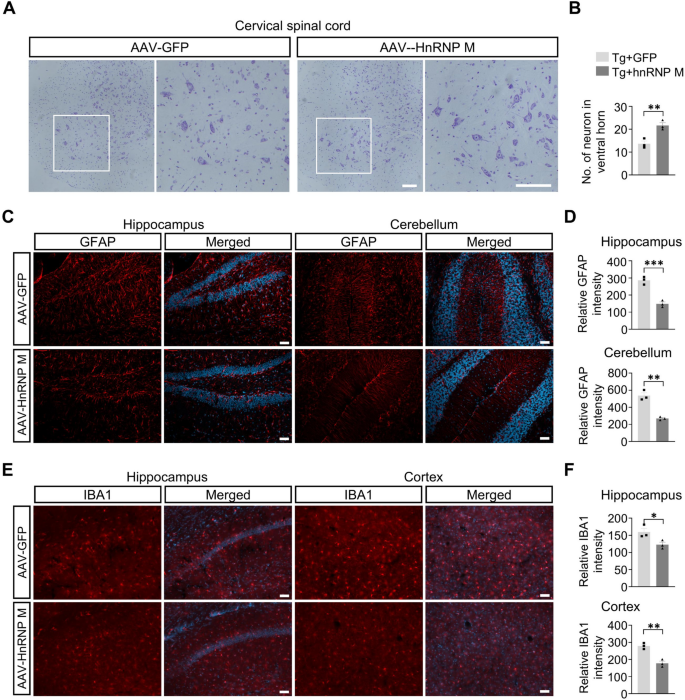
实验目的:检测hnRNP M对NIID小鼠神经元丢失与胶质增生的影响。
方法细节:免疫荧光染色检测NeuN(成熟神经元)、Calbindin(浦肯野细胞)、GFAP(星形胶质细胞)、Iba1(小胶质细胞);Nissl染色计数存活神经元。
结果解读:hnRNP M表达后,海马NeuN强度增加(n=3,P=0.0168),小脑Calbindin阳性细胞增多(n=4,P=0.0011);皮层、海马、小脑存活神经元数显著高于GFP组(皮层P=0.0169,CA1区P=0.0129);GFAP/Iba1强度降低(海马GFAP P=0.0014,皮层Iba1 P=0.0461),胶质增生缓解。
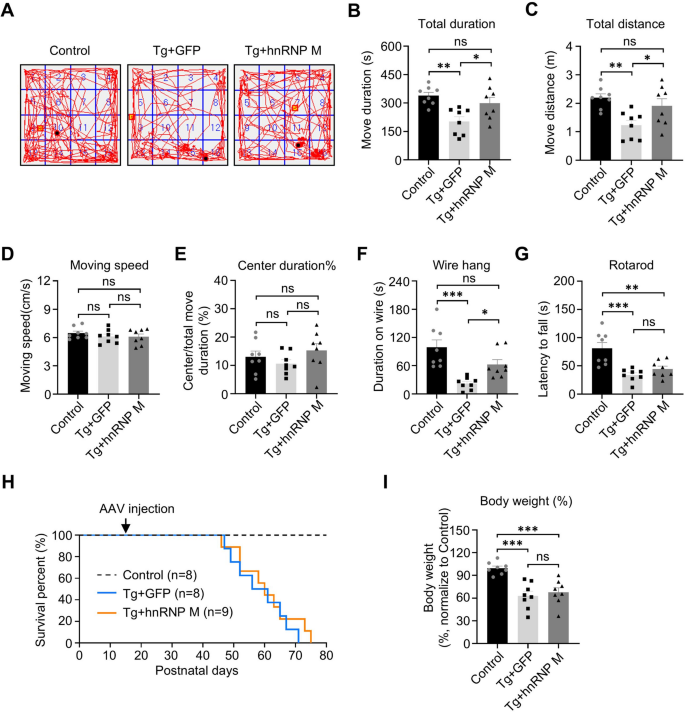
3.3 行为学功能评估
实验目的:验证hnRNP M对NIID小鼠运动功能的改善作用。
方法细节:P40(AAV注射后3周)进行开放场实验(运动持续时间/距离)、悬wire实验(悬挂潜伏期)、转棒实验(坠落潜伏期)。
结果解读:开放场实验中,hnRNP M组运动持续时间/距离恢复至对照水平(P<0.05);悬wire实验潜伏期延长(P<0.05);转棒实验无显著差异;生存期与终末期体重无改善。
3.4 RNA加工机制验证
实验目的:揭示hnRNP M缓解NIID的分子机制。
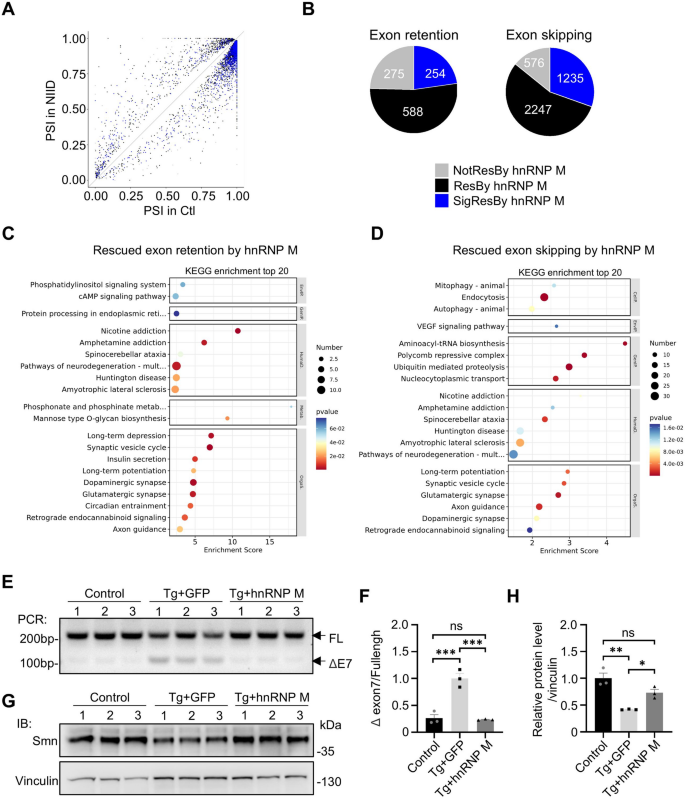
方法细节:对P50小鼠皮层进行RNA-seq,筛选差异基因(DEGs)与可变剪接事件;qRT-PCR验证Dlg4(转录异常)、RT-PCR验证Smn(剪接异常),Western blot验证Smn蛋白。
结果解读:NIID小鼠皮层有722个基因下调(突触通路)、1119个基因上调(免疫反应);hnRNP M表达后,135个突触基因(如Dlg4)被上调,481个免疫基因被下调;Dlg4在NIID海马中下调(n=3,P<0.05),hnRNP M恢复其表达;Smn基因exon7跳读增加(n=3,P<0.0005),hnRNP M恢复exon7包含,Smn蛋白水平升高(n=3,P<0.05)。
4. Biomarker研究及发现成果解析
Biomarker定位
本文的Biomarker为功能型标志物,包括:
1. 治疗靶点Biomarker:hnRNP M(NIID潜在治疗靶点);
2. 分子病理Biomarker:Smn基因exon7跳读(RNA剪接异常)、Dlg4 mRNA表达(转录异常)。
筛选/验证逻辑:
- hnRNP M:基于前期“被polyG隔离”的研究,体内实验验证补充可缓解病理;
- Smn exon7跳读:基于hnRNP M调控Smn剪接的已知功能,验证NIID中的异常及恢复作用;
- Dlg4表达:基于hnRNP M调控Dlg4转录的已知功能,验证NIID中的下调及恢复作用。
研究过程详述
Biomarker来源:NIID小鼠的脑(皮层、海马)和脊髓组织。
验证方法:Smn exon7跳读用RT-PCR(全长216bp/跳读105bp),Dlg4用qRT-PCR,Smn蛋白用Western blot。
特异性与敏感性:Smn exon7跳读在NIID中显著增加(P<0.0005),hnRNP M处理后降低(P<0.0005);Dlg4 mRNA在NIID中降低(P<0.05),处理后升高(P<0.05)。
核心成果提炼
- 治疗靶点价值:hnRNP M是NIID潜在治疗靶点,AAV介导的表达可缓解神经病理(神经元丢失、胶质增生)与运动缺陷(开放场、悬wire实验改善)。
- 分子病理标志物:Smn基因exon7跳读、Dlg4 mRNA表达分别反映NIID的RNA剪接与转录异常。
- 机制结论:hnRNP M通过恢复这些RNA加工异常发挥作用,调控突触相关基因(如Dlg4、Smn)的表达是关键。
统计学结果:Smn exon7跳读(NIID vs 对照,P<0.0005;hnRNP M vs GFP,P<0.0005);Dlg4 mRNA(NIID vs 对照,P<0.05;hnRNP M vs GFP,P<0.05)。
