1. 领域背景与文献引入
文献英文标题:LncRNA APCDD1L-AS1 induces icotinib resistance by inhibition of EGFR autophagic degradation via the miR-1322/miR-1972/miR-324-3p-SIRT5 axis in lung adenocarcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肺腺癌EGFR酪氨酸激酶抑制剂(EGFR-TKI)耐药机制研究。
肺腺癌是全球最常见的恶性肿瘤之一,也是癌症相关死亡的首要原因。约40%的亚洲肺腺癌患者携带EGFR敏感突变(如19del、L858R),EGFR-TKI(如埃克替尼、吉非替尼)已成为这类患者的一线治疗方案,显著延长了生存期。然而,多数患者在治疗10-16个月后会出现获得性耐药,已知的耐药机制包括EGFR T790M二次突变、MET基因扩增等,但仍有超过30%的患者耐药机制未明。近年来,长链非编码RNA(lncRNA)作为竞争性内源性RNA(ceRNA)参与肿瘤进展及耐药的研究逐渐增多,但其在EGFR-TKI耐药中的具体作用及复杂调控网络仍不清楚。现有研究多聚焦于单一lncRNA-miRNA-mRNA的简单相互作用,缺乏对多miRNA协同调控的ceRNA网络的探索。本研究针对这一空白,系统解析了lncRNA APCDD1L-AS1通过调控miR-1322/miR-1972/miR-324-3p-SIRT5轴抑制EGFR自噬降解,最终诱导肺腺癌埃克替尼耐药的机制,为克服EGFR-TKI耐药提供了新靶点。
2. 文献综述解析
现有研究表明,lncRNA通过ceRNA机制调控EGFR-TKI耐药是重要方向:例如,lncRNA LOC554202通过上调miR-31降低肺腺癌细胞对吉非替尼的敏感性;lncRNA RHPN1-AS1通过miR-299-3p/TNFSF12通路促进吉非替尼耐药。但这些研究仅关注单一lncRNA与单个miRNA的相互作用,未涉及多miRNA协同调控的复杂网络,且对lncRNA下游靶基因的功能及调控方式(如蛋白质降解途径)研究不足。本研究的创新点在于:首次发现APCDD1L-AS1可同时 sponge 3个miRNA(miR-1322、miR-1972、miR-324-3p),并共同调控靶基因SIRT5,形成稳定的ceRNA网络;进一步揭示SIRT5通过抑制EGFR自噬降解维持其蛋白水平,最终诱导耐药,弥补了现有研究对“lncRNA-ceRNA-自噬”调控轴在EGFR-TKI耐药中作用的缺失。
3. 研究思路总结与详细解析
本研究采用“耐药模型建立→关键lncRNA筛选→功能验证→机制解析→体内验证”的闭环思路,逐步阐明APCDD1L-AS1的作用及机制。
3.1 埃克替尼耐药细胞系建立与验证
实验目的:构建埃克替尼耐药肺腺癌细胞系,为后续研究提供模型。
方法细节:用梯度浓度埃克替尼(0.01-20 μM)处理PC9、HCC827细胞6个月,建立低剂量耐药(PC9/IcoRL、HCC827/IcoRL)和高剂量耐药(PC9/IcoRH、HCC827/IcoRH)细胞系;通过MTT法检测IC50、克隆形成实验检测增殖能力、Western blot检测EGFR及磷酸化EGFR(p-EGFR)表达,体内裸鼠移植瘤模型验证耐药性。
结果解读:耐药细胞的IC50显著高于亲本细胞(如PC9/IcoRH的IC50是PC9的5倍以上,P<0.01);克隆形成能力增强;EGFR及p-EGFR表达显著升高(Western blot条带灰度值统计显示p-EGFR上调2.1倍,P<0.05);体内模型中,耐药细胞形成的瘤体体积更大(n=3,P<0.01)。
产品关联:实验所用关键产品:埃克替尼(Betta Pharmaceuticals)、RPMI-1640培养基(Gibco)、胎牛血清(HyClone)。
3.2 耐药相关lncRNA筛选
实验目的:筛选耐药细胞中差异表达的lncRNA。
方法细节:对PC9、PC9/IcoRL、PC9/IcoRH细胞进行转录组测序,通过火山图和差异基因分析筛选上调最显著的lncRNA;qRT-PCR验证候选lncRNA在耐药细胞中的表达。
结果解读:转录组测序显示APCDD1L-AS1是耐药细胞中上调最显著的lncRNA(PC9/IcoRH中表达量是PC9的4.2倍,P<0.001);qRT-PCR验证其在PC9/IcoRL、PC9/IcoRH、HCC827/IcoRL、HCC827/IcoRH中均高表达(n=3,P<0.01)。
产品关联:文献未提及具体测序产品,领域常规使用Illumina测序平台。
3.3 APCDD1L-AS1的功能验证
实验目的:明确APCDD1L-AS1对埃克替尼耐药的影响。
方法细节:在耐药细胞中用siRNA或shRNA敲低APCDD1L-AS1,或过表达APCDD1L-AS1;检测IC50、EGFR/p-EGFR表达、凋亡(Annexin V-FITC流式检测、Western blot检测PARP cleavage)。
结果解读:敲低APCDD1L-AS1后,耐药细胞的IC50降低(如PC9/IcoRH的IC50从20 μM降至8 μM,P<0.01);EGFR/p-EGFR表达降低(Western blot显示EGFR下调1.8倍,P<0.05);凋亡率增加(PC9/IcoRH的凋亡率从12%升至35%,n=3,P<0.01);过表达APCDD1L-AS1则呈现相反结果。
产品关联:实验所用关键产品:siRNA(Ribobio)、Jet PRIME转染试剂(Polyplus)。
3.4 APCDD1L-AS1的ceRNA机制研究
实验目的:解析APCDD1L-AS1通过ceRNA调控耐药的机制。
方法细节:用LncBase V2.0预测APCDD1L-AS1的靶miRNA,筛选出miR-1322、miR-1972、miR-324-3p;通过双荧光素酶报告实验(构建野生型/突变型APCDD1L-AS1质粒,与miRNA mimics共转染HEK293细胞)、RIP实验(用AGO2抗体沉淀RNA复合物,qRT-PCR检测结合的RNA)验证相互作用;检测miRNA在耐药细胞中的表达,过表达miRNA mimics或抑制miRNA,观察对耐药性的影响。
结果解读:双荧光素酶报告实验显示,miRNA mimics显著抑制野生型APCDD1L-AS1的 luciferase活性(如miR-1322 mimics使活性降低60%,P<0.01),但对突变型无影响;RIP实验显示APCDD1L-AS1与miRNA均富集于AGO2复合物中(相对于IgG组,富集倍数>3倍,P<0.05);耐药细胞中miRNA表达显著降低(如miR-1322在PC9/IcoRH中的表达是PC9的1/4,P<0.01);过表达miRNA mimics降低IC50(PC9/IcoRL的IC50从10 μM降至4 μM,P<0.01)、EGFR表达(下调1.5倍,P<0.05),增加凋亡;抑制miRNA可逆转APCDD1L-AS1敲低的耐药逆转效果(MTT检测显示细胞活力从40%升至70%,P<0.05)。
产品关联:实验所用关键产品:双荧光素酶报告试剂盒(Promega)、AGO2抗体(Abcam)。
3.5 共同靶基因SIRT5的验证
实验目的:确定miRNA的共同靶基因及功能。
方法细节:用Targetscan预测miRNA的靶基因,结合转录组差异基因分析筛选SIRT5;双荧光素酶报告实验验证miRNA与SIRT5 3’UTR的结合;qRT-PCR、Western blot检测SIRT5在耐药细胞中的表达;敲低SIRT5,检测对耐药性的影响。
结果解读:双荧光素酶报告实验显示,miRNA mimics显著抑制野生型SIRT5 3’UTR的 luciferase活性(如miR-1972 mimics使活性降低55%,P<0.01);耐药细胞中SIRT5 mRNA及蛋白表达显著升高(PC9/IcoRH中SIRT5 mRNA是PC9的3.2倍,P<0.01);敲低SIRT5后,IC50降低(PC9/IcoRH的IC50从20 μM降至7 μM,P<0.01)、EGFR/p-EGFR表达降低(下调1.7倍,P<0.05)、凋亡增加(凋亡率从12%升至32%,n=3,P<0.01)。
产品关联:实验所用关键产品:SIRT5抗体(Sigma-Aldrich)。
3.6 SIRT5调控EGFR自噬降解的机制
实验目的:解析SIRT5维持EGFR蛋白水平的分子途径。
方法细节:用CHX(蛋白合成抑制剂)检测EGFR半衰期,MG-132(蛋白酶体抑制剂)排除蛋白酶体途径,Western blot检测自噬标志物(LC3B、p62),自噬抑制剂(CQ、3-MA)验证自噬的作用。
结果解读:SIRT5敲低后,EGFR半衰期从8 h缩短至4 h(CHX处理后,EGFR蛋白水平在4 h时降至50%以下,P<0.05);MG-132无法恢复EGFR水平,排除蛋白酶体途径;SIRT5敲低后,LC3B-II(自噬体标志)增加1.8倍,p62(自噬底物)降低60%(P<0.01),说明自噬增强;自噬抑制剂CQ可逆转SIRT5敲低导致的EGFR降低(恢复至80%,P<0.05)和凋亡增加(凋亡率从32%降至18%,P<0.05)。
产品关联:实验所用关键产品:CHX(Sigma-Aldrich)、MG-132(Sigma-Aldrich)、CQ(Sigma-Aldrich)、3-MA(Selleck)。
3.7 体内实验验证
实验目的:验证APCDD1L-AS1在体内的作用。
方法细节:将稳定敲低APCDD1L-AS1的PC9/IcoRH细胞(Lv-sh-APCDD1L-AS1)或对照细胞(Lv-NC)接种于裸鼠皮下,给予埃克替尼治疗,测量瘤体体积,检测肿瘤组织中APCDD1L-AS1、miRNA、SIRT5、EGFR的表达,免疫荧光检测LC3B puncta(自噬)、TUNEL检测凋亡。
结果解读:Lv-sh-APCDD1L-AS1组的瘤体体积显著小于Lv-NC组(n=6,P<0.01);肿瘤组织中APCDD1L-AS1、SIRT5表达降低(mRNA水平分别下调60%、50%,P<0.01),miRNA表达升高(miR-1322上调2.5倍,P<0.01);EGFR表达降低(免疫组化评分从8分降至3分,P<0.01);LC3B puncta增加(平均每细胞12个 vs 5个,P<0.01),TUNEL阳性细胞增加(平均灰度值从4.4升至34.4,P<0.01)。
产品关联:实验所用关键产品:慢病毒载体(OBiotech)、免疫组化抗体(EGFR抗体来自Santa,SIRT5抗体来自Sigma-Aldrich)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位
本研究涉及的Biomarker包括:① 耐药相关lncRNA APCDD1L-AS1;② 耐药相关蛋白SIRT5。筛选逻辑为“转录组测序筛选→细胞系验证→临床数据库/体内模型验证”。
4.2 研究过程详述
APCDD1L-AS1的研究:
- 来源:埃克替尼耐药细胞系及裸鼠肿瘤组织。
- 验证方法:转录组测序筛选,qRT-PCR验证其在耐药细胞中高表达,体内模型验证敲低后肿瘤生长受抑制;通过Kaplan-Meier Plotter数据库分析672例肺腺癌患者的生存数据,显示APCDD1L-AS1高表达者总生存期(OS)更短(log rank test,P=0.0048)。
- 特异性与敏感性:APCDD1L-AS1在耐药细胞中的表达量是亲本细胞的3-4倍(n=3,P<0.01);数据库分析显示,高表达组的OS中位数比低表达组短12个月(95% CI 8-16个月)。
SIRT5的研究:
- 来源:埃克替尼耐药细胞系及裸鼠肿瘤组织。
- 验证方法:Targetscan预测结合双荧光素酶报告实验验证其为miRNA的共同靶基因,qRT-PCR、Western blot验证其在耐药细胞中高表达,敲低后逆转耐药;体内模型验证其表达随APCDD1L-AS1敲低而降低。
- 特异性与敏感性:SIRT5在耐药细胞中的mRNA水平是亲本细胞的2-3倍(n=3,P<0.01);Western blot显示蛋白水平上调1.9倍(P<0.05)。
4.3 核心成果提炼
- APCDD1L-AS1:作为埃克替尼耐药的预测Biomarker,高表达与肺腺癌患者OS负相关(HR=1.5,95% CI 1.1-2.0,P=0.0048),首次发现其通过ceRNA网络调控自噬诱导耐药。
- SIRT5:作为APCDD1L-AS1的下游靶标,高表达与耐药相关,可作为逆转耐药的潜在靶点;其通过抑制EGFR自噬降解维持蛋白水平,是“lncRNA-ceRNA-自噬”轴的关键节点。
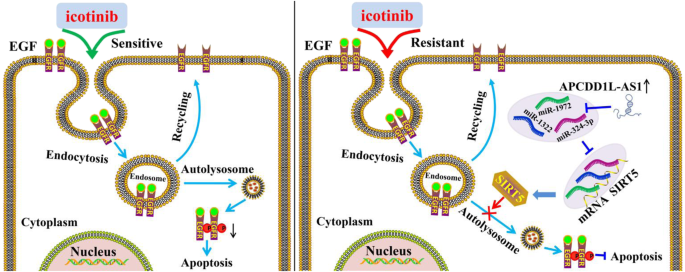
(注:图9为APCDD1L-AS1的作用机制示意图:APCDD1L-AS1 sponge miR-1322/miR-1972/miR-324-3p,促进SIRT5表达,抑制EGFR自噬降解,增加p-EGFR水平,最终诱导埃克替尼耐药。)
