1. 领域背景与文献引入
文献英文标题:Novel insights into MSC-EVs therapy for immune diseases;发表期刊:Biomarker Research;影响因子:未明确;研究领域:间充质基质细胞(MSC)与细胞外囊泡(EVs)在免疫疾病中的应用。
间充质基质细胞(MSC)是一类具有自我更新和多向分化能力的非造血干细胞,其对适应性免疫(如T细胞、B细胞)和固有免疫(如树突状细胞、巨噬细胞)的调节作用已被广泛验证,并作为免疫抑制剂用于移植物抗宿主病(GVHD)、多发性硬化(MS)、系统性红斑狼疮(SLE)等疾病的临床研究。然而,MSC疗法存在疗效变异大的问题——其疗效受来源(骨髓、脐带血)、培养条件、患者炎症微环境等因素影响,部分患者对MSC无响应甚至出现病情加重。近年来,研究发现MSC的免疫调节功能主要依赖旁分泌途径,尤其是其分泌的细胞外囊泡(EVs):MSC-EVs是包裹磷脂双分子层的囊泡,携带miRNA、蛋白、线粒体等生物活性 cargo,可传递至受体细胞发挥作用,且无致瘤性、不易受炎症微环境影响,成为潜在的无细胞免疫疗法。在此背景下,本文系统总结MSC-EVs在免疫疾病中的治疗潜力,旨在解决MSC疗法的局限性,为无细胞免疫治疗提供新见解。
2. 文献综述解析
作者围绕“MSC-EVs的免疫调节机制及临床应用”核心,按“MSC-EVs的特征与cargo→对免疫细胞的调节作用→在免疫疾病中的应用→优势与优化策略”的逻辑分类现有研究,系统梳理MSC-EVs作为无细胞疗法的基础与临床证据。
现有研究的关键结论包括:(1)MSC-EVs的功能依赖于其携带的 cargo——miRNA(如miR-21促进TGF-β信号、let-7b介导抗炎)、可溶性蛋白(如IL-10、TGF-β诱导调节性T细胞)、线粒体(增强巨噬细胞代谢)是主要效应分子;(2)MSC-EVs对适应性免疫(抑制T细胞增殖、促进调节性T细胞生成,抑制B细胞增殖与免疫球蛋白分泌)和固有免疫(诱导树突状细胞向未成熟调节表型分化、促进巨噬细胞向M2型极化)均有调节作用;(3)在GVHD、SLE、1型糖尿病、慢性肾病等模型中,MSC-EVs可降低促炎细胞因子水平、提高肾功能指标,改善疾病症状。
现有研究的局限性:MSC-EVs对IDO(吲哚胺2,3-双加氧酶)活性无显著影响,对B细胞的调节能力弱于MSC;不同实验条件(如MSC来源、培养方式)导致结论矛盾,如部分研究指出MSC-EVs无法抑制淋巴细胞增殖。
文献的创新价值:系统整合MSC-EVs的免疫调节机制(从cargo到免疫细胞)与临床应用证据,强调其作为无细胞疗法的优势(避免炎症微环境极化、穿越血脑屏障);提出优化策略(如预刺激MSC、选择合适来源),为后续研究提供方向。
3. 研究思路总结与详细解析
本文为综述性研究,作者围绕“问题提出→机制阐述→应用总结→优势讨论→优化方向”展开综述,具体思路如下:
3.1 MSC的免疫调节作用与临床局限性
作者首先回顾MSC的基本特征(多能性、免疫调节)及临床应用现状(用于GVHD、MS等疾病),指出其疗效变异大的问题——炎症微环境会影响MSC的激活状态,导致免疫极化。由此引出“MSC的旁分泌作用是其免疫调节的关键”,为后续MSC-EVs的讨论奠定基础。
3.2 MSC-EVs的特征与cargo解析
作者阐述MSC-EVs的定义(包括外泌体、微囊泡)、生物发生(内体途径、细胞膜出芽)及表面标志物(如CD9、CD63);重点分析其 cargo组成:miRNA(如miR-21、let-7b)、蛋白(如IL-10、TGF-β、PEDF)、线粒体是主要效应分子。例如,LPS预处理的脐带血MSC-EVs携带let-7b,可介导抗炎作用;MSC-EVs携带的miR-124可增强星形胶质细胞的抗炎症能力。
3.3 MSC-EVs对免疫细胞的调节机制
作者分两部分讨论:(1)对适应性免疫细胞的作用:抑制T细胞增殖、促进调节性T细胞生成(通过TGF-β、IL-10),抑制B细胞增殖与免疫球蛋白分泌;(2)对固有免疫细胞的作用:诱导树突状细胞向未成熟调节表型分化(降低共刺激分子表达、增加IL-10分泌),促进巨噬细胞向M2型极化(通过STAT3激活arginase-1)。作者通过图1直观展示MSC-EVs对免疫细胞的调节网络:
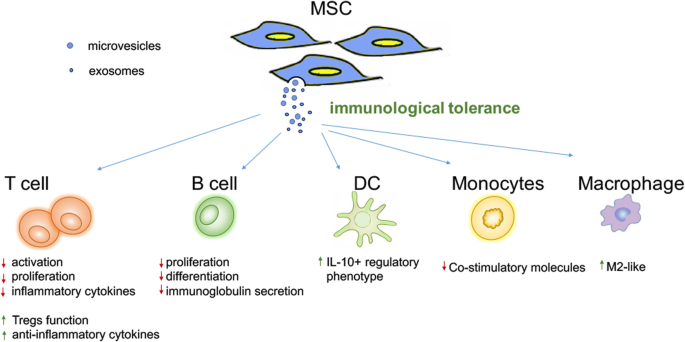
3.4 MSC-EVs在免疫疾病中的应用总结
作者系统总结MSC-EVs在多种免疫疾病模型中的应用:(1)GVHD模型:MSC-EVs可降低IL-1β、TNF-α水平,延长小鼠存活期;(2)SLE模型:MSC-EVs通过传递Fas受体降低miR-29b水平,改善骨量减少;(3)慢性肾病模型:MSC-EVs可提高估算肾小球滤过率(eGFR),增加TGF-β、IL-10水平;(4)1型糖尿病模型:MSC-EVs可抑制抗原提呈细胞激活,预防疾病发生。
3.5 MSC-EVs的优势与优化策略
作者指出MSC-EVs的优势:无致瘤性、不易受炎症微环境影响、可穿越血脑屏障、易标准化生产;同时提到其与MSC的差异:对IDO活性无影响、对B细胞的调节能力较弱。针对这些问题,作者提出优化策略:(1)预刺激MSC(如用IFN-γ、TNF-α处理)以增强EVs的免疫调节分子表达;(2)选择脐带血MSC等来源以获得更均一的EVs;(3)分离外泌体等特定亚型以提高疗效。
4. Biomarker研究及发现成果解析
本文为综述性研究,未聚焦于特定Biomarker的筛选或验证,而是围绕MSC-EVs的免疫调节功能展开。文中提到的MSC-EVs携带的分子 cargo(如miR-21、let-7b、IL-10、TGF-β)可视为与免疫调节相关的候选Biomarker,但未对其特异性、敏感性进行系统验证。例如,miR-21可促进TGF-β信号,但未在临床样本中验证其作为GVHD疗效Biomarker的价值;IL-10可诱导Tregs生成,但未检测其在患者血清中的水平与疾病预后的关联。此外,文中未涉及Biomarker的筛选流程(如数据库筛选→细胞验证→临床验证),也无ROC曲线AUC值、敏感性等数据报道。因此,本文未提供针对免疫疾病的特异性Biomarker发现成果,仅为后续研究提供了候选分子(如MSC-EVs中的miRNA、蛋白)。
注:文中图片均来自原文献,图表编号与内容对应。所有结论基于原文献内容,未添加额外信息。
