1. 领域背景与文献引入
文献英文标题:Heterogeneous expression of EPCAM in human circulating tumour cells from patient-derived xenografts;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学-循环肿瘤细胞(CTC)研究。
癌症转移是全球癌症相关死亡的主要原因,约90%的癌症死亡由肿瘤转移引起。循环肿瘤细胞(CTC)是原发肿瘤释放进入外周血的肿瘤细胞,被认为是肿瘤转移的关键中间步骤——CTC通过血液播散并定植于远处器官,最终形成转移灶。近年来,以CTC分析为核心的“液体活检”因非侵入性、实时监测肿瘤动态等优势成为研究热点,其临床应用涵盖早期癌症诊断、复发风险预测、治疗效果监测及患者分层。然而,现有CTC检测技术存在显著局限性:多数方法依赖上皮细胞黏附分子(EPCAM)等上皮标志物(如临床常用的CellSearch系统),但肿瘤细胞在发生上皮-间质转化(EMT)后,会丢失EPCAM等上皮表型,转化为更具侵袭性的间质样CTC,这类EPCAM阴性的CTC难以被现有方法检测,导致漏检。当前CTC研究的热点是解析CTC的异质性(包括上皮型、间质型及中间型),但未解决的核心问题是“现有EPCAM依赖的检测方法无法覆盖所有CTC亚群”,限制了对CTC生物学功能及临床价值的全面理解。
针对这一瓶颈,本文提出不依赖EPCAM的CTC检测策略:利用患者来源异种移植(PDX)模型(将患者肿瘤组织移植到免疫缺陷小鼠,保留肿瘤异质性且排除人类血液细胞干扰),结合人类特异性定量逆转录PCR(qRT-PCR)技术,直接检测PDX血液中的人类CTC,旨在揭示EPCAM在CTC中的异质性表达,为开发更全面的CTC检测方法提供实验依据。
2. 文献综述解析
本文综述围绕“CTC检测的技术局限性”“现有替代方法的不足”“PDX模型的优势”三条逻辑线展开,系统评述了当前CTC研究的现状与瓶颈。
现有研究的关键结论包括:①CTC的预后价值已被多项临床研究证实(如转移性乳腺癌患者中CTC计数与生存期显著相关),但EPCAM依赖的检测方法在转移性患者中常出现“CTC阴性”结果,提示部分CTC未被捕获;②EMT后的CTC更具肿瘤发生能力(如迁移能力增强、对化疗耐药),但因丢失EPCAM而难被现有方法检测;③尺寸过滤等非标志物依赖的CTC富集方法(如利用CTC体积大于正常血细胞的特点)能提高CTC产量,但需额外的肿瘤特异性标志物验证身份,增加了实验复杂度。现有技术的优势:CellSearch系统是标准化的EPCAM依赖检测方法,适用于临床常规检测;尺寸过滤法无需抗体,能富集更多表型的CTC。局限性:EPCAM依赖的方法漏检EPCAM阴性CTC;尺寸过滤法需额外验证,易引入假阳性。
PDX模型的优势是本文综述的核心亮点:PDX模型通过移植患者肿瘤组织到免疫缺陷小鼠,能在体内保留肿瘤的异质性,且小鼠血液中无人类单核细胞污染,可精准研究人类CTC的基因表达——这为突破现有检测的局限性提供了理想模型。
本文的创新价值在于首次将PDX模型与人类特异性qRT-PCR结合:PDX模型排除了人类血液细胞的干扰,人类特异性引物确保仅检测人类CTC的基因表达,无需预富集即可分析CTC的异质性。这种方法不仅能检测EPCAM阳性的CTC,还能捕获EPCAM阴性的CTC,为全面解析CTC的分子表型提供了新工具。
3. 研究思路总结与详细解析
本文的研究目标是“开发不依赖EPCAM的CTC检测方法”,核心科学问题是“如何利用PDX模型和人类特异性qRT-PCR揭示CTC中EPCAM的异质性表达”,技术路线遵循“PDX模型建立→血液样本收集→RNA提取与逆转录→人类特异性引物设计与验证→qRT-PCR定量检测→数据统计分析”的闭环逻辑,逐步验证方法的可行性并揭示EPCAM的异质性。
3.1 PDX模型建立与血液样本收集
实验目的:构建含人类CTC的PDX模型,收集用于CTC分析的血液样本。
方法细节:将患者手术或活检获取的肿瘤组织移植到6-8周龄雌性无胸腺裸鼠(Athymic Nude-Foxn1nu)的肩胛间区,待肿瘤体积增长至>1500mm³(符合伦理要求的肿瘤大小)时,通过心脏穿刺采集血液(每只小鼠至少采集600-800μl),血液用0.5M EDTA抗凝。随后用ACK裂解缓冲液(Lonza)裂解红细胞,收集外周血单个核细胞(PBMC),冻存于液氮中备用。所有实验均获得医院伦理委员会批准及患者知情同意,小鼠实验符合法国农业食品和林业部的伦理规范。
结果解读:成功建立28个乳腺癌PDX模型,收集到28份PDX小鼠血液样本;3份样本因未检测到人类参考基因(ACTB、OAZ1)被排除,最终纳入25份样本进行后续分析。
3.2 人类特异性引物设计与验证
实验目的:设计能特异性扩增人类基因(避免小鼠基因交叉反应)的引物,为检测PDX血液中的人类CTC奠定基础。
方法细节:利用NCBI的Primer-BLAST工具设计人类特异性引物,针对ACTB(肌动蛋白β,管家基因)、OAZ1(鸟氨酸脱羧酶抗酶1,管家基因)、EPCAM(上皮细胞黏附分子)、KRT19(角蛋白19)设计引物,要求引物序列无人类与小鼠同源性,优先选择跨exon或靶向UTR的引物(避免基因组DNA污染)。通过人类乳腺癌细胞系(ZR-75-1、MCF-7、MDA-MB-231)和naive小鼠血液验证引物特异性:提取RNA并逆转录为cDNA后,进行RT-PCR和嵌套PCR(提高检测灵敏度),产物用2%低熔点琼脂糖凝胶电泳分析。
结果解读:引物能特异性扩增人类细胞系的目标基因(如EPCAM在人类细胞系中出现预期大小的条带),而naive小鼠血液中无扩增产物(图1),证明引物具有严格的人类特异性,无小鼠基因交叉反应。
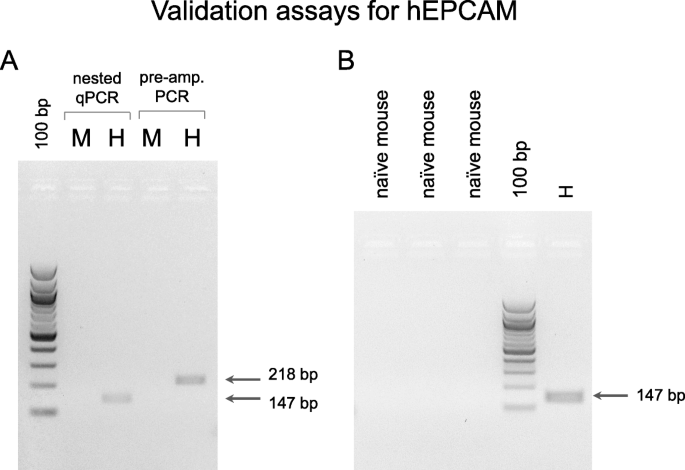
3.3 定量PCR检测与数据处理
实验目的:定量检测PDX血液中人类CTC的基因表达(管家基因与CTC标志物),并处理低丰度转录本的未检测值。
方法细节:从PDX小鼠PBMC中提取总RNA(Trizol,Invitrogen),用NanoDrop ND-1000分光光度计(Thermo Fischer)评估RNA质量(A260/A280比值>1.8)。取1μg总RNA,用随机六聚体和SuperScript II逆转录酶(Life Technologies)逆转录为cDNA。为检测低丰度的人类转录本,对cDNA进行14循环预扩增(DreamTaq DNA聚合酶,Life Technologies,退火温度58℃),随后用嵌套引物进行qPCR(Bio-Rad CFX96 Touch平台,PowerUp SYBR Green Master Mix,Applied Biosystems)。以小鼠Actb(mActb)为内参基因,归一化人类基因的表达;用R语言“nondetects”包的期望最大化(EM)算法估算未检测到的Ct值(即Ct>40的样本)。
结果解读:naive小鼠血液中未检测到人类参考基因(Ct>40),证明无假阳性;25份PDX样本均检测到人类ACTB和OAZ1表达(图2),说明样本中存在人类CTC;EPCAM和KRT19的表达在不同样本中差异显著,提示CTC的异质性。
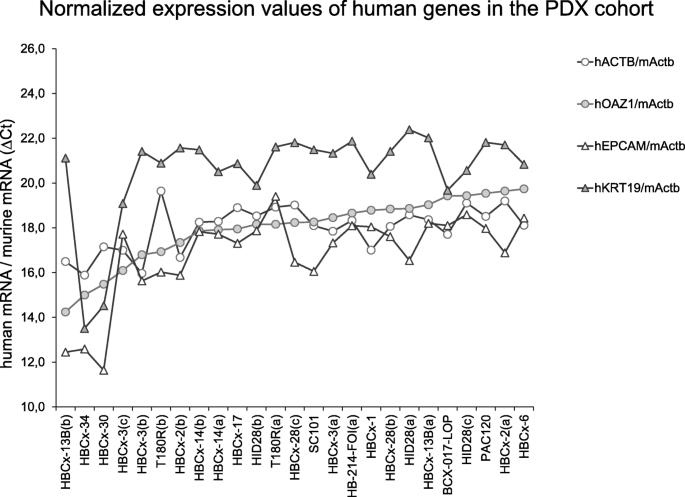
3.4 基因表达相关性分析
实验目的:分析EPCAM、KRT19与人类管家基因的表达相关性,验证EPCAM的异质性。
方法细节:用SPSS 23软件计算EPCAM/KRT19与ACTB/OAZ1的Spearman相关系数——若EPCAM在CTC中均一表达,则其与管家基因的表达应显著正相关;若存在异质性,则相关性不显著。
结果解读:人类管家基因ACTB与OAZ1的表达显著相关(Spearman’s rho=0.462,p<0.05,n=25),符合管家基因的表达特征;EPCAM与ACTB的相关性(Spearman’s rho=0.219,p>0.05,n=25)及EPCAM与OAZ1的相关性(Spearman’s rho=0.152,p>0.05,n=25)均无统计学意义(图3);KRT19的表达模式与EPCAM类似,同样无显著相关性(图4)。这一结果提示,EPCAM在CTC中的表达并非均一——部分CTC高表达EPCAM,部分CTC低表达或不表达EPCAM,证实了CTC的异质性。

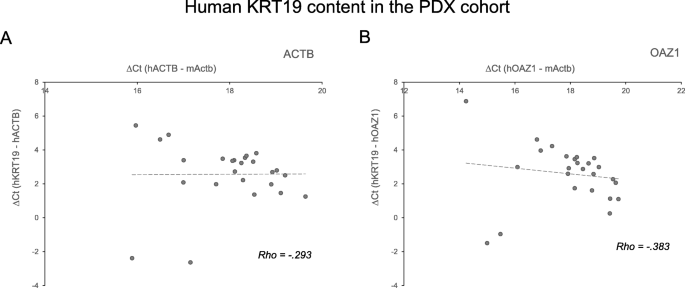
实验所用关键产品:ACK裂解缓冲液(Lonza)、Trizol(Invitrogen)、SuperScript II逆转录酶(Life Technologies)、DreamTaq DNA聚合酶(Life Technologies)、PowerUp SYBR Green Master Mix(Applied Biosystems);仪器包括NanoDrop ND-1000分光光度计(Thermo Fischer)、Bio-Rad CFX96 Touch qPCR仪。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker为上皮细胞黏附分子(EPCAM)和角蛋白19(KRT19),均为传统CTC上皮标志物。研究通过“PDX模型筛选→人类特异性qRT-PCR验证→相关性分析”的逻辑链,揭示了EPCAM在CTC中的异质性表达,为突破现有CTC检测的局限性提供了依据。
Biomarker定位与验证逻辑
EPCAM和KRT19是当前CTC检测中最常用的上皮标志物,本文旨在验证这两个标志物在CTC中的表达异质性。筛选逻辑:利用PDX模型排除人类血液细胞干扰,确保仅分析肿瘤来源的CTC;验证逻辑:通过人类特异性qRT-PCR定量检测标志物表达,结合相关性分析评估其与管家基因的关联(反映表达均一性)。
研究过程与数据解析
Biomarker来源为PDX小鼠血液中的人类CTC(排除了人类正常细胞的污染);验证方法采用人类特异性嵌套qRT-PCR——先通过预扩增提高低丰度转录本的检测灵敏度,再用嵌套引物进行定量,确保结果的特异性和准确性;特异性通过naive小鼠血液无扩增(无假阳性)验证,敏感性通过预扩增步骤(检测低丰度CTC转录本)提高。
数据方面:25份PDX样本中,EPCAM的表达水平在不同样本中差异显著(图2),且与人类管家基因(ACTB、OAZ1)无显著相关性(p>0.05);KRT19的表达模式与EPCAM类似,同样无显著相关性。
核心成果与创新性
①EPCAM表达异质性:首次在PDX模型中证实,EPCAM在CTC中的表达并非均一——部分CTC高表达EPCAM,部分CTC低表达或不表达EPCAM,这解释了为何现有EPCAM依赖的方法会漏检部分CTC;
②方法学创新:证明PDX模型与人类特异性qRT-PCR结合的方法能有效检测异质的CTC,包括EPCAM阴性的CTC,为开发更全面的CTC检测方法(如同时检测EPCAM和间质标志物)提供了实验基础;
③临床意义:EPCAM异质性的发现提示,仅依赖EPCAM的CTC检测可能低估患者的肿瘤负荷,需结合多标志物(如上皮+间质标志物)才能全面捕获CTC,提升临床应用价值。
统计学结果:ACTB与OAZ1的表达显著相关(Spearman’s rho=0.462,p<0.05,n=25);EPCAM与ACTB、OAZ1的相关性均无统计学意义(p>0.05,n=25)。
