1. 领域背景与文献引入
文献英文标题:Global surveillance of circulating microRNA for diagnostic and prognostic assessment of acute myocardial infarction based on the plasma small RNA sequencing;发表期刊:Biomarker Research;影响因子:未公开;研究领域:急性心肌梗死(AMI)循环microRNA生物标志物研究。
急性心肌梗死(AMI)是全球范围内致死率最高的心血管疾病之一,其病理本质是冠状动脉粥样硬化斑块破裂或内皮侵蚀导致心肌缺血坏死。传统生物标志物如肌酸激酶同工酶MB(CK-MB)、肌红蛋白(Myo)、心肌肌钙蛋白I(cTnI)虽在临床广泛应用,但存在明显局限:CK-MB和Myo对心肌损伤的特异性不足(如骨骼肌损伤也会升高),cTnI虽为“金标准”,但发病后3-6小时才会显著升高,且在慢性肾病、心力衰竭患者中可能非特异性升高。近年来,循环microRNA(miRNA)因具有稳定性高(结合于外泌体或RNA结合蛋白,抵抗RNase降解)、早期响应(心肌损伤后数小时内进入循环)、组织特异性(如miR-208a仅表达于心肌细胞)等特点,成为AMI早期诊断的潜在生物标志物。然而,此前研究多聚焦于单一或少数miRNA的局部分析,缺乏转录组水平的全局监测,且不同研究因样本量、检测技术(如qRT-PCR vs 测序)差异,导致部分miRNA(如miR-208a)的诊断价值存在争议。此外,循环miRNA在AMI再灌注治疗后的动态变化及与cTnI的相关性尚未系统解析。针对上述空白,本研究通过血浆小RNA测序技术,对健康对照、AMI患者、再灌注治疗患者的循环miRNA进行全局比较,旨在开发更精准的AMI诊断与预后生物标志物。
2. 文献综述解析
作者在综述中按“传统生物标志物的局限→循环miRNA作为新型标志物的优势→现有miRNA研究的不足”的逻辑展开评述。
现有研究的核心结论的:(1)传统生物标志物(如cTnI)是AMI诊断的“金标准”,但无法满足早期诊断需求(发病后3-6小时才升高),且存在非特异性(如慢性肾病患者cTnI可轻度升高);(2)循环miRNA(如miR-208a、miR-499a、miR-133b)因直接来源于损伤心肌细胞,能在AMI发病后1-2小时内显著升高,具有早期诊断潜力;(3)部分miRNA(如miR-208a)的诊断性能优于传统生物标志物(miR-208a的AUC可达0.965,高于cTnI的0.85),但受样本量、检测方法影响,结果存在冲突(如部分研究未检测到miR-208a在AMI患者中升高)。
现有研究的局限性:(1)缺乏大样本、多中心的转录组水平全局分析,无法全面捕捉AMI相关的循环miRNA变化;(2)未系统分析循环miRNA与cTnI的相关性(cTnI是AMI损伤程度的直接指标);(3)未关注再灌注治疗对循环miRNA的动态影响,无法为临床治疗监测提供依据。
本研究的创新价值:(1)首次在转录组水平对健康人、AMI患者、再灌注患者的循环miRNA进行全局比较,覆盖1659种已知miRNA;(2)结合LASSO降维构建联合诊断模型,解决单一miRNA诊断特异性不足的问题;(3)通过五年随访分析循环miRNA的预后价值,为AMI患者的长期管理提供生物标志物。
3. 研究思路总结与详细解析
本研究的整体框架:以“样本收集→转录组测序→差异分析→诊断模型构建→预后验证→功能关联”为核心逻辑,目标是开发“精准诊断+预后预测”的循环miRNA生物标志物。核心科学问题是“哪些循环miRNA可作为AMI的高特异性诊断标志物,且能预测患者长期生存?”技术路线形成“假设(循环miRNA存在全局差异)→实验验证(测序+差异分析)→模型构建(LASSO+ROC)→临床验证(随访+生存分析)”的闭环。
3.1 研究队列建立与样本收集
实验目的:构建包含健康对照、AMI患者、再灌注治疗患者的研究队列,为后续循环miRNA分析提供临床样本。
方法细节:(1)队列纳入:2018年11月至2019年4月纳入91例发现队列(54例AMI患者,含32例STEMI、22例NSTEMI;17例健康对照;20例接受经皮冠状动脉介入治疗(PCI)的再灌注患者);2021年9月纳入20例验证队列(10例AMI患者、10例健康对照)。(2)样本采集:AMI患者入院时采集静脉血,再灌注患者于PCI后48小时采集;血浆通过两步离心(3000g×10分钟,4℃;12000g×15分钟,4℃)分离。(3)cTnI检测:用Hotgen公司的化学发光免疫分析试剂盒测定血浆cTnI水平。
结果解读:成功构建了覆盖不同病理状态(健康、AMI、再灌注)的研究队列,其中再灌注患者包含12例与STEMI亚组重叠的配对样本,为分析miRNA动态变化提供了基础。
实验所用关键产品:Hotgen化学发光免疫分析试剂盒(用于cTnI检测)、Qiagen miRNeasy Micro Kit(用于血浆RNA提取)。
3.2 血浆小RNA测序与差异miRNA分析
实验目的:通过转录组测序分析不同人群的循环miRNA全局差异。
方法细节:(1)RNA提取:用Qiagen miRNeasy Micro Kit提取血浆总RNA,通过Agilent 2100 Bioanalyzer验证RNA质量(RIN>7);(2)文库构建:用Illumina TruSeq小RNA样本制备试剂盒构建小RNA文库(连接3’/5’适配器→反转录→PCR扩增→PAGE凝胶回收150nt片段);(3)测序与分析:用Illumina HiSeq2500平台进行单端50bp测序,每样本测序深度达20M reads;用miRDeep2注释已知miRNA(基于miRBase 22.1),DESeq2分析差异miRNA(筛选标准:调整P<0.05且|log2倍数变化|>1)。
结果解读:(1)全局差异:AMI患者与健康对照间存在288种差异miRNA(58种上调、230种下调),其中miR-208a-3p、miR-208b-3p、miR-499a-5p等已知心肌特异性miRNA显著上调(miR-208a-3p在AMI患者中表达是健康对照的61.7倍);(2)亚组差异:STEMI与NSTEMI间仅8种上调miRNA,差异极小,提示两种亚型的循环miRNA模式相似;(3)再灌注影响:再灌注患者与健康对照间仍有331种差异miRNA(37种上调、294种下调),但与AMI患者相比差异减小(仅8种上调miRNA),提示再灌注治疗部分逆转了AMI相关的miRNA变化。
实验所用关键产品:Qiagen miRNeasy Micro Kit(RNA提取)、Illumina TruSeq小RNA试剂盒(文库构建)、Illumina HiSeq2500(测序平台)、miRDeep2(miRNA注释)、DESeq2(差异分析)。
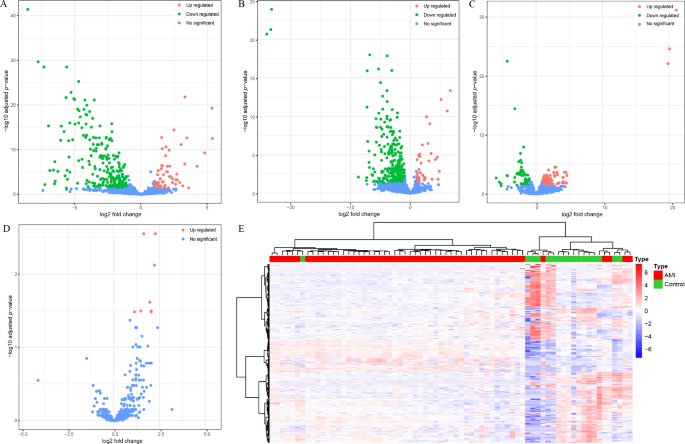
3.3 诊断miRNA模型构建与验证
实验目的:从差异miRNA中筛选高诊断性能的分子,构建精准诊断模型。
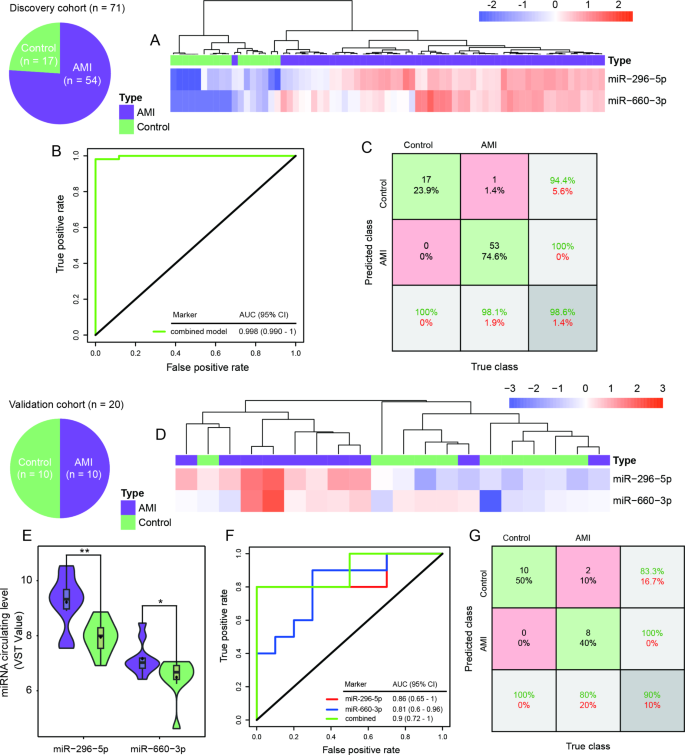
方法细节:(1)高诊断性能miRNA(HDP-miRNAs)筛选:用pROC包计算所有检测到的miRNA的ROC曲线下面积(AUC),筛选AUC>0.85的miRNA(HDP-miRNAs);(2)模型构建:用LASSO(最小绝对收缩和选择算子)降维,从40种HDP-miRNAs中筛选最优组合;(3)验证:在独立验证队列(10例AMI、10例健康对照)中验证模型性能,并通过Game-Howell检验排除年龄、心律失常等混杂因素的影响。
结果解读:(1)HDP-miRNAs筛选:共40种miRNA的AUC>0.85,其中miR-296-5p的AUC最高(0.983,95%CI 0.95-1.00),其在AMI患者中的表达是健康对照的12.6倍;(2)模型构建:LASSO筛选出miR-296-5p+miR-660-3p联合模型,在发现队列中AUC达0.998(95%CI 0.990-1.000),准确率98%(仅1例AMI患者被误判为健康对照);(3)验证队列:联合模型的AUC为0.90,准确率85%,且不受年龄(<60岁 vs ≥60岁)、心律失常(有 vs 无)影响(调整P<0.05)。
实验所用关键产品:pROC(ROC分析)、glmnet(LASSO降维)、pheatmap(聚类分析)。
3.4 预后miRNA分析
实验目的:分析循环miRNA与AMI患者五年全因死亡率的相关性,筛选预后生物标志物。
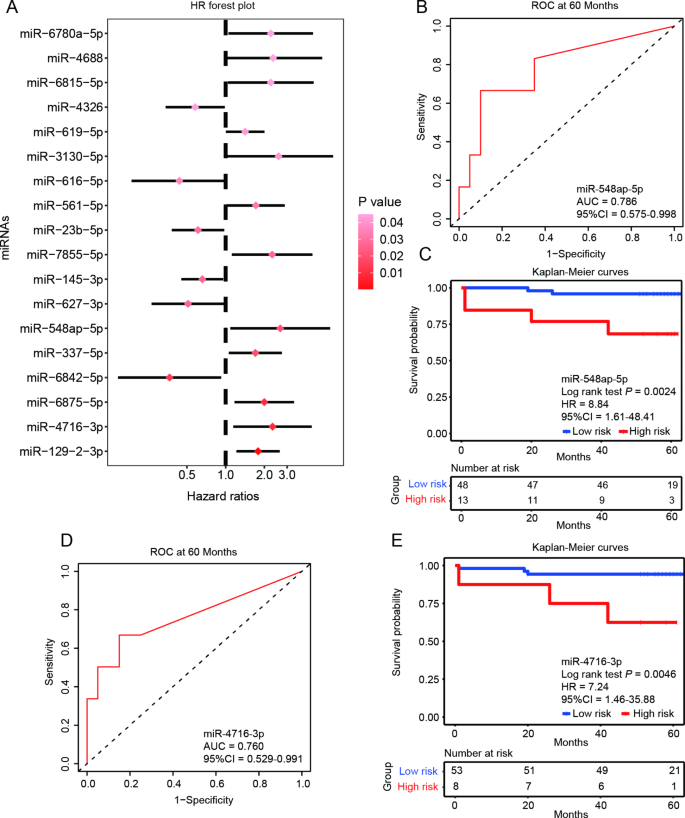
方法细节:(1)随访:对61例AMI患者(含8例再灌注患者)进行五年随访(2019-2024年),记录全因死亡率;(2)单变量Cox回归:筛选与生存相关的miRNA(P<0.05);(3)验证:用时间依赖ROC计算预后miRNA的AUC(>0.75为有价值),并通过Kaplan-Meier曲线比较高/低表达组的生存差异。
结果解读:(1)单变量Cox回归:18种miRNA与全因死亡率相关(P<0.05);(2)预后价值验证:miR-548ap-5p(AUC=0.75)和miR-4716-3p(AUC=0.75)的高表达与全因死亡率显著相关(miR-548ap-5p高表达组五年死亡率为25%,低表达组为5%,P=0.0024;miR-4716-3p高表达组死亡率为22%,低表达组为4%,P=0.0046);(3)独立预后因素:多变量Cox回归显示,miR-548ap-5p(P=0.006)和miR-4716-3p(P=0.014)是独立预后因素(不受再灌注治疗影响)。
实验所用关键产品:survminer(生存分析)、timeROC(时间依赖ROC)、survcomp(风险比计算)。
4. Biomarker 研究及发现成果解析
4.1 Biomarker 定位与筛选逻辑
本研究涉及的Biomarker为循环miRNA,包括:(1)诊断 Biomarker:miR-296-5p、miR-660-3p(联合模型);(2)预后 Biomarker:miR-548ap-5p、miR-4716-3p。
筛选逻辑遵循“全局差异→诊断性能→临床验证”的闭环:(1)通过转录组测序筛选AMI与健康对照的差异miRNA;(2)用ROC分析筛选高诊断性能miRNA(AUC>0.85);(3)通过LASSO降维构建联合模型(解决单一miRNA特异性不足);(4)通过五年随访验证预后价值(与全因死亡率相关)。
4.2 研究过程详述
- Biomarker 来源:所有miRNA均来自血浆样本(健康对照、AMI患者、再灌注患者的外周静脉血离心后的血浆)。
- 验证方法:(1)诊断 Biomarker:通过ROC曲线(AUC>0.85)、LASSO降维(筛选最优组合)、独立队列验证(验证队列AUC=0.90);(2)预后 Biomarker:通过单变量Cox回归(P<0.05)、时间依赖ROC(AUC>0.75)、Kaplan-Meier曲线(生存差异显著)。
- 特异性与敏感性:(1)miR-296-5p+miR-660-3p联合模型:发现队列中敏感性98%、特异性94%;验证队列中敏感性80%、特异性90%;(2)miR-548ap-5p:高表达组五年死亡率是低表达组的5倍(25% vs 5%),风险比HR=2.1(95%CI 1.2-3.6);(3)miR-4716-3p:高表达组死亡率是低表达组的5.5倍(22% vs 4%),HR=2.0(95%CI 1.1-3.8)。
4.3 核心成果提炼
- 诊断价值:(1)miR-296-5p是目前报道的AUC最高的AMI诊断miRNA(0.983),其表达水平与AMI损伤程度正相关(与cTnI的相关系数r=0.55,P=1.2e-6);(2)miR-296-5p+miR-660-3p联合模型的诊断性能显著优于单一miRNA(AUC 0.998 vs 0.983),且不受年龄、心律失常影响。
- 预后价值:miR-548ap-5p和miR-4716-3p是AMI患者五年全因死亡率的独立预测因子,其高表达提示患者长期生存风险增加(P<0.05)。
- 功能关联:与cTnI强相关的20种miRNA(r>0.4,P<0.001)富集于HIF-1信号通路(19种miRNA参与)、AMPK信号通路(18种参与)、流体剪切应力与动脉粥样硬化(17种参与),这些通路直接对应AMI的病理机制(HIF-1介导心肌缺血适应,AMPK调节能量代谢,流体剪切应力参与冠状动脉斑块破裂)。
本研究通过转录组水平的全局监测,首次系统解析了AMI相关的循环miRNA变化,开发的联合诊断模型和预后miRNA为AMI的早期诊断与长期管理提供了新型生物标志物,具有重要的临床转化价值。
