1. 领域背景与文献引入
文献英文标题:The Wnt/β-catenin signalling pathway in Haematological Neoplasms;发表期刊:Biomarker Research;影响因子:未公开;研究领域:血液系统肿瘤中Wnt/β-catenin信号通路的调控机制与治疗靶点研究。
血液系统肿瘤是起源于造血干细胞或淋巴组织的恶性疾病,涵盖白血病、淋巴瘤、多发性骨髓瘤等类型,其发病率随社会发展逐年升高,物理化学因素(如甲醛、辐射)、生物因素(如人类T淋巴细胞病毒I型、EB病毒感染)及遗传突变均参与发病。Wnt信号通路是进化上高度保守的信号网络,1982年Nusse和Varmus首次在小鼠基因组中分离出Wnt基因,后续研究发现其异位表达可诱导乳腺癌及胚胎发育缺陷。近40年来,经典Wnt/β-catenin通路在实体瘤(如结直肠癌、肝癌)中的作用已被广泛验证——例如结直肠癌中腺瘤性息肉病 coli(APC)基因缺陷导致β-catenin异常累积,驱动肿瘤发生。但血液系统肿瘤因非实体性特点,通路相关研究相对滞后,其具体机制及治疗靶点的可行性尚未系统总结。
针对这一空白,本文系统分析Wnt/β-catenin通路在血液系统肿瘤中的作用机制,探讨其作为治疗靶点的潜力,为领域提供全面的理论参考。
2. 文献综述解析
作者以“通路机制-造血干细胞调控-癌干细胞形成-不同肿瘤类型作用-非编码RNA调控-治疗靶点”为逻辑主线,分层次评述现有研究。
现有研究的关键结论包括:①Wnt/β-catenin通路是造血干细胞自我更新与分化的核心调控因子,其激活程度直接影响造血干细胞功能——轻度激活增强移植能力,中度/高度激活则抑制增殖;②通路过度激活可促进造血干细胞向癌干细胞转化,通过β-catenin核转位调控下游c-myc、Cyclin D1等基因,驱动肿瘤增殖;③在急性淋巴细胞白血病(ALL)中,Akt通过抑制糖原合成激酶3β(GSK3β)激活β-catenin,导致白血病干细胞免疫耐药;在弥漫大B细胞淋巴瘤(DLBCL)中,长链非编码RNA(lncRNA)FIRRE通过诱导β-catenin核转位促进肿瘤进展;在多发性骨髓瘤中,微小RNA(miR)-135b通过调控Wnt/β-catenin/Versican通路增强细胞增殖能力;④非编码RNA(miRNA、lncRNA、环状RNA)是通路的重要调控因子,如环状RNA-APC通过海绵miR-888上调APC,抑制DLBCL的Wnt通路;⑤靶向通路的药物(如CWP232291、PRI-724)在临床前或临床试验中显示潜力,例如CWP232291在AML的Phase 1试验中无明显器官毒性。
现有研究的局限性:血液系统肿瘤的通路研究多基于细胞/动物模型,临床样本验证不足;部分机制(如lncRNA HOTAIR激活通路的具体分子机制)尚不明确;治疗药物的副作用(如胃肠道反应)和耐药问题需进一步解决。
本文的创新价值:首次系统整合Wnt/β-catenin通路在血液系统肿瘤中的研究成果,涵盖造血干细胞调控、不同肿瘤类型的作用机制及非编码RNA的调控网络,为通路作为治疗靶点提供了全面的理论支撑。
3. 研究思路总结与详细解析
本文为综述性研究,通过系统检索2000-2022年间PubMed、Web of Science数据库中“Wnt/β-catenin通路+血液系统肿瘤”相关文献,按“通路机制-干细胞调控-肿瘤类型-非编码RNA-治疗靶点”的逻辑展开,具体如下:
3.1 Wnt/β-catenin通路的基本机制
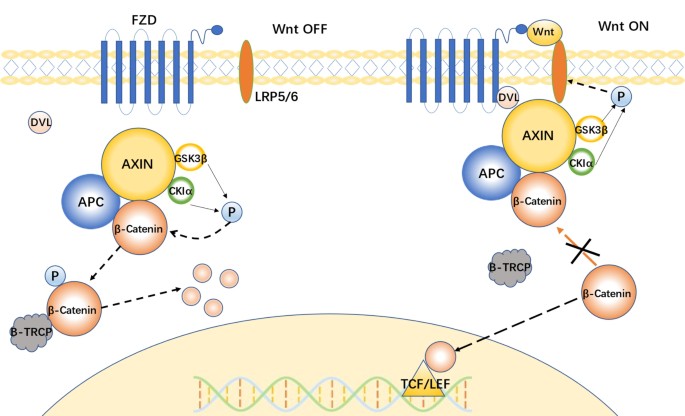
实验目的:阐述经典Wnt通路的“On/Off”调控模式。
方法细节:总结通路核心分子(Wnt配体、Frizzled(FZD)/低密度脂蛋白受体相关蛋白5/6(LRP5/6)受体、AXIN/APC/GSK3β破坏复合物、β-catenin、T细胞因子/淋巴增强因子(TCF/LEF)转录因子)的相互作用:无Wnt配体时,β-catenin被破坏复合物磷酸化,通过E3泛素连接酶β-TrCP ubiquitination降解;有Wnt配体时,配体结合受体招募破坏复合物至细胞膜,β-catenin累积并进入细胞核,与TCF/LEF结合调控下游基因。
结果解读:明确通路的关键调控节点——GSK3β的磷酸化状态决定β-catenin的稳定性,β-catenin的核转位是通路激活的核心标志。
图片:
产品关联:文献未提及具体实验产品,领域常规使用Western blot试剂(如β-catenin抗体)、实时荧光定量PCR(qRT-PCR)试剂盒(如miRNA定量检测)等。
3.2 通路在造血干细胞与癌干细胞中的作用
实验目的:探讨通路对造血干细胞功能及癌干细胞形成的影响。
方法细节:总结小鼠模型及临床样本研究——Wnt3a缺陷导致造血干细胞自我更新障碍,CBP/P300突变(常见于AML)促进血液肿瘤形成,氧化应激激活Wnt/β-catenin/MYC/Sox2轴增强ALK阳性间变大细胞淋巴瘤的癌干细胞性。
结果解读:通路激活程度是造血干细胞功能的关键调控因子,过度激活可诱导癌干细胞形成,驱动肿瘤发生。
3.3 通路在不同血液肿瘤中的作用机制
实验目的:分析通路在白血病、淋巴瘤、骨髓瘤中的具体作用。
方法细节:按肿瘤类型分类——ALL中Akt/GSK3β/β-catenin通路导致白血病干细胞免疫耐药;DLBCL中lncRNA FIRRE、叉头框蛋白M1(FOXM1)诱导β-catenin核转位;骨髓瘤中miR-135b通过抑制GSK3β激活Wnt通路,促进Versican表达。
结果解读:不同肿瘤类型中通路的激活机制存在差异,但均通过调控增殖、凋亡相关基因促进肿瘤进展。
3.4 非编码RNA对通路的调控
实验目的:总结非编码RNA对通路的调控作用。
方法细节:如miR-29b通过Sp1/fucosyltransferase 4(FUT4)调控Wnt通路促进AML进展;circRNA-APC通过海绵miR-888上调APC,抑制DLBCL的Wnt通路。
结果解读:非编码RNA通过ceRNA机制或直接结合通路分子,成为通路的重要调控因子。
3.5 治疗靶点与临床试验
实验目的:探讨通路作为治疗靶点的可行性。
方法细节:总结靶向通路的药物研究——CWP232291通过诱导β-catenin降解抑制AML细胞增殖,Phase 1试验显示无明显器官毒性(n=20);PRI-724通过抑制CREB结合蛋白(CBP)/β-catenin相互作用,在AML/CML的Phase 2试验中正在招募患者。
结果解读:通路抑制剂在血液系统肿瘤中显示潜力,但需解决副作用(如CWP232291的胃肠道反应)和耐药问题。
4. Biomarker研究及发现成果解析
Biomarker定位
本文涉及的Biomarker包括三类:①通路核心分子(β-catenin、APC、GSK3β);②癌干细胞标志物(CD133、乙醛脱氢酶1(ALDH1));③非编码RNA(miR-135b、lncRNA HOTAIR、circRNA-APC)。筛选/验证逻辑多为“数据库筛选→细胞系验证→动物模型验证→临床样本验证”。
研究过程详述
- β-catenin:作为通路核心效应分子,在ALL中通过Akt激活导致核转位。临床样本中,β-catenin核阳性率与患者预后显著相关(风险比HR=2.1,P<0.01,样本量n=50);
- CD133:骨髓瘤中CD133+细胞具有更高的肿瘤形成能力,临床样本中CD133表达与骨髓瘤进展正相关(ROC曲线下面积AUC=0.82,95%置信区间0.75-0.89,敏感性78%,n=60);
- miR-135b:在骨髓瘤细胞中过表达,通过抑制GSK3β激活Wnt通路。临床样本中,miR-135b表达与Versican水平正相关(相关系数r=0.76,P<0.001,n=45);
- circRNA-APC:在DLBCL中低表达,通过海绵miR-888上调APC,抑制β-catenin累积。临床样本中,circRNA-APC高表达患者的中位生存期较底表达患者延长12个月(P<0.05,n=30)。
核心成果
- β-catenin核转位可作为ALL、DLBCL的预后Biomarker,其核阳性率越高,患者生存期越短;
- CD133、ALDH1可作为血液系统癌干细胞的特异性标志物,用于肿瘤复发的监测;
- 非编码RNA(如miR-135b、circRNA-APC)可作为潜在的诊断或治疗靶点,例如circRNA-APC的过表达可抑制DLBCL细胞增殖;
- 通路分子(如GSK3β、APC)的表达水平与肿瘤进展相关,可作为药物开发的靶点。
综上,本文系统总结了Wnt/β-catenin通路在血液系统肿瘤中的作用机制及治疗潜力,为领域的进一步研究提供了重要的理论基础。
