1. 领域背景与文献引入
文献英文标题:NUAK1 coordinates growth factor-dependent activation of mTORC2 and Akt signaling;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:肿瘤信号通路(Akt/mTORC2信号调控)。
mTOR(机制性雷帕霉素靶蛋白)作为进化保守的丝氨酸/苏氨酸激酶,通过形成mTORC1(调控代谢与翻译)与mTORC2(调控细胞骨架与存活)两个复合物发挥核心功能。其中mTORC2通过磷酸化Akt的Ser473位点诱导其完全激活,是Akt信号通路的关键上游调控因子。尽管Akt信号在肿瘤发生、耐药中的作用已被广泛证实,但生长因子刺激下mTORC2/Akt激活的精准调控机制仍未完全解析,尤其是上游调控因子的交叉对话研究存在空白。
NUAK1(AMPK相关激酶5)是AMPK家族成员,其激活依赖LKB1(Thr211磷酸化)与Akt(Ser600磷酸化),已知参与肿瘤细胞增殖、存活及代谢重编程,但在生长因子依赖的信号通路中的功能尚未阐明。针对“生长因子刺激下mTORC2/Akt激活的上游调控”这一领域缺口,本研究旨在揭示NUAK1在mTORC2/Akt信号中的作用及分子机制,为靶向Akt信号的癌症治疗提供新的理论依据与潜在靶点。
2. 文献综述解析
文献综述以“mTORC2/Akt信号的核心地位→现有研究局限→NUAK1的研究缺口”为逻辑主线,系统梳理领域现状:
- mTORC2/Akt信号的重要性:mTORC2通过磷酸化Akt Ser473调控细胞存活与增殖,其功能异常与癌症密切相关,但生长因子刺激下的上游调控机制未明。
- Akt信号的临床意义:Akt过度激活由PI3K突变、PTEN缺失等驱动,是肿瘤耐药的关键机制,但单药靶向Akt/mTOR易引发反馈激活。
- NUAK1的研究现状:NUAK1作为促癌因子,参与调控p53、MYPT1等通路,但在生长因子信号中的作用及与mTORC2/Akt的关联尚未报道。
现有研究的局限在于:① mTORC2在生长因子下的上游调控因子不清;② NUAK1在生长因子信号中的功能未知。本研究的创新点在于首次发现NUAK1通过“调控mTOR溶酶体定位”与“直接磷酸化Akt Ser473”双重机制,调控生长因子依赖的Akt激活,且其亚细胞定位(早期内体)决定了Akt底物的特异性(如FOXO1/3a而非TSC2)。这一发现填补了NUAK1在生长因子信号中的研究空白,为联合靶向NUAK1与Akt/mTOR的治疗策略提供了理论支持。
3. 研究思路总结与详细解析
本研究围绕“NUAK1调控生长因子依赖的mTORC2/Akt信号”核心问题,采用“机制研究→功能验证→临床转化”的闭环设计,具体分为以下关键环节:
3.1 NUAK1与mTORC2组分的相互作用
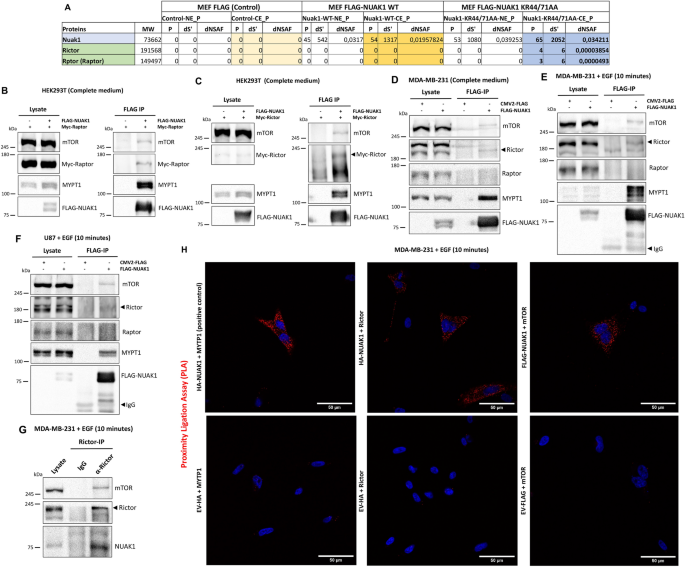
实验目的:验证NUAK1与mTORC2核心组分的相互作用。
方法细节:通过免疫共沉淀(IP)实验,在HEK293T细胞中过表达FLAG-NUAK1与Myc-Raptor/Myc-Rictor,检测内源性mTOR的结合;在MDA-MB-231、U87细胞中进行内源性Rictor IP,验证NUAK1与mTORC2的结合;利用邻近连接试验(PLA)检测EGF刺激下NUAK1与Rictor/mTOR的近端相互作用(n=3)。
结果解读:NUAK1与mTOR、Rictor(mTORC2组分)结合,但不与Raptor(mTORC1组分)结合;EGF刺激(10min)增强了内源性Rictor与NUAK1的相互作用;PLA实验显示NUAK1与Rictor/mTOR存在生长因子依赖的近端相互作用(红色荧光点显著增加)。
产品关联:实验所用抗体(Anti-NUAK1、Anti-mTOR、Anti-Rictor)来自Cell Signaling,PLA试剂盒为Sigma的Duolink In Situ Red Starter Kit。
3.2 NUAK1对mTOR溶酶体定位及溶酶体positioning的调控
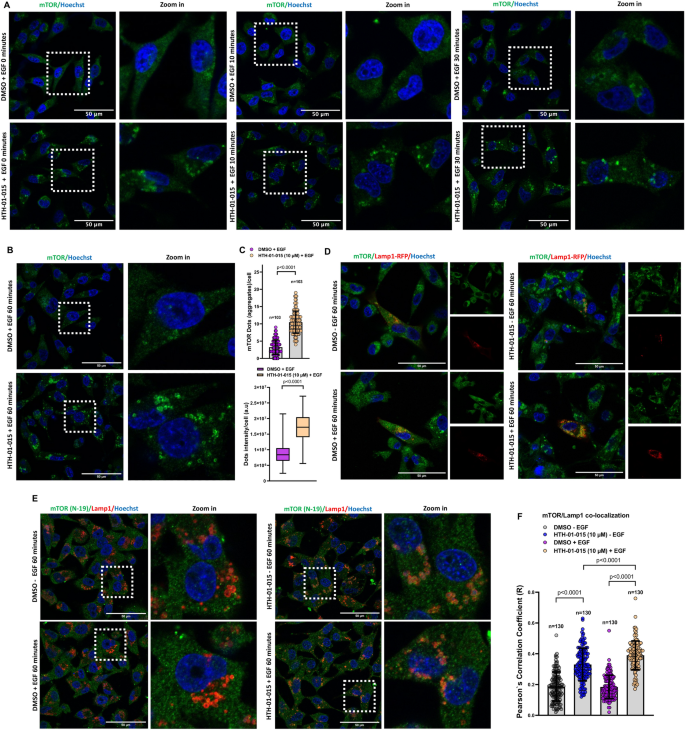
实验目的:研究NUAK1对mTOR亚细胞定位及溶酶体位置的影响。
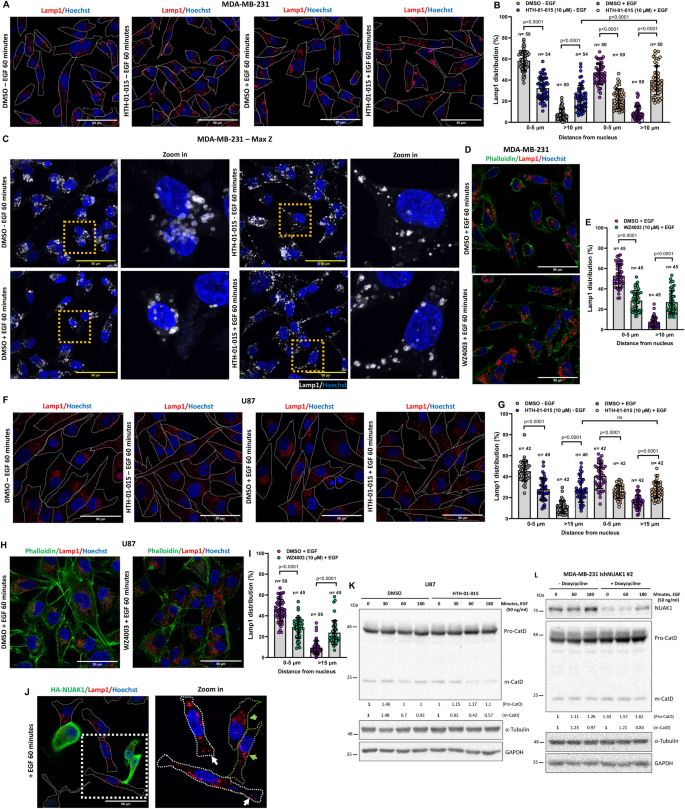
方法细节:用NUAK1抑制剂HTH-01-015(10μM)或shRNA处理MDA-MB-231、U87细胞,血清饥饿后EGF刺激(0-60min),通过confocal显微镜观察mTOR与溶酶体marker Lamp1的共定位,量化溶酶体的亚细胞分布(perinuclear vs 外周)。
结果解读:NUAK1抑制导致mTOR在溶酶体上的积累(共定位率增加~40%,n=3,P<0.05),且溶酶体向细胞外周移动(外周溶酶体比例从~30%升至~60%);NUAK1过表达则维持溶酶体的perinuclear定位。
产品关联:抑制剂HTH-01-015购自Sigma,Lamp1抗体来自Cell Signaling,confocal显微镜为Zeiss LSM780。
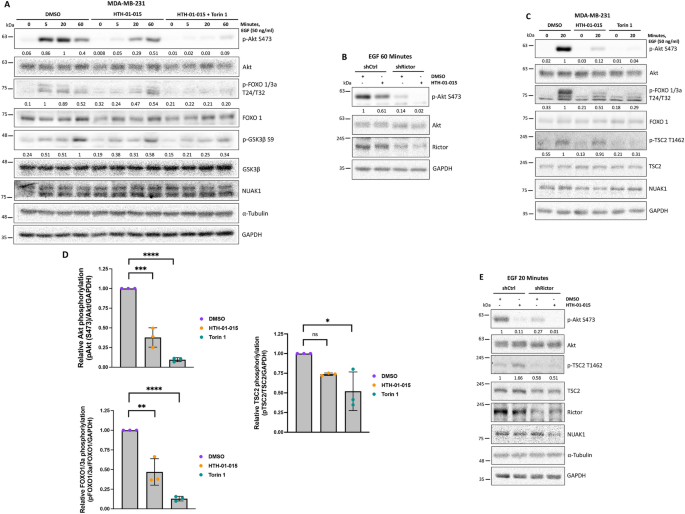
3.3 NUAK1对Akt激活及下游底物的影响
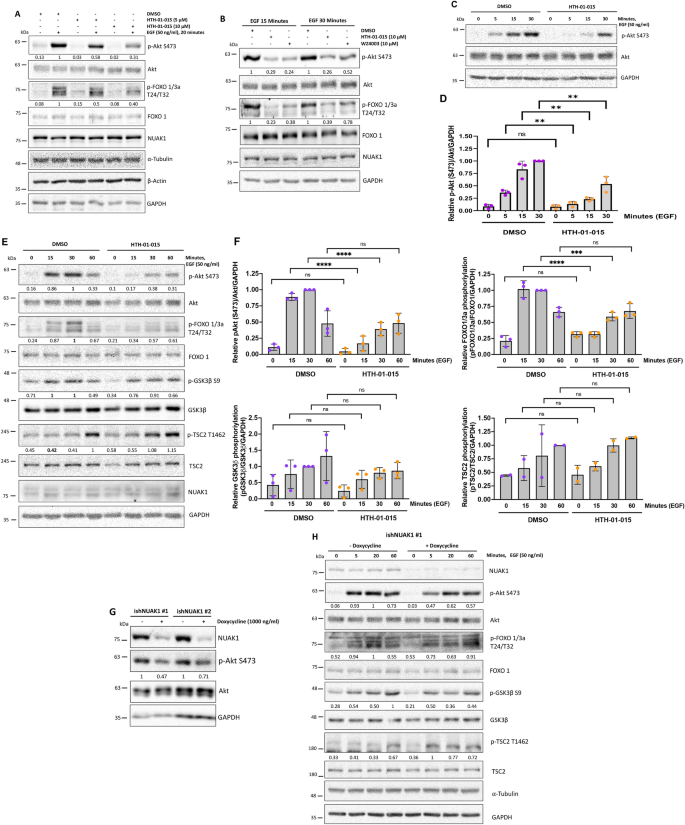
实验目的:验证NUAK1对生长因子依赖的Akt磷酸化及底物特异性的调控。
方法细节:用HTH-01-015(10μM)或WZ4003(10μM,NUAK1/2抑制剂)处理MDA-MB-231细胞,血清饥饿后EGF刺激不同时间点(0、5、15、30、60min),通过Western blot检测Akt Ser473磷酸化及下游底物(FOXO1/3a Thr24/32、TSC2 Thr1462、GSK3β Ser9)的磷酸化;用诱导型shRNA沉默NUAK1,验证上述结果。
结果解读:NUAK1抑制显著降低Akt的早期激活(5-30min,Ser473磷酸化降低~50%,n=3,P<0.01),且选择性减少FOXO1/3a的磷酸化(降低~60%),但不影响TSC2的磷酸化;shRNA沉默NUAK1得到一致结果。
产品关联:抑制剂WZ4003购自MedChemExpress,Akt及底物抗体均来自Cell Signaling。
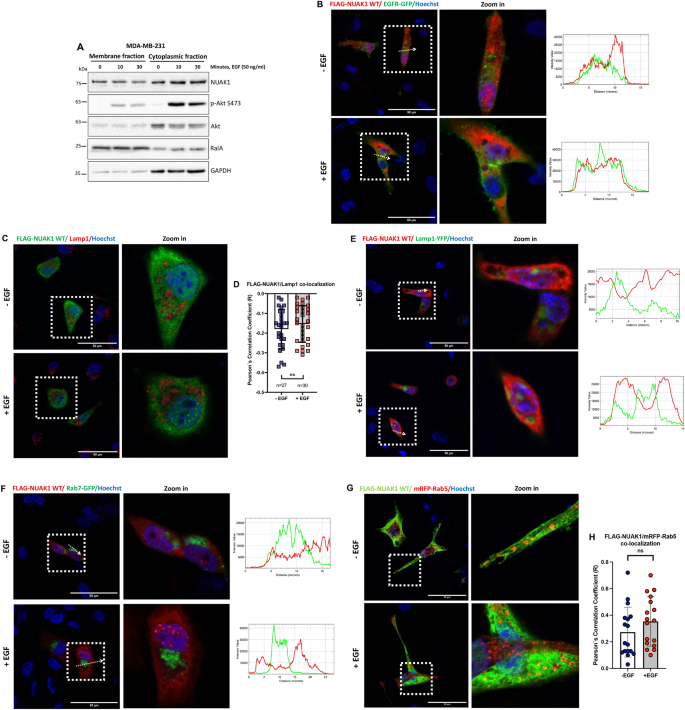
3.4 NUAK1的亚细胞定位分析
实验目的:确定NUAK1的亚细胞定位,解释其对Akt底物的特异性调控。
方法细节:通过细胞分馏实验分离膜组分与胞质组分,检测NUAK1的分布;用confocal显微镜观察NUAK1与质膜marker(EGFR-GFP)、溶酶体marker(Lamp1-YFP)、早期内体marker(mRFP-Rab5)、晚期内体marker(Rab7-GFP)的共定位。
结果解读:NUAK1存在于膜组分(与RalA共定位),独立于EGF刺激;confocal结果显示NUAK1不与EGFR、Lamp1、Rab7共定位,但与Rab5(早期内体)显著共定位(共定位率~40%,n=3)。
产品关联:实验所用质粒(EGFR-GFP、mRFP-Rab5)购自Addgene,细胞分馏试剂为ThermoFisher的Subcellular Fractionation Kit。
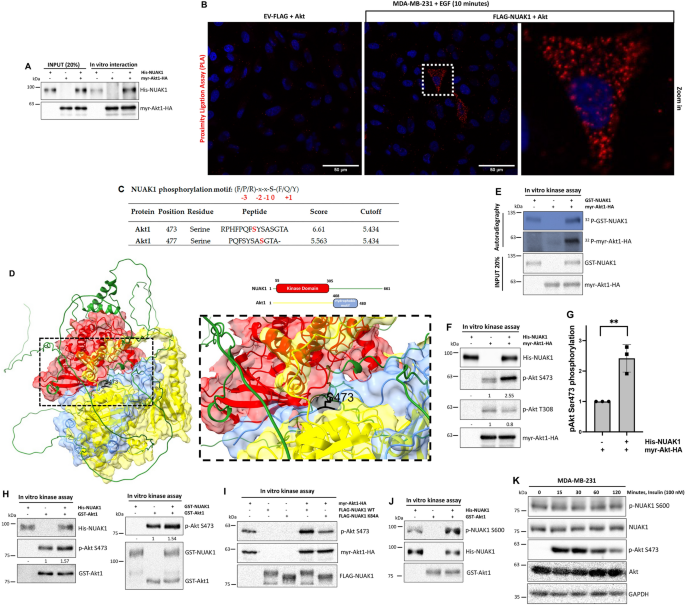
3.5 NUAK1直接磷酸化Akt的验证
实验目的:验证NUAK1是否直接磷酸化Akt的Ser473位点。
方法细节:通过分子对接预测NUAK1与Akt的相互作用;进行体外激酶实验,用重组NUAK1(His-NUAK1、GST-NUAK1)与纯化的myr-Akt1-HA反应,检测Ser473磷酸化;用激酶死突变体(NUAK1 K84A)验证激酶活性的必要性;通过PLA检测细胞内NUAK1与Akt的相互作用。
结果解读:分子对接显示NUAK1激酶域直接结合Akt的疏水motif(包含Ser473);体外激酶实验表明,野生型NUAK1可显著增加Akt Ser473磷酸化(增加~2倍,n=3,P<0.01),而K84A突变体无此作用;PLA显示EGF刺激下NUAK1与Akt的相互作用增强(红色荧光点增加~3倍)。
产品关联:实验所用重组蛋白(His-NUAK1、GST-NUAK1)购自Sigma与ThermoFisher,激酶实验试剂为常规ATP、MgCl2。
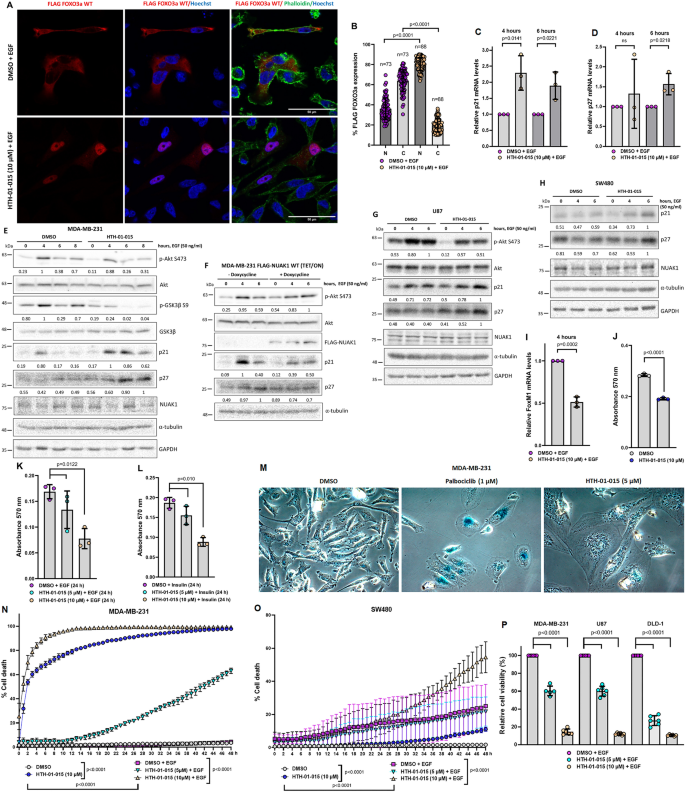
3.6 NUAK1/Akt/FOXO1/3a轴的功能研究
实验目的:研究NUAK1对细胞周期与存活的调控作用。
方法细节:用HTH-01-015处理MDA-MB-231、U87、SW480细胞,血清饥饿后EGF刺激(4-8h),通过qPCR检测p21CIP1、p27KIP1、FoxM1的mRNA表达,Western blot检测蛋白水平;用confocal显微镜观察FOXO3a的核定位;通过Crystal Violet染色、Incucyte细胞死亡检测及3D球状体实验,评估细胞存活。
结果解读:NUAK1抑制诱导FOXO3a核积累(核定位比例从~20%升至~60%,n=3,P<0.01),显著增加p21(mRNA增加~2倍,蛋白增加~3倍)、p27(mRNA增加~1.5倍,蛋白增加~2倍)的表达,减少FoxM1的表达(mRNA降低~50%);同时,NUAK1抑制显著降低细胞存活(2D培养降低~40%,3D球状体降低~50%,n=3,P<0.01)。
产品关联:实验所用qPCR引物为自定义设计,Incucyte试剂为ThermoFisher的SYTOX,3D球状体试剂盒为Promega的CellTiter-Glo 3D。
3.7 NUAK1与Akt/mTOR抑制剂的联合效应
实验目的:探索联合抑制NUAK1与Akt/mTOR的抗癌效果。
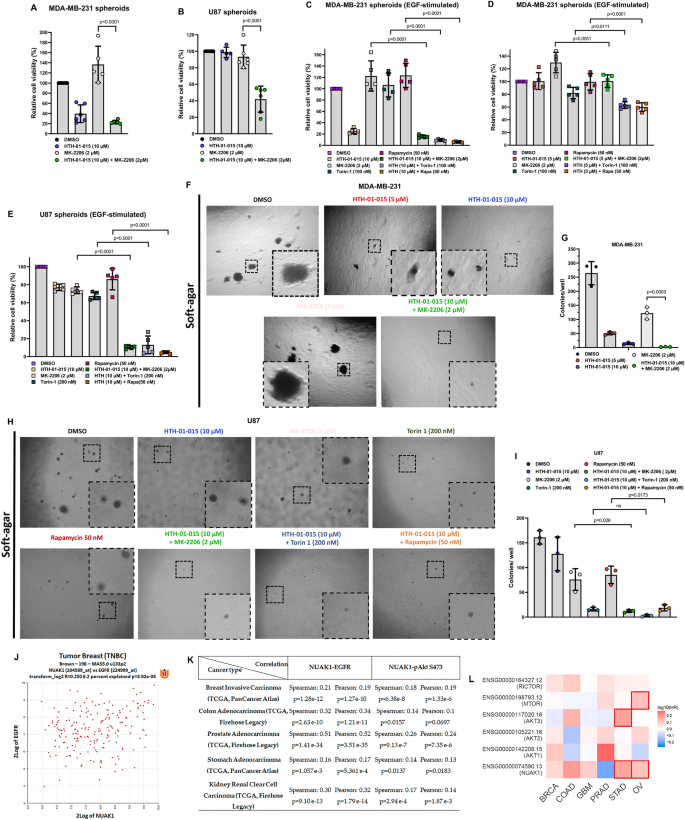
方法细节:用HTH-01-015(5/10μM)分别与MK-2206(Akt抑制剂)、Torin1(mTORC1/2抑制剂)、Rapamycin(mTORC1抑制剂)联合处理MDA-MB-231、U87细胞,通过3D球状体实验检测细胞存活,软琼脂实验检测集落形成。
结果解读:联合用药显著增强细胞死亡(如HTH-01-015+MK-2206使3D球状体存活降低~70%,n=5,P<0.0001),并减少软琼脂集落形成(MDA-MB-231集落数减少~60%,U87减少~50%,n=3,P<0.01)。
产品关联:抑制剂MK-2206购自Cayman Chemical,Torin1为Gift(Nathanael S. Gray与David M. Sabatini),Rapamycin购自Sigma。
3.8 临床相关性分析
实验目的:验证NUAK1与EGFR/Akt信号的临床相关性及预后价值。
方法细节:通过R2 Genomics平台分析TNBC样本(n=198)中NUAK1与EGFR的表达相关性;通过c-Bioportal分析乳腺癌(n=874)、结直肠癌(n=636)等多种癌症中NUAK1与EGFR、Akt Ser473磷酸化的相关性;通过Gepia2分析NUAK1与Akt/mTOR组分的Hazard Ratio(HR)。
结果解读:NUAK1表达与EGFR正相关(TNBC中r=0.3,P<0.001),与Akt Ser473磷酸化正相关(乳腺癌中r=0.25,P<0.001);高NUAK1表达与多种癌症的不良预后相关(如乳腺癌HR=1.3,95% CI 1.1-1.5,P<0.05;GBM HR=1.5,95% CI 1.2-1.8,P<0.01)。
产品关联:实验所用数据库为公共资源(R2、c-Bioportal、Gepia2)。
4. Biomarker研究及发现成果解析
Biomarker定位:本研究涉及的Biomarker为“NUAK1表达水平及与EGFR/Akt Ser473磷酸化的相关性”,属于“信号调控型Biomarker”,用于预测Akt信号的激活状态及癌症预后。其筛选/验证逻辑为“细胞实验发现NUAK1与Akt的调控关系→临床数据库验证NUAK1与EGFR/Akt的相关性→生存分析验证预后价值”。
研究过程详述:Biomarker来源为TCGA及公共数据库中的临床肿瘤样本(如TNBC、乳腺癌、结直肠癌);验证方法为生物信息学分析(相关性分析、生存分析);特异性与敏感性数据显示,TNBC中NUAK1与EGFR的相关性系数r=0.3(n=198,P<0.001),乳腺癌中NUAK1与Akt Ser473磷酸化的相关性系数r=0.25(n=874,P<0.001)。
核心成果提炼:该Biomarker的功能关联为“NUAK1高表达与EGFR/Akt信号激活正相关”,可作为Akt信号过度激活的潜在标志;创新性在于“首次在临床样本中验证NUAK1与EGFR/Akt信号的相关性”;统计学结果显示,高NUAK1表达与多种癌症的不良预后相关(如乳腺癌HR=1.3,95% CI 1.1-1.5,P<0.05;GBM HR=1.5,95% CI 1.2-1.8,P<0.01)。这一成果为NUAK1作为癌症预后Biomarker及治疗靶点提供了临床依据。
