1. 领域背景与文献引入
文献英文标题:Reliable assessment of telomere maintenance mechanisms in neuroblastoma;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:儿童神经母细胞瘤分子生物学与端粒维持机制。
神经母细胞瘤是儿童最常见的颅外实体恶性肿瘤,起源于发育中的交感神经系统,临床进程呈现极强异质性——低危患儿常出现自发消退,而高危患儿尽管接受多模态强化治疗,仍有约50%死于疾病进展。当前临床风险分层主要基于年龄、INSS分期等临床变量,以及MYCN基因扩增等分子标记,但仍存在部分患者被错误分层的情况。端粒维持机制(TMM)是高危神经母细胞瘤的核心分子标志,主要通过两种途径实现:端粒酶激活(通过MYCN扩增、TERT基因重排等驱动)和替代性端粒延长(ALT)(通过同源重组介导端粒延长)。然而,TMM检测尚未纳入临床常规,尤其是ALT的评估缺乏统一共识——现有方法(如ALT相关PML核体(APB)检测、C-circle试验)的敏感性和特异性未系统验证,且当结果冲突时缺乏有效补充参数。
本文针对“神经母细胞瘤TMM(尤其是ALT)缺乏可靠评估流程”的研究空白,通过大样本队列整合多类分子指标,开发了“分步评估+多参数验证”的TMM诊断流程,为临床常规应用提供了可操作的框架。
2. 文献综述解析
本文综述围绕“神经母细胞瘤TMM评估的现状与挑战”展开,按端粒酶激活与ALT两类机制分类评述现有研究:
现有研究总结
- 端粒酶激活评估:现有方法已明确可通过检测MYCN基因扩增、TERT基因重排(两种常见基因组改变)或TERT mRNA高表达、端粒酶活性实现,这些指标具有较高特异性,但需标准化阈值(如TERT表达的临界值)。
- ALT评估挑战:现有研究主要采用APB检测(观察端粒与PML蛋白的共定位)和C-circle试验(检测端粒来源的环状DNA),但两种方法的结果一致性未系统验证,且部分研究显示结果冲突;此外,当常规方法无法明确TMM状态时,缺乏端粒长度、TERRA(端粒相关长链非编码RNA)等补充参数辅助判断。
创新价值论证
本文的核心创新在于系统整合多类TMM指标(基因组改变、基因表达、细胞形态学、分子表型),通过68例大样本队列验证了各指标的关联性,并提出“分步评估+多参数整合”的诊断流程——解决了ALT评估的不确定性问题,为临床常规应用提供了可操作的框架。
3. 研究思路总结与详细解析
本文研究目标是建立神经母细胞瘤TMM的可靠评估流程,核心科学问题是“如何整合多参数准确分类TMM状态(端粒酶激活、ALT、TMM阴性)”,技术路线遵循“样本队列构建→常规TMM指标检测→多参数整合分类→模糊病例补充验证→ workflow提出”的闭环逻辑。
3.1 样本队列与基础分子数据获取
实验目的:构建标准化神经母细胞瘤样本队列,获取基础分子特征数据。
方法细节:回顾性分析68例原发性神经母细胞瘤样本(来自GPOH临床研究),所有样本均具有全基因组测序(WGS)数据,部分样本补充RNA测序(n=64)、荧光原位杂交(FISH,检测MYCN扩增与TERT重排,n=68)、端粒酶重复扩增实验(TRAP,检测端粒酶活性,n=15)等数据。
结果解读:样本覆盖神经母细胞瘤全疾病谱(INSS分期1-4S均有分布),获取了所有样本的MYCN扩增状态、TERT重排情况、TERT mRNA表达水平等基础分子数据,为后续TMM分类提供核心依据。
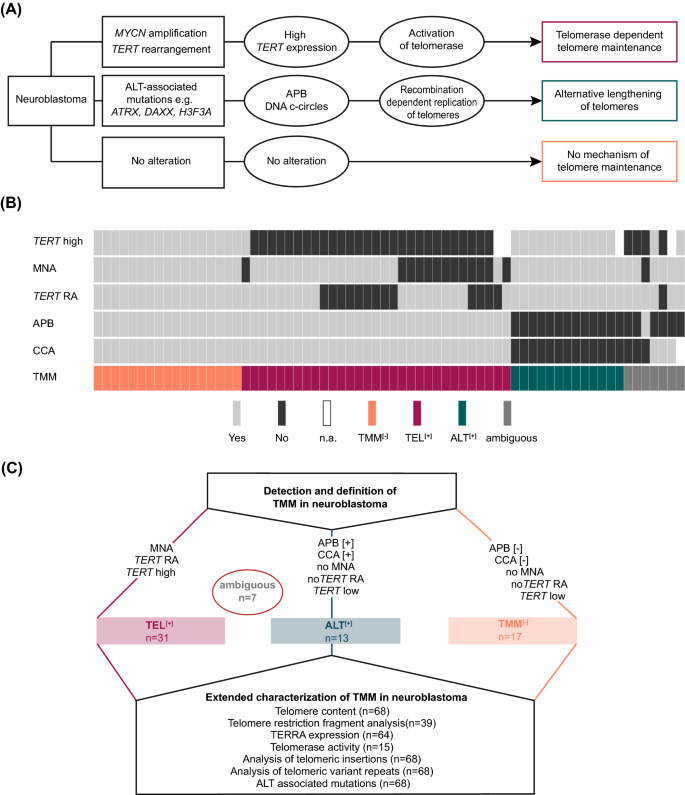
3.2 端粒酶激活状态评估
实验目的:定义端粒酶阳性(TEL⁺)神经母细胞瘤的标准。
方法细节:通过FISH检测MYCN扩增或TERT重排;通过RNA测序数据计算TERT mRNA表达水平,基于大样本队列(n=64)定义TERT高表达阈值(log₂表达值≥7.58,对应“具有TERT/MYCN改变的肿瘤”的后验概率≥95%);通过TRAP实验验证端粒酶活性。
结果解读:31例样本被归类为TEL⁺(45.6%),其中14例存在MYCN扩增、14例存在TERT重排(3例同时存在两种改变),或TERT表达高于阈值;TEL⁺样本的端粒酶活性显著高于非TEL⁺样本(相对活性中位数720 vs. 164,n=15,P=0.002)。
3.3 ALT激活状态评估
实验目的:优化ALT阳性(ALT⁺)神经母细胞瘤的检测方法与标准。
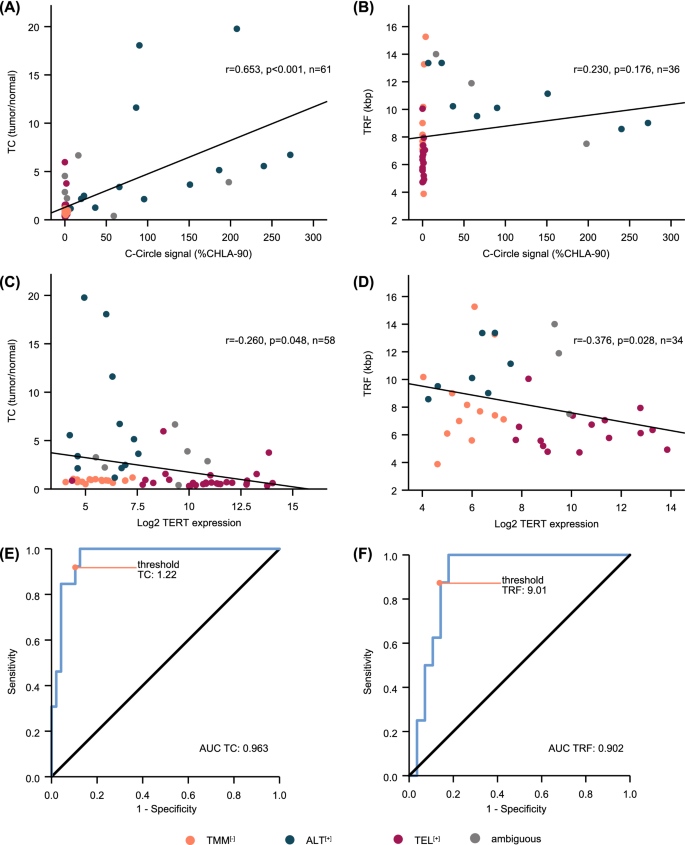
方法细节:通过“免疫荧光+原位杂交”结合检测APB(观察端粒与PML蛋白的共定位,n=68);通过C-circle试验检测端粒来源的环状DNA,比较两种阈值(th₁:C-circle信号≥ALT阳性细胞系CHLA-90的5%;th₂:≥20%且≥无聚合酶对照组的4倍)的准确性,最终选择th₁(与APB结果一致性更高,94.0%)。
结果解读:13例样本被归类为ALT⁺(19.1%),均满足APB阳性且C-circle试验th₁阳性;ALT⁺样本的C-circle信号强度与端粒含量显著正相关(Pearson相关系数,P<0.001)。
3.4 TMM状态分类与多参数验证
实验目的:基于常规指标分类TMM状态,并通过多参数验证分类准确性。
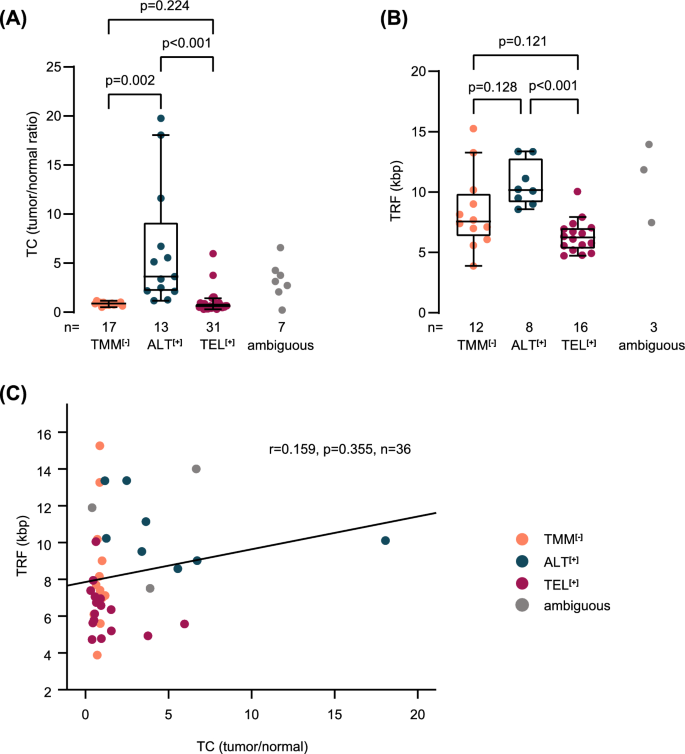
方法细节:将样本分为三类:① TEL⁺(存在端粒酶激活指标,无ALT指标);② ALT⁺(存在ALT指标,无端粒酶激活指标);③ TMM⁻(无上述所有指标)。进一步分析各亚组的额外参数:端粒含量(WGS计算,n=68)、端粒限制片段(TRF,Southern blot,n=39)、TERRA表达(RNA-seq,n=64)、端粒变异重复序列(TVR)、端粒插入(WGS分析,n=68)、ATRX突变(WGS,n=68)。
结果解读:89.7%的样本(61/68)被明确分类(TEL⁺31例、ALT⁺13例、TMM⁻17例);ALT⁺样本具有长端粒(端粒含量中位数6.39 vs. TEL⁺0.96、TMM⁻0.87,n=61,P<0.001)、高TERRA表达(中位数0.011 vs. TEL⁺0.002、TMM⁻0.004,n=58,P<0.001)、更多端粒插入(77% vs. TEL⁺32%、TMM⁻6%,n=68,P<0.001)等特征;端粒含量与TRF的ROC曲线AUC均≥0.9,显示其对ALT的高判别能力。
3.5 模糊病例的TMM状态补充验证
实验目的:解决常规指标无法明确分类的7例模糊病例(4例APB与C-circle结果冲突、1例仅APB数据、2例同时存在端粒酶激活与ALT指标)。
方法细节:整合所有可用参数(基因组改变、TERT表达、端粒酶活性、端粒长度、TERRA、TVR、端粒插入、ATRX突变)进行判断。
结果解读:2例被归类为TEL⁺(如NB05存在MYCN扩增与高TERT表达,尽管C-circle阳性,但端粒含量与TERRA低,无ALT相关TVR改变);5例被归类为ALT⁺(如NB43存在APB阳性、高TERRA、长端粒、端粒插入,无端粒酶激活指标)。
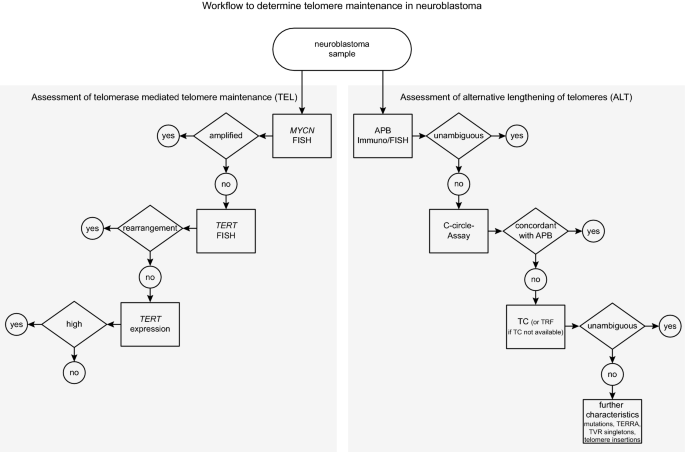
3.6 TMM评估workflow提出
实验目的:基于上述结果提出临床可行的TMM评估流程。
方法细节:总结各指标的优先级与关联性,提出“先评估端粒酶激活→再评估ALT→最后补充验证”的分步流程:① 先通过FISH检测MYCN扩增/TERT重排,或RNA-seq检测TERT高表达(判断TEL⁺);② 对无端粒酶激活的样本,通过APB检测结合C-circle试验(th₁)判断ALT⁺;③ 对模糊病例,补充端粒长度、TERRA、TVR等参数验证。
结果解读:该流程可覆盖95%以上样本的TMM分类,为临床风险分层提供了分子依据。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker分为端粒酶激活相关与ALT相关两类,筛选逻辑遵循“常规临床指标→实验验证指标→补充分子表型指标”的逐层递进,验证通过“大样本关联分析→ROC曲线判别能力评估→模糊病例验证”实现。
Biomarker定位与筛选逻辑
- 端粒酶激活相关Biomarker:包括MYCN基因扩增(FISH检测)、TERT基因重排(FISH检测)、TERT mRNA高表达(RNA-seq检测,阈值log₂≥7.58)。筛选逻辑为“临床常规FISH检测→基因表达验证”。
- ALT相关Biomarker:涵盖细胞形态学(APB阳性,免疫荧光+原位杂交)、分子表型(C-circle阳性、长端粒、TERRA高表达)、基因组特征(TVR singleton depletion、端粒插入、ATRX突变)。筛选逻辑为“实验形态学检测→分子表型验证→基因组特征补充”。
研究过程详述
- Biomarker来源:68例原发性神经母细胞瘤样本的WGS、RNA-seq、FISH、免疫荧光、C-circle试验等数据。
- 验证方法:① 端粒酶激活Biomarker:通过FISH验证MYCN/TERT基因组改变,RNA-seq验证TERT表达阈值,TRAP验证端粒酶活性;② ALT相关Biomarker:通过免疫荧光验证APB,C-circle试验验证环状DNA,WGS验证端粒长度与TVR,RNA-seq验证TERRA表达。
- 特异性与敏感性:端粒含量(TC)判别ALT的AUC=0.9(敏感性92.3%,特异性89.6%,n=61);端粒限制片段(TRF)判别ALT的AUC≥0.9(敏感性87.5%,特异性85.7%,n=36);TERRA表达判别ALT的AUC=0.826(n=58)。
核心成果提炼
- TMM分类标准:明确神经母细胞瘤的三类TMM状态——TEL⁺(MYCN/TERT改变或TERT高表达)、ALT⁺(APB+CCA+且无端粒酶激活)、TMM⁻(无上述指标)。
- ALT核心Biomarker组合:ALT⁺样本需同时满足:APB阳性、C-circle试验th₁阳性、长端粒(TC>1.22或TRF>9.01kb)、高TERRA表达、TVR singleton(TTTGGG/TGAGGG)depletion、端粒插入、ATRX突变(75%的ALT⁺样本存在)。
- 临床应用价值:本文提出的TMM评估流程可直接用于临床风险分层——TEL⁺与ALT⁺均为高危标志,需针对性选择端粒酶抑制剂(如Imetelstat)或ALT靶向治疗(如PARP抑制剂);TMM⁻样本通常为低危,可减少过度治疗。
结论
本文首次在神经母细胞瘤中系统整合了端粒酶激活与ALT评估的多类Biomarker,建立了“分步评估+多参数验证”的可靠流程,解决了现有研究中ALT评估的不确定性问题,为临床风险分层和个性化治疗提供了关键分子依据。
