1. 领域背景与文献引入
文献英文标题:Prognostic and predictive biomarkers for response to neoadjuvant chemoradiation in esophageal adenocarcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:食管腺癌(EAC)新辅助治疗生物标志物研究。
食管腺癌是全球第7大常见癌症、第6大癌症相关死亡原因,局部晚期患者的标准治疗为新辅助放化疗(CRT)联合手术(CROSS方案:卡铂+紫杉醇+放疗),可显著提高病理完全缓解(pCR)率和生存。但当前风险分层高度依赖临床病理特征(如TNM分期、pCR),存在明显局限性——约30%患者对CRT无反应,却承受了治疗毒性;部分pCR患者仍会复发,而传统指标无法提前识别。领域共识:亟需可靠的生物标志物优化风险分层,实现个性化治疗。本研究针对这一需求,通过靶向测序分析治疗前后样本的基因变异,旨在鉴定预测CRT反应和预后的基因特征,填补食管腺癌新辅助治疗生物标志物的空白。
2. 文献综述解析
文献综述的核心评述逻辑围绕“临床需求-现有不足-研究 gap”展开:作者首先总结食管腺癌的致死性与新辅助CRT的标准地位,强调pCR是当前最有效的预后指标,但仅29%患者能达到pCR,且依赖术后病理评估无法指导术前决策;接着评述现有研究的局限性——肿瘤突变负荷(TMB)虽在免疫治疗中显示价值,但在CRT中的预测作用存在争议;ERBB2(Her-2/neu)等基因在乳腺癌、胃癌中的研究较多,但在食管腺癌新辅助CRT中的作用尚未明确;最后指出,缺乏针对食管腺癌CROSS方案的预测性与预后性基因标志物是关键未解决问题。本研究的创新点在于:首次通过配对治疗前后样本的靶向测序,同时构建“预测CRT反应”和“预后生存”的双基因 signature,为个性化治疗提供更精准的工具。
3. 研究思路总结与详细解析
本研究的整体框架为:“患者队列建立-样本测序-差异基因筛选- signature 构建-验证”闭环。研究目标是鉴定食管腺癌患者对CROSS方案的预测生物标志物及预后生物标志物;核心科学问题是“哪些基因变异与CRT反应、生存结局相关”;技术路线以“临床样本-分子测序-生物信息分析-临床验证”为核心逻辑。
3.1 患者队列与样本收集
实验目的是建立符合条件的局部晚期食管腺癌患者队列,获取治疗前后配对样本用于基因分析。方法细节:纳入34例局部晚期食管腺癌患者(2013-2018年就诊),其中21例接受CROSS方案;收集治疗前基线样本(活检FFPE组织)和治疗后样本(手术切除FFPE组织),经病理确认肿瘤细胞含量≥20%。结果解读:患者中位年龄64岁(97%为男性),T3期占73.5%,淋巴结阳性(N+)占73.5%;中位总生存(OS)为45.3个月(95% CI 26-52.1),57% N+患者术后淋巴结转阴。
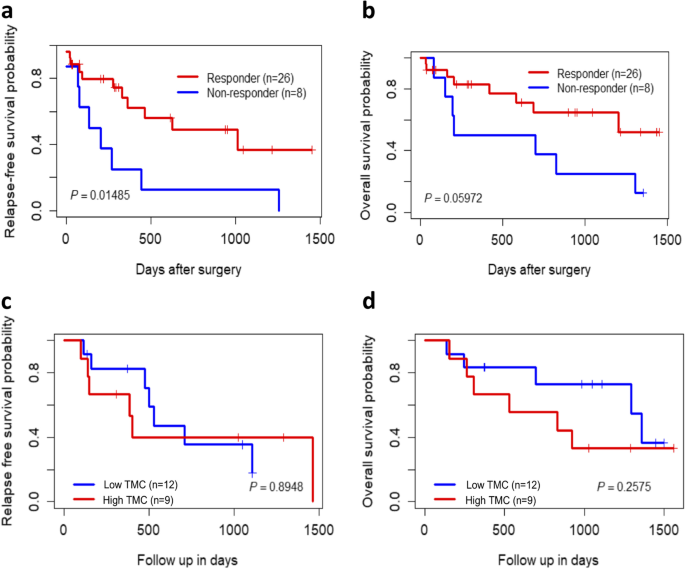
(图1显示, responders 较 non-responders 有更长的无复发生存(RFS)和OS,但TMB与生存无显著关联)。实验所用关键产品:Qiagen QIAamp DNA FFPE Tissue Kit(提取DNA)。
3.2 靶向测序与基因变异分析
实验目的是检测治疗前后样本的基因变异,筛选差异突变基因。方法细节:用Covaris M220超声破碎DNA(250-300bp),Agilent SureSelect-XT试剂盒构建文库,杂交至640基因定制 panel(覆盖癌相关基因),Illumina HiSeq 2500测序(2×100bp);数据分析流程:bcl2fastq转FASTQ→BWA比对至hg19→Picard去重复→GATK变异检测→Annovar注释,保留变异等位基因频率(VAF)≥5%、深度≥50×的非同义突变(错义、移码等)。结果解读:Responders(对CROSS有反应)的治疗前样本高频突变基因为MKI67、SYNE1、PCLO等,治疗后突变数显著减少(p=5.89E-03);Non-responders 高频突变基因为NLRP1、ALK1、MAP3K1,治疗后突变数也减少(p=4.85E-03)。
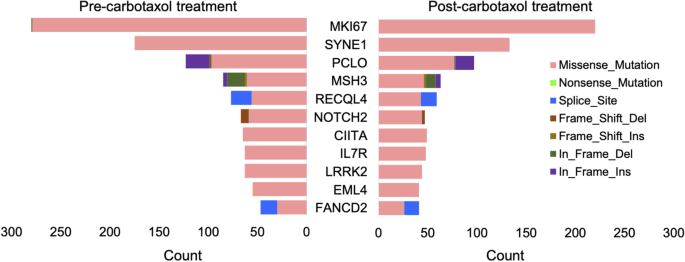
(图2展示了responders与non-responders治疗前后的高频突变基因分布)。实验所用关键产品:Agilent SureSelect-XT Target Enrichment Kit、Illumina HiSeq 2500测序仪。
3.3 预测性3基因 signature 构建
实验目的是筛选预测CROSS方案反应的基因标志物。方法细节:对21例CROSS方案患者(15例responders、6例non-responders),用Maftools的mafCompare函数分析治疗前样本的差异突变基因(Fisher精确检验,p<0.05);通过ROC曲线验证单基因及组合的预测效能。结果解读:差异突变基因EPHA5(p=7.00E-03)、BCL6(p=2.00E-02)、ERBB2(p=6.00E-02)可预测反应——EPHA5/BCL6突变提示耐药,ERBB2突变提示敏感;三者组合的ROC曲线下面积(AUC)达0.974(p<0.0001),敏感性84.6%、特异性100%,显著优于单基因。
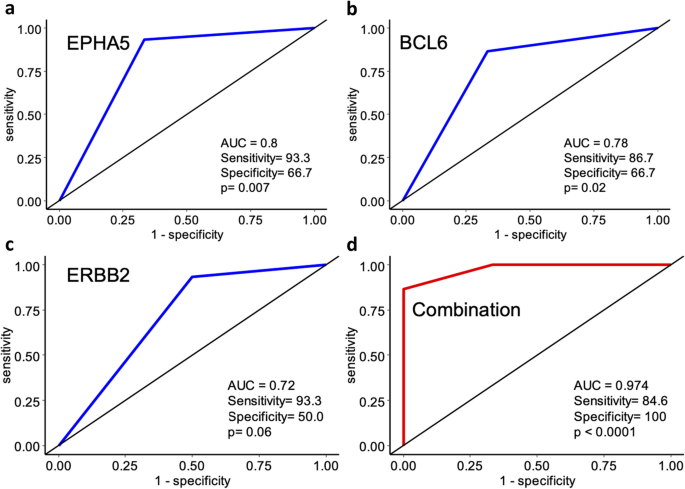
(图3展示了单基因与3基因组合的ROC曲线)。实验所用关键工具:R包Maftools(差异分析)、MedCalc(ROC分析)。
3.4 预后性9基因 signature 构建
实验目的是筛选与生存相关的预后基因标志物。方法细节:对34例患者,用单变量Cox比例风险回归分析基因变异状态(是否携带非同义突变)与总生存(OS)的关联(p<0.05);基于回归系数构建突变风险评分(Mutational Risk Score=ΣWj×mut.statusij,Wj为基因权重),用 median 风险评分将患者分为高、低风险组,Kaplan-Meier分析生存差异。结果解读:9个基因与OS显著相关——APC、MAP3K6、PML突变提示生存改善(负系数),ETS1、CSF3R、PDGFRB、GATA2、ARID1A、FGF6突变提示生存恶化(正系数);9基因 signature 可显著分层患者:低风险组中位OS未达到,高风险组仅12个月(p=3.325E-06),复发-free生存(RFS)也显著差异(p=4.73E-03);ROC曲线AUC=0.868(敏感性73.33%,特异性94.74%)。
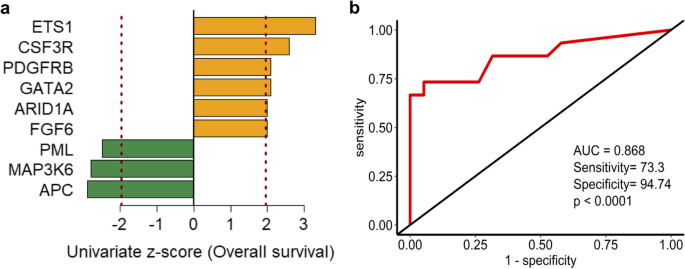
(图4展示了9基因的Cox回归系数);
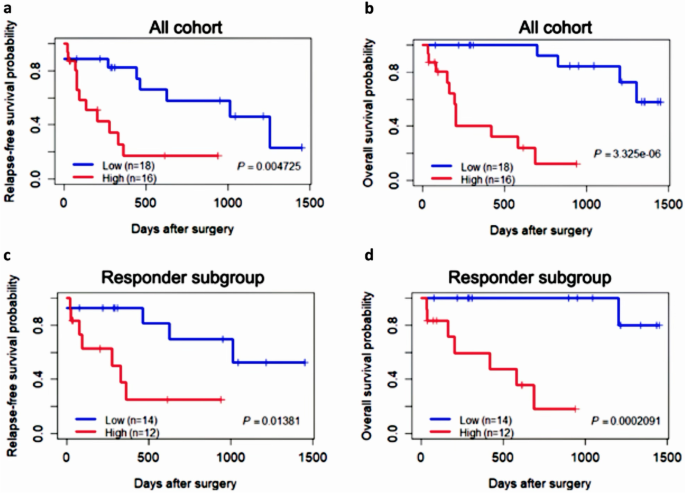
(图5展示了高、低风险组的生存曲线)。实验所用关键工具:R包survival(Cox回归)、Maftools(突变注释)。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
本研究鉴定了两类Biomarker:
1. 预测性Biomarker:3基因 signature(EPHA5、BCL6、ERBB2),筛选逻辑为“治疗前样本差异突变分析(responders vs non-responders)→ROC验证组合效能”;
2. 预后性Biomarker:9基因 signature(APC、MAP3K6、ETS1、CSF3R、PDGFRB、GATA2、ARID1A、PML、FGF6),筛选逻辑为“单变量Cox回归(基因变异与OS关联)→构建风险评分→生存验证”。
研究过程与核心成果
- 预测性Biomarker:来源为治疗前FFPE组织,验证方法为靶向测序+ROC分析;效能数据:3基因组合预测CROSS反应的敏感性84.6%、特异性100%(AUC=0.974,n=21,p<0.0001)。核心价值:首次在食管腺癌中发现EPHA5、BCL6突变与CRT耐药相关,ERBB2突变与敏感相关,解决了“无法术前预测CRT反应”的临床痛点。
- 预后性Biomarker:来源为治疗前FFPE组织,验证方法为Cox回归+Kaplan-Meier分析;效能数据:9基因 signature 分层OS的p=3.325E-06(n=34),RFS的p=4.73E-03,ROC-AUC=0.868(敏感性73.33%,特异性94.74%)。核心价值:首次整合9个基因的变异状态预测生存,优于传统临床病理指标,可提前识别高复发风险患者。
创新性与临床意义
本研究的创新点在于同时构建“预测反应”和“预后”的双基因 signature,且均基于治疗前样本(可术前检测),解决了当前生物标志物“预测与预后分离”“依赖术后样本”的问题。临床意义:3基因 signature 可指导术前决策(无反应患者避免CRT,直接手术或更换方案);9基因 signature 可指导术后管理(高风险患者加强随访或辅助治疗),为食管腺癌个性化治疗提供了可靠工具。
(注:文中图片均来自原文献,对应原figure 1-5;未提及的实验产品均为领域常规试剂,如PCR试剂盒、测序试剂等。)
