1. 领域背景与文献引入
文献英文标题:Vitamin D activates FBP1 to block the Warburg effect and modulate blast metabolism in acute myeloid leukemia;发表期刊:Biomarker Research;影响因子:未公开;研究领域:急性髓系白血病代谢调控。
急性髓系白血病(AML)是成人最常见的急性白血病类型,尽管诊疗技术不断进步,但其临床困境仍突出——约50%患者会在诱导化疗后复发,5年总体生存率仅29%,复发难治性AML是改善预后的关键障碍。近年来,代谢重编程被证实是AML细胞的核心特征之一,其中“Warburg效应”(即使在有氧条件下仍依赖糖酵解供能)尤为典型,不仅为AML细胞提供快速能量,还与化疗耐药、不良预后密切相关。果糖-1,6-二磷酸酶1(FBP1)作为糖异生途径的限速酶,可通过水解果糖-1,6-二磷酸逆向抑制糖酵解,在实体瘤中发挥肿瘤抑制作用,但FBP1在AML中的功能及调控机制尚未明确。此外,维生素D(1,25VD3)作为经典的抗白血病分子,已知其可诱导AML细胞分化、抑制增殖,但此前研究未关注其对代谢通路的调控作用。
作者团队前期研究已证实维生素D联合5-阿扎胞苷(去甲基化剂)可增强对AML细胞的细胞毒性,但维生素D是否通过调控代谢发挥抗白血病效应仍不清楚。基于此,本研究聚焦“维生素D-代谢-FBP1”轴,探索其对AML Warburg效应的阻断作用,为AML治疗提供新的代谢靶点。
2. 文献综述解析
本研究的文献综述围绕“AML临床困境→代谢重编程靶点→FBP1功能→维生素D作用”的逻辑展开,核心评述如下:
首先,AML的临床与代谢特征:AML患者预后差,复发难治的关键原因之一是细胞代谢重编程——Warburg效应导致糖酵解增强,乳酸生成增加,不仅为肿瘤细胞提供能量,还促进化疗耐药。已有研究证实,糖酵解水平越高的AML患者,临床结局越差。
其次,FBP1的抑癌潜力:FBP1是糖异生的关键限速酶,可将果糖-1,6-二磷酸转化为果糖-6-磷酸,直接抑制糖酵解的关键步骤。在肝癌、肺癌等实体瘤中,FBP1的低表达与肿瘤进展相关,但其在AML中的表达及功能未被系统研究。
再次,维生素D的抗白血病机制:维生素D通过结合维生素D受体(VDR)发挥作用,已知其可诱导AML细胞分化、阻滞细胞周期,但此前研究多聚焦于分化或增殖调控,未关联代谢通路。
现有研究的局限性在于:缺乏对“维生素D如何调控AML代谢”的机制探索,尤其未关注FBP1的介导作用。本研究的创新之处在于——首次将维生素D的抗白血病作用与代谢重编程结合,提出“维生素D激活FBP1阻断Warburg效应”的新机制,填补了维生素D调控AML代谢的研究空白。
3. 研究思路总结与详细解析
本研究的整体目标是揭示维生素D对AML细胞代谢的调控机制,核心科学问题是“维生素D是否通过激活FBP1抑制Warburg效应,减少AML细胞能量供应”。技术路线遵循“筛选靶基因→验证表达→解析功能→揭示通路”的闭环逻辑:通过RNA-seq锁定FBP1→多技术验证FBP1表达→乳酸实验验证Warburg效应→RNA-seq分析代谢通路。
3.1 RNA-seq筛选差异表达基因
实验目的:筛选80nM 1,25VD3处理后,AML细胞系中显著差异表达的代谢相关基因。
方法细节:选取4种AML细胞系(MV4-11、MOLM-14、MV4-11-米哚妥林耐药株、MOLM-14-米哚妥林耐药株),用80nM 1,25VD3处理后提取总RNA,通过RNA-seq测序定量基因表达(以FPKM值衡量)。
结果解读:1,25VD3处理后共检测到17757个差异基因,其中FBP1是唯一上调超过250倍的基因——未处理组FBP1的FPKM值为4.37(排名第8413位),处理组升至1110.13(排名第94位),且该结果在4种细胞系中一致。
实验所用关键产品:文献未提及具体实验产品,领域常规使用Illumina NovaSeq平台进行RNA-seq测序。
3.2 FBP1基因与蛋白表达验证
实验目的:验证1,25VD3对FBP1 mRNA及蛋白表达的上调作用。
方法细节:① qPCR验证mRNA:将MV4-11细胞用80nM 1,25VD3处理48小时,提取总RNA并反转录,以GAPDH为内参进行实时定量PCR;② 蛋白免疫印迹(WB)验证蛋白:提取处理后细胞的总蛋白,通过SDS-PAGE分离、转膜,用FBP1抗体孵育后ECL显色;③ 免疫细胞化学:将细胞爬片用1,25VD3处理后固定,用FBP1一抗及荧光二抗孵育,荧光显微镜观察;④ 流式细胞术:用FBP1和VDR抗体标记处理后细胞,检测两者的共表达情况。
结果解读:qPCR显示FBP1 mRNA显著上调(文献未明确具体倍数,基于RNA-seq结果推测>250倍);WB显示FBP1蛋白条带灰度值显著增加;免疫细胞化学显示处理后细胞内FBP1荧光信号增强;流式细胞术显示95.9%的FBP1阳性细胞同时表达VDR(Isotype对照无显著信号),提示FBP1的激活依赖维生素D-VDR通路。
实验所用关键产品:文献未提及具体实验产品,领域常规使用FBP1抗体(如Cell Signaling Technology #3682)、VDR抗体(如Abcam ab137037)进行WB及流式检测。
3.3 乳酸实验验证Warburg效应
实验目的:验证1,25VD3通过FBP1抑制AML细胞的Warburg效应(降低乳酸生成)。
方法细节:将MV4-11细胞用80nM 1,25VD3处理后,收集细胞上清液,采用酶法乳酸检测试剂盒定量乳酸浓度,每组设置5个复孔(n=5)。
结果解读:处理组乳酸浓度较未处理组显著降低(数据为均值±SEM,p<0.005),提示1,25VD3处理后AML细胞的糖酵解水平下降,Warburg效应被阻断。
实验所用关键产品:文献未提及具体实验产品,领域常规使用Sigma-Aldrich乳酸检测试剂盒(MAK064)。
3.4 代谢通路基因表达分析
实验目的:解析1,25VD3对AML细胞整体代谢通路的调控。
方法细节:对MV4-11及MV4-11-米哚妥林耐药株进行RNA-seq,分析糖酵解、糖异生、三羧酸循环(TCA)、氧化磷酸化等代谢通路的关键基因表达变化。
结果解读:1,25VD3处理后,糖异生、TCA循环、氧化磷酸化相关基因表达上调(如FBP1、PCK1、IDH1),糖酵解、糖原分解、核苷酸合成相关基因表达下调(如HK2、PFK1、PRPS1),提示维生素D通过调控多个代谢通路,协同抑制AML细胞的能量生成。
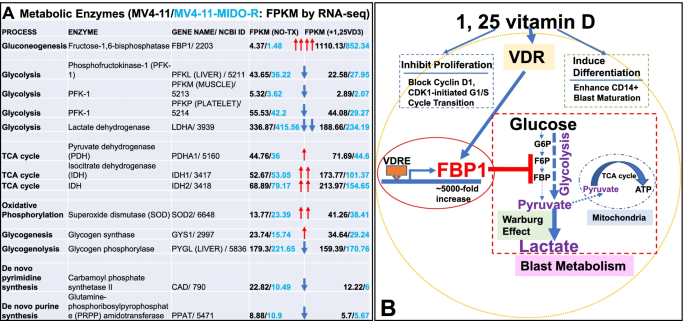
4. Biomarker研究及发现成果解析
本研究涉及的核心Biomarker为果糖-1,6-二磷酸酶1(FBP1),属于“代谢酶类Biomarker”,其筛选与验证遵循“高通量测序→细胞系验证→功能验证”的完整逻辑链:
Biomarker定位与筛选逻辑
FBP1的筛选源于RNA-seq对17757个差异基因的分析——是1,25VD3处理后唯一上调超过250倍的基因;验证逻辑则通过多技术交叉验证:qPCR(mRNA)、WB(蛋白)、免疫细胞化学(细胞内定位)、流式细胞术(通路关联)、乳酸实验(功能),确保结果的可靠性。
研究过程详述
- 来源:FBP1来自AML细胞系(MV4-11、MOLM-14及其耐药株)的细胞内蛋白;
- 验证方法:① qPCR检测mRNA表达(处理后显著上调);② WB检测蛋白表达(条带灰度增加);③ 免疫细胞化学检测细胞内定位(荧光信号增强);④ 流式细胞术检测与VDR的共表达(95.9%共阳性);⑤ 乳酸实验验证功能(降低乳酸生成);
- 特异性与敏感性:流式显示FBP1与VDR高度共表达(95.9%),提示其激活依赖维生素D-VDR通路;乳酸实验显示FBP1对Warburg效应的抑制具有高敏感性(p<0.005,n=5)。
核心成果提炼
- 功能关联:FBP1是维生素D调控AML代谢的关键下游靶基因,通过激活FBP1,维生素D可直接阻断Warburg效应,减少乳酸生成,抑制AML细胞的能量供应;
- 创新性:首次在AML中揭示FBP1的代谢调控作用,提出“维生素D-FBP1-代谢”的新通路,填补了维生素D抗白血病机制的空白;
- 临床意义:FBP1可作为预测维生素D治疗响应的潜在Biomarker——表达VDR的AML患者可能对维生素D更敏感,为精准治疗提供依据。
统计学结果:FBP1的FPKM值在处理后上调254倍(未处理组4.37 vs 处理组1110.13);乳酸浓度降低具有显著统计学差异(p<0.005,n=5);FBP1与VDR的共表达率为95.9%。
本研究首次将维生素D的抗白血病作用与代谢重编程结合,为AML的代谢靶向治疗提供了新的理论依据,FBP1有望成为维生素D治疗的响应预测Biomarker。
