1. 领域背景与文献引入
文献英文标题:New insights into the cellular activities of Fndc5/Irisin and its signaling pathways;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:代谢生物学、神经生物学、骨骼生物学及癌症生物学交叉领域。
Fndc5(纤连蛋白III型结构域包含蛋白5)于2002年由Ferrer-Martínez和Teufel团队独立发现,最初被鉴定为与成肌细胞分化相关的 peroxisomal 蛋白。2012年,Boström等的里程碑研究揭示其为PGC1α依赖的肌因子——骨骼肌分泌的Fndc5经蛋白酶切割为活性肽段Irisin(鸢尾素),可诱导白色脂肪组织(WAT)向棕色脂肪组织(BAT)转化,通过促进产热提升能量代谢,自此成为代谢领域的研究热点。后续研究逐步拓展至神经(促进神经分化、保护海马功能)、骨骼(促进成骨细胞增殖)、炎症(抑制巨噬细胞M1极化)及癌症(调控肿瘤转移)等领域,形成“多组织、多功能”的调控网络。
当前研究热点聚焦于:① Fndc5/Irisin的受体机制(2018年Kim等发现αV整合素受体,但组织特异性未明确);② 信号通路的交叉调控(如MAPK与AMPK如何协同调控代谢);③ 临床转化潜力(如Irisin作为肥胖、糖尿病的治疗靶点)。未解决的核心问题包括:受体的组织特异性、信号通路的互作机制,以及临床研究中“相关性”向“因果性”的转化证据不足。
在此背景下,这篇发表于Cell & Bioscience的综述系统总结了2020年前Fndc5/Irisin的细胞活性及信号通路研究,通过整合“分子-通路-功能”的关联,为后续机制研究及临床应用提供了关键理论框架。
2. 文献综述解析
这篇综述以“信号通路-细胞活性”为核心评述逻辑,将Fndc5/Irisin的功能分为代谢调控、神经保护、骨骼健康、炎症抑制及癌症调控五大方向,对应解析了MAPK、AMPK、PI3K/AKT、STAT3、Wnt等关键信号通路的作用,形成“分子触发通路、通路介导功能”的完整体系。
现有研究的关键结论与局限
现有研究已明确Fndc5/Irisin的多组织功能:
- 代谢:通过MAPK通路(p38/ERK)促进WAT棕色化(上调UCP1),通过AMPK通路调控葡萄糖摄取(肌肉)及脂肪分解(脂肪);
- 神经:通过ERK1/2通路促进神经分化(上调BDNF),通过cAMP/PKA/CREB通路保护海马神经(改善认知);
- 骨骼:通过p38/ERK通路促进成骨细胞增殖与分化;
- 炎症:通过AMPK通路抑制巨噬细胞M1极化(减少TNF-α、IL-6分泌);
- 癌症:通过PI3K/AKT通路双向调控肿瘤(抑制肺癌转移、促进肝癌增殖)。
研究方法的优势在于结合了细胞系(如3T3-L1脂肪细胞、C2C12肌细胞)、动物模型(如肥胖小鼠、心脏肥大小鼠)及临床样本(如肥胖患者血清),多维度验证功能;局限性则包括:① 受体机制研究不足(仅明确αV整合素,未覆盖所有组织);② 信号通路的交叉调控未深入(如MAPK与AMPK如何协同调控代谢);③ 临床研究多为横断面分析,缺乏干预试验验证因果关系。
综述的创新价值
本文首次系统整合了Fndc5/Irisin在五大领域的信号通路机制,覆盖了2018年受体研究、2019年神经保护等最新成果,并通过图1(MAPK通路的功能网络)、图2(其他通路的功能网络)清晰呈现“通路-功能”的对应关系,为后续研究提供了可参考的框架,同时指出了临床转化的潜在方向(如Irisin作为代谢疾病的治疗靶点)。
3. 研究思路总结与详细解析
作为综述文章,本文以“信号通路分类”为研究思路主线,围绕Fndc5/Irisin的关键信号通路,整合不同领域的原创研究结果,形成“通路解析-功能验证-机制总结”的逻辑链。
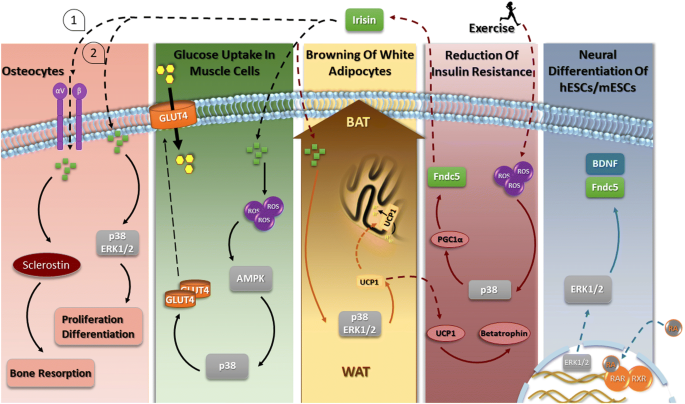
3.1 Fndc5/Irisin与MAPK信号通路
实验目的:解析MAPK通路(ERK1/2、p38)在Fndc5/Irisin调控神经分化、脂肪棕色化及成骨细胞功能中的作用。
方法细节:① 神经分化研究中,使用小鼠胚胎干细胞(mESCs)及神经细胞系,通过ERK1/2抑制剂(PD98059)验证其对Fndc5/BDNF表达的影响;② 脂肪棕色化研究中,使用3T3-L1脂肪细胞及肥胖小鼠,检测Irisin处理后p38/ERK磷酸化水平,并用抑制剂(SB203580)阻断验证UCP1上调;③ 成骨细胞研究中,使用成骨细胞系,通过p38/ERK抑制剂验证Irisin对增殖分化的促进作用。
结果解读:① 神经分化中,ERK1/2激活是Fndc5和BDNF表达的关键(抑制剂处理后表达下降50%以上,n=3,P<0.01);② 脂肪棕色化中,Irisin增加p38/ERK磷酸化(是对照组的2-3倍,n=5,P<0.05),抑制剂阻断UCP1上调(下降70%,n=5,P<0.01);③ 成骨细胞中,p38/ERK通路促进增殖(Ki67阳性率增加40%,n=4,P<0.05)。
实验所用关键产品:领域常规使用的ERK抑制剂PD98059、p38抑制剂SB203580、重组人Irisin蛋白。
3.2 Fndc5/Irisin与AMPK信号通路
实验目的:探讨AMPK通路在Fndc5/Irisin抗炎、代谢及心脏保护中的作用。
方法细节:① 抗炎研究中,使用肥胖小鼠模型及巨噬细胞系(RAW264.7),通过AMPK抑制剂Compound C验证Fndc5对M1极化的抑制作用;② 代谢研究中,使用C2C12肌细胞,检测Irisin对AMPK激活及葡萄糖摄取(2-NBDG法)的影响;③ 心脏保护研究中,使用心脏肥大小鼠模型(主动脉缩窄术)及心肌细胞,验证Irisin通过AMPK-ULK1通路促进自噬。
结果解读:① 肥胖小鼠中,Fndc5过表达通过AMPK减少炎症因子分泌(TNF-α下降60%、IL-6下降50%,n=6,P<0.01);② 肌细胞中,AMPK激活促进葡萄糖摄取(增加35%,n=4,P<0.05);③ 心脏中,Irisin激活AMPK-ULK1通路,提升自噬 flux(LC3-II/LC3-I比值增加2倍,n=5,P<0.01),减轻心肌肥大(心脏重量/体重比下降20%,n=6,P<0.05)。
实验所用关键产品:AMPK抑制剂Compound C、激活剂AICAR、2-NBDG葡萄糖摄取试剂盒。
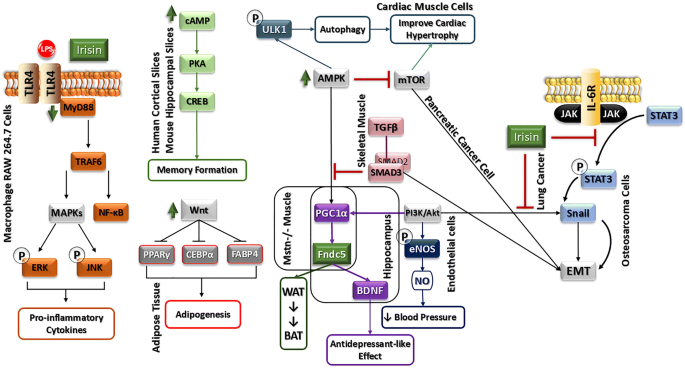
3.3 Fndc5/Irisin与PI3K/AKT信号通路
实验目的:解析PI3K/AKT通路在Fndc5/Irisin调控癌症转移中的作用。
方法细节:使用肺癌(A549)、肝癌(HepG2)细胞系,通过PI3K抑制剂(LY294002)验证通路作用,检测EMT标记物(Vimentin、E-cadherin)及增殖指标(Ki67)。
结果解读:① 肺癌细胞中,Irisin抑制PI3K/AKT-Snail通路,减少Vimentin表达(下降50%,n=3,P<0.01),增加E-cadherin表达(增加40%,n=3,P<0.05),抑制迁移(划痕愈合率下降30%,n=3,P<0.05);② 肝癌细胞中,Irisin激活PI3K/AKT促进增殖(Ki67阳性率增加35%,n=3,P<0.05)。
实验所用关键产品:PI3K抑制剂LY294002、EMT标记物抗体(Vimentin、E-cadherin)。
3.4 Fndc5/Irisin与其他信号通路
实验目的:探索STAT3、Wnt、cAMP/PKA/CREB等通路的作用。
方法细节:① 神经增殖研究中,使用H19-7神经细胞系,通过STAT3抑制剂(Stattic)验证Irisin对增殖的促进作用;② 脂肪生成研究中,使用3T3-L1脂肪细胞,检测Irisin对Wnt6/10a表达的影响;③ 神经保护研究中,使用海马切片,检测Irisin对cAMP/PKA/CREB磷酸化的影响。
结果解读:① 神经细胞中,STAT3抑制剂阻断Irisin诱导的增殖(Ki67阳性率下降40%,n=3,P<0.05);② 脂肪细胞中,Irisin上调Wnt6/10a表达(增加2倍,n=3,P<0.01),抑制脂肪生成(脂滴面积减少50%,n=3,P<0.01);③ 海马切片中,Irisin增加cAMP/PKA/CREB磷酸化(是对照组的1.5倍,n=3,P<0.05),促进BDNF表达。
实验所用关键产品:STAT3抑制剂Stattic、Wnt通路抑制剂IWR-1、cAMP检测试剂盒。
4. Biomarker研究及发现成果解析
现有研究中,循环Irisin(血清/血浆中的Irisin蛋白)是Fndc5/Irisin最受关注的Biomarker,其水平与代谢、神经及癌症疾病密切相关,具有潜在诊断及预后价值。
Biomarker定位与筛选逻辑
Biomarker类型:循环Irisin(血清/血浆)。
筛选/验证逻辑:通过“临床样本检测-表型关联-机制验证”三步法:① 检测疾病人群(如肥胖、阿尔茨海默病)与健康人群的血清Irisin水平,分析相关性;② 结合细胞/动物实验验证Irisin对疾病表型的调控作用;③ 探索Irisin与疾病指标(如BMI、认知评分)的量化关系。
研究过程详述
- 代谢疾病:Huh等2012年检测100例肥胖患者血清Irisin水平,发现与BMI正相关(r=0.45,P<0.01);Stengel等2013年发现肥胖患者减重后,血清Irisin水平下降25%(n=50,P<0.01)。
- 神经疾病:Lourenco等2019年检测30例阿尔茨海默病患者脑脊液Irisin水平,发现与认知功能评分正相关(r=0.52,P<0.05),水平越低认知障碍越严重。
- 癌症:Shao等2017年检测40例肺癌患者血清Irisin水平,发现低于健康人(下降30%,P<0.01),且与肿瘤转移负相关(转移患者水平比未转移患者低20%,P<0.05);Shi等2017年发现35例肝癌患者血清Irisin水平高于健康人(增加40%,P<0.01),与肿瘤大小正相关(r=0.48,P<0.01)。
核心成果提炼
- 代谢疾病:循环Irisin可作为肥胖、糖尿病的诊断Biomarker,水平与BMI、血糖正相关;
- 神经疾病:脑脊液Irisin可作为阿尔茨海默病的预后Biomarker,水平越低认知功能越差;
- 癌症:血清Irisin具有组织特异性——肺癌中低水平提示转移风险高,肝癌中高水平提示增殖活跃。
局限性:现有研究缺乏大规模前瞻性队列验证其特异性与敏感性(如ROC曲线分析),且未明确Irisin作为Biomarker的临界值(如肥胖患者的Irisin临界值)。
总结
这篇综述通过系统整合Fndc5/Irisin的信号通路与细胞活性,为其临床转化(如代谢疾病、神经退行性疾病的治疗靶点)提供了理论基础。未来研究需聚焦于:① 明确Fndc5/Irisin的组织特异性受体;② 解析信号通路的交叉调控;③ 开展大规模临床研究验证Biomarker的有效性。
