1. 领域背景与文献引入
文献英文标题:Morphological, biochemical, transcriptional and epigenetic responses to fasting and refeeding in intestine of Xenopus laevis;发表期刊:Cell Biosci;影响因子:未公开;研究领域:两栖动物肠道生理与代谢调控。
两栖动物作为变温脊椎动物,能在缺乏食物的环境中存活数月甚至数年,但其长期禁食的分子适应机制尚未完全阐明。肠道作为参与营养吸收、代谢调控的核心器官,其对禁食的响应是维持生存的关键。现有研究表明,恒温动物(如哺乳动物)短期禁食(如大鼠1周)会导致肠道上皮萎缩、屏障功能受损及细菌易位,但变温动物(如两栖类、爬行类)因代谢率低,且具备“代谢抑制”(metabolic rate depression)能力,能通过肠道结构与功能的可塑性适应长期禁食。然而,两栖动物肠道对禁食/重新喂食的多维度(形态、生化、转录、表观遗传)响应机制仍不清楚,现有研究多集中在鱼类、爬行类,缺乏对两栖类肠道转录及表观遗传调控的系统分析。
本文以非洲爪蟾(Xenopus laevis)为模型,通过分析禁食和重新喂食后肠道的形态学变化、生化指标、基因表达及表观遗传修饰,旨在揭示两栖动物肠道适应禁食的分子机制,填补领域空白。
2. 文献综述解析
作者对现有研究的评述逻辑基于“恒温动物 vs 变温动物”的肠道响应差异,及“形态/功能变化 vs 分子机制”的研究深度,核心结论如下:
1. 恒温动物短期禁食的肠道变化:如大鼠短期禁食会导致胃黏膜紊乱、肠道上皮萎缩,肠道消化酶活性降低,但重新喂食后3天内恢复;
2. 变温动物的代谢适应:变温动物(如鱼类、爬行类)能通过降低代谢率、重塑肠道结构(如细胞增殖/凋亡平衡、上皮层重塑)适应长期禁食,但其分子调控机制(如转录、表观遗传)未被系统研究;
3. 现有研究的局限性:缺乏对两栖动物肠道响应禁食的多组学分析,及转录后调控在肠道适应中的作用研究。
本文的创新价值在于:首次以非洲爪蟾为模型,系统分析肠道对禁食/重新喂食的形态、生化、转录及表观遗传变化,揭示表观遗传(组蛋白修饰、RNA聚合酶II状态)和转录后调控(mRNA稳定性)在肠道适应中的作用,为理解两栖动物长期禁食的生存策略提供新见解。
3. 研究思路总结与详细解析
整体框架:研究目标是阐明非洲爪蟾肠道对禁食和重新喂食的多维度响应机制;核心科学问题是“肠道如何通过转录、表观遗传及转录后调控适应禁食/重新喂食”;技术路线为“动物分组→样本收集→形态学/生化分析→转录水平检测→表观遗传分析→转录后调控验证”。
3.1 动物处理与样本收集
实验目的:获得不同饮食状态的爪蟾样本,用于后续分析。
方法细节:将24只1岁雄性非洲爪蟾分为3组(8只/组):(1)喂食组:每日投喂4只蟋蟀,持续22天;(2)禁食组:禁食22天;(3)重新喂食组:禁食21天,第22天投喂4只蟋蟀。实验终点处,断头收集血浆,解剖获取肠道,清洗后分为三部分:中间段用于形态学分析,近端+远端混合用于生化、转录及表观遗传分析。
结果解读:各组体重无显著变化;禁食组肠道湿重较喂食组降低52%,重新喂食组部分恢复;血浆及肠道样本用于后续检测。
产品关联:实验所用关键试剂包括Sigma的l-丙氨酸-4-硝基苯胺、Wako的葡萄糖CII测试盒、Merck Millipore的组蛋白抗体(如H3K9ac抗体,货号07-352)。
3.2 肠道形态学与血浆生化分析
实验目的:检测禁食/重新喂食对肠道结构及血浆代谢物的影响。
方法细节:肠道中间段固定后HE染色,测量上皮层周长、绒毛-凹槽单元数等形态参数;血浆样本用比色法检测葡萄糖、甘油三酯、胆固醇、游离脂肪酸浓度。
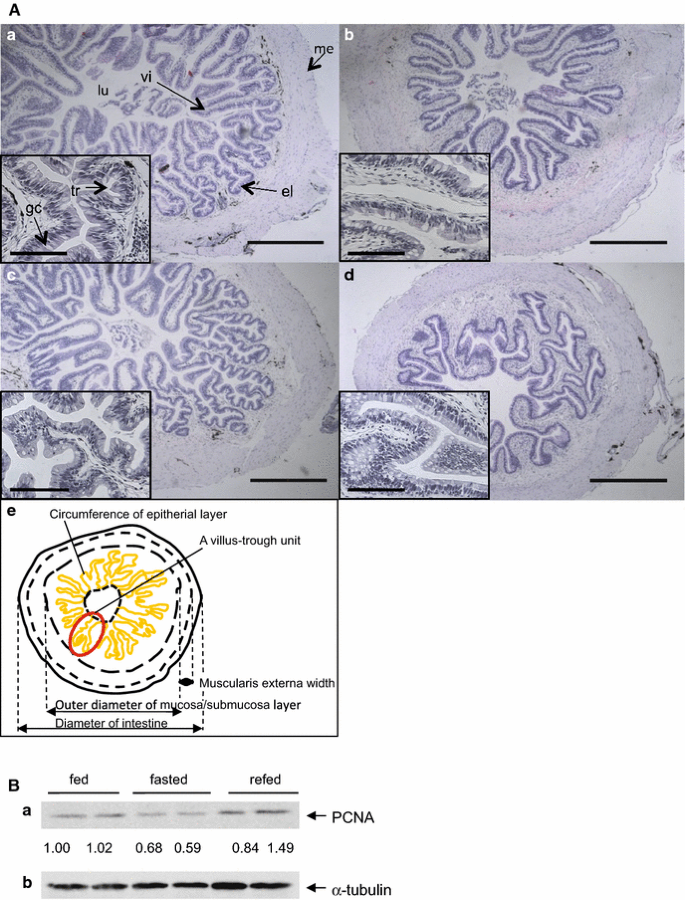
结果解读:禁食组肠道上皮层周长较喂食组降低43%,绒毛-凹槽单元数减少(图1);血浆葡萄糖、甘油三酯、游离脂肪酸浓度分别降低至喂食组的44%、64%、44%(n=8,P<0.05),重新喂食组部分恢复(表1)。
产品关联:形态学分析使用Olympus BX61显微镜,血浆生化检测使用Wako的商业化试剂盒。
3.3 肠道消化酶活性检测
实验目的:评估肠道消化功能变化。
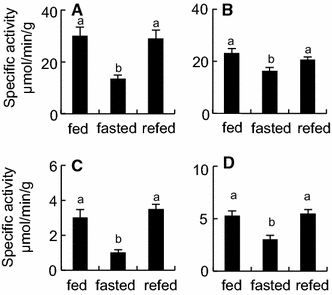
方法细节:采用比色法检测肠道匀浆中碱性磷酸酶(底物4-硝基苯 phosphate)、氨基肽酶(底物l-丙氨酸-4-硝基苯胺)、葡萄糖淀粉酶(底物可溶性淀粉)、麦芽糖酶(底物麦芽糖)的活性。
结果解读:禁食组碱性磷酸酶、氨基肽酶、葡萄糖淀粉酶、麦芽糖酶活性分别降低至喂食组的45%、70%、34%、58%(n=8,P<0.05),重新喂食1天后恢复至喂食组水平(图2)。
产品关联:酶活性检测所用底物购自Sigma、Wako等品牌,如l-丙氨酸-4-硝基苯胺购自Sigma。
3.4 转录水平分析(逆转录-定量聚合酶链反应)
实验目的:检测肠道基因表达变化。
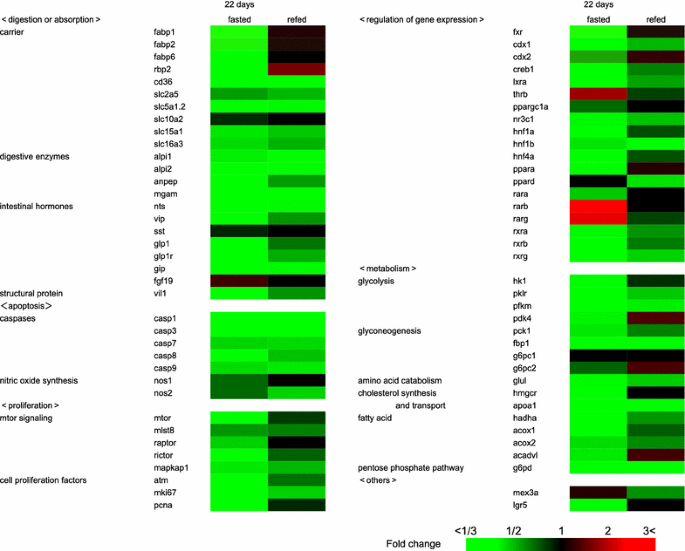
方法细节:提取肠道总RNA,逆转录为cDNA,RT-qPCR检测74个基因(分为消化/吸收、凋亡、增殖、基因表达调控、代谢等6类)。
结果解读:禁食组19个消化/吸收基因、7个凋亡基因、8个增殖基因表达下调,重新喂食后部分基因(如fabp1、fabp2、cdx2)快速恢复至喂食组水平,部分基因(如caspase家族)仍低(图3)。
产品关联:RT-qPCR使用Applied Biosystems的Taqman RT试剂盒和Power SYBR Green Master Mix。
3.5 表观遗传分析(染色质免疫沉淀)
实验目的:研究关键基因的组蛋白修饰及RNA聚合酶II状态。
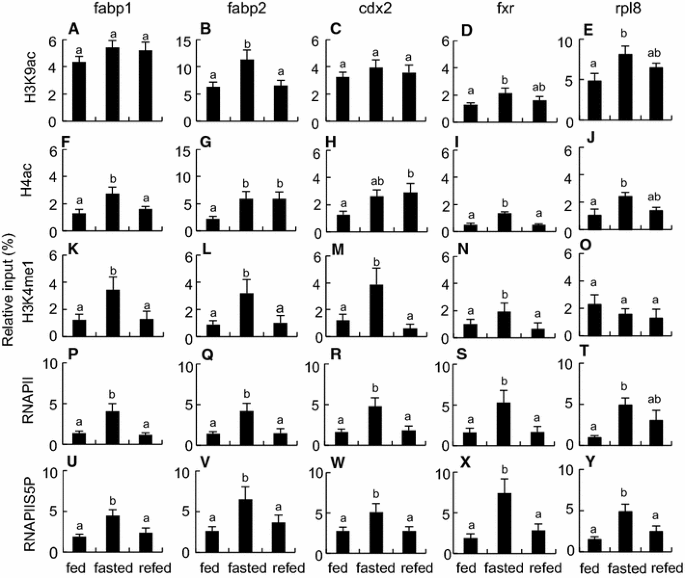
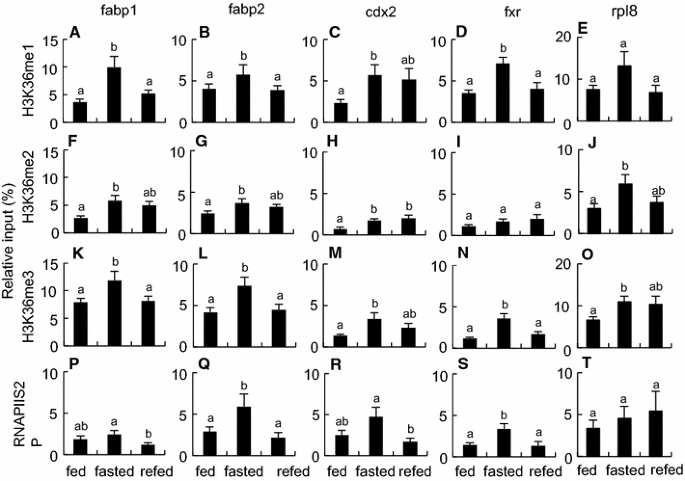
方法细节:选取fabp1、fabp2、cdx2、fxr(禁食下调、重新喂食快速恢复的基因),ChIP检测组蛋白乙酰化(H3K9ac、H4ac)、甲基化(H3K4me1、H3K36me)及RNA聚合酶II磷酸化(RNAPIIS5P、RNAPIIS2P)水平。
结果解读:禁食组fabp2的H3K9ac、fxr的H4ac较喂食组显著增加(n=8,P<0.05),RNAPIIS5P(转录起始标记)在4个基因中均增加;重新喂食组这些修饰恢复至喂食组水平(图4、5)。
产品关联:ChIP实验使用Merck Millipore的H3K9ac抗体(货号07-352)、Abcam的RNAPIIS5P抗体(货号ab5131)等。
3.6 转录后调控研究
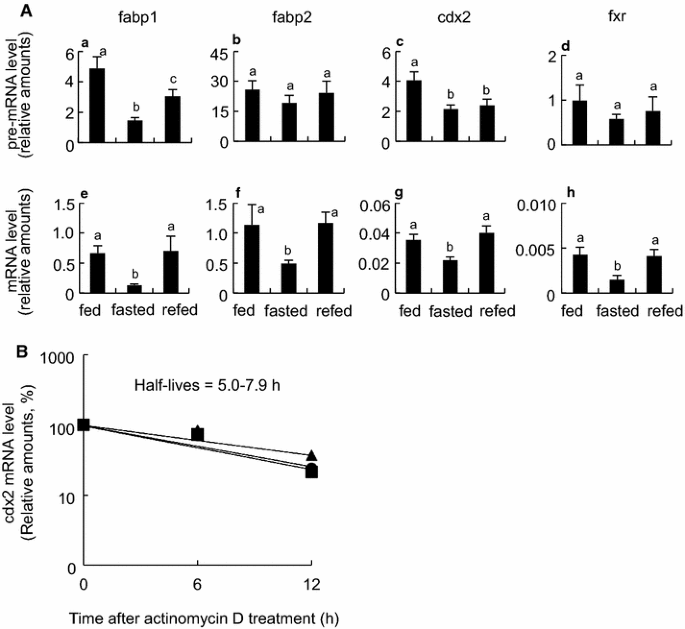
实验目的:探讨mRNA稳定性及转录后调控。
方法细节:RT-qPCR同时检测pre-mRNA与成熟mRNA水平;肠道组织培养时加入actinomycin D抑制RNA合成,检测cdx2 mRNA半衰期。
结果解读:禁食组成熟mRNA水平较pre-mRNA下降更显著(如fabp1成熟mRNA降低至喂食组的20%,pre-mRNA降低至50%);重新喂食组成熟mRNA恢复更明显;cdx2 mRNA半衰期在各组无显著差异(5.0-7.9小时,n=8,P>0.05)(图6)。
产品关联:actinomycin D购自Wako,浓度为25μg/mL。
4. Biomarker研究及发现成果解析
Biomarker定位
本文的Biomarker为响应禁食/重新喂食的关键基因(fabp1、fabp2、cdx2、fxr),类型为“代谢状态响应基因”。筛选逻辑:基于RT-qPCR结果(禁食下调、重新喂食快速恢复)→ChIP验证表观遗传修饰→转录后调控研究,形成完整验证链。
研究过程详述
- 表达变化:fabp1 mRNA在禁食时降低至喂食组的20%(n=8,P<0.05),重新喂食1天后恢复至80%以上;cdx2 mRNA禁食时降低至30%,重新喂食后恢复至90%。
- 表观遗传修饰:禁食时fabp2的H3K9ac增加2倍(n=8,P<0.05),fxr的H4ac增加1.5倍,提示基因处于“转录活性待命状态”;重新喂食后修饰恢复,转录启动。
- 转录后调控:pre-mRNA水平变化较小(如fabp1 pre-mRNA降低至50%),成熟mRNA下降更显著,提示存在转录后调控(如mRNA降解加速)。
核心成果提炼
- 功能关联:fabp1、fabp2、cdx2、fxr可作为非洲爪蟾肠道对禁食/重新喂食响应的分子标志物,其表达变化反映肠道代谢状态(禁食时抑制、重新喂食时激活)。
- 创新性:首次发现两栖动物肠道基因在禁食时处于“表观遗传活性但转录抑制”状态(组蛋白乙酰化增加但mRNA水平低),重新喂食后快速启动转录,揭示表观遗传修饰在肠道快速响应中的作用。
- 统计学结果:fabp1成熟mRNA禁食时降低至20%(n=8,P<0.05),重新喂食后恢复至85%;cdx2 H3K4me1(启动子活性标记)禁食时增加2倍(n=8,P<0.05)。
本研究为理解两栖动物长期禁食的生存策略提供了多维度证据,也为恒温动物(如人类)长期禁食的肠道保护研究提供了参考。
