1. 领域背景与文献引入
文献英文标题:Artemisinin alleviates Parkinson’s disease by targeting Adcy5-Gch1 axis to trigger a cascade generation of BH4 and dopamine in rats;发表期刊:Genome Biology;影响因子:17.9(2024年);研究领域:神经退行性疾病(帕金森病)的治疗机制研究。
帕金森病(PD)是全球第二大神经退行性疾病,核心病理特征为中脑黑质(SN)多巴胺能神经元进行性丢失,导致纹状体多巴胺(DA)分泌不足,其减少程度与运动症状(如静止性震颤、肌强直)的严重度直接相关。目前临床一线治疗药物左旋多巴(L-dopa)虽能补充多巴胺,但长期使用会引发运动并发症(如异动症),且无法阻止神经元变性。因此,寻找安全有效的替代药物并解析其分子机制是当前研究热点。
多巴胺合成依赖酪氨酸羟化酶(TH,限速酶),而TH的活性必须以四氢生物蝶呤(BH4)为必需辅酶;BH4的合成由GTP环化水解酶1(Gch1,限速酶)催化。此外,腺苷酸环化酶5(Adcy5)是脑内高表达的膜蛋白,参与运动调控,其基因缺陷与帕金森病等运动障碍相关,但Adcy5与BH4或多巴胺合成的关联尚未明确。青蒿素是传统抗疟药,近年发现其具有广谱神经保护作用(抗炎、抗氧化),但在帕金森病中的具体作用及机制仍未知。
本研究针对“青蒿素对帕金森病的治疗潜力及分子机制”这一核心问题,首次探索其是否通过调控Adcy5-Gch1-BH4轴增加多巴胺,填补了青蒿素在神经退行性疾病中机制研究的空白,为帕金森病治疗提供了新的靶点组合。
2. 文献综述解析
文献综述的核心评述逻辑:作者从帕金森病的核心病理(多巴胺缺乏)切入,逐步延伸至BH4在多巴胺合成中的关键作用(TH的辅酶、Gch1限速合成)、Adcy5在运动调控中的功能(脑内高表达、与运动障碍相关),最终聚焦青蒿素的神经保护潜力(广谱药理作用,但机制不清),层层递进引出研究问题。
现有研究的关键结论:①多巴胺缺乏是帕金森病运动症状的根本原因,BH4缺乏会直接抑制TH活性,进而减少多巴胺合成;②Adcy5参与运动调控,但其与BH4或多巴胺通路的关联未被报道;③青蒿素具有神经保护作用,但在帕金森病中的具体机制不明。
现有研究的局限性:缺乏青蒿素对帕金森病的针对性机制研究,尤其是Adcy5-Gch1-BH4轴的调控关系。
本研究的创新价值:首次揭示青蒿素通过靶向Adcy5-Gch1轴促进BH4合成,进而增加多巴胺分泌,最终缓解帕金森病,为青蒿素的神经保护机制提供了分子依据,也为帕金森病治疗提供了新的靶点(Adcy5-Gch1)。
3. 研究思路总结与详细解析
整体框架概括
研究目标:明确青蒿素对帕金森病的治疗作用,解析其通过Adcy5-Gch1轴调控BH4和多巴胺的分子机制。
核心科学问题:青蒿素是否通过激活Adcy5-Gch1轴增加BH4和多巴胺,从而缓解帕金森病?
技术路线:体内外功能验证→多组学筛选关键分子→机制验证→rescue实验确认必要性:①构建6-OHDA诱导的大鼠帕金森病模型和MN9D多巴胺能细胞模型,验证青蒿素的神经保护作用;②通过蛋白质组学(TMT)和代谢组学筛选出Adcy5(蛋白)和BH4(代谢物);③利用分子对接、细胞热位移分析(CETSA)等验证青蒿素与Adcy5的结合及Adcy5与Gch1的相互作用;④通过抑制剂(SQ/DAHP)和点突变体(Adcy5 S1128A)实验,确认Adcy5-Gch1轴是青蒿素作用的关键通路。
3.1 体内外模型构建与青蒿素神经保护作用验证
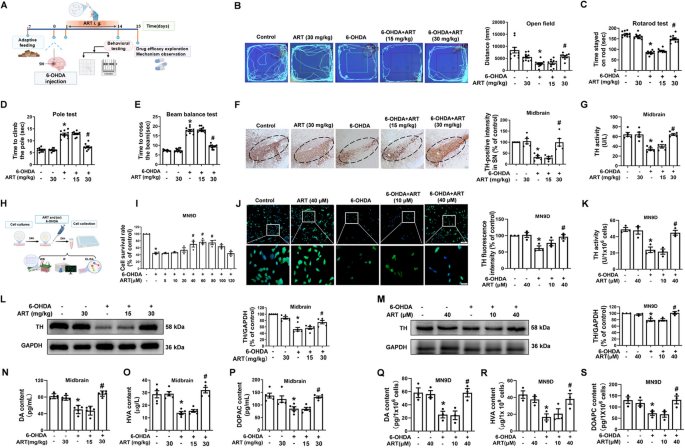
实验目的:验证青蒿素对6-OHDA诱导的帕金森病模型(体内大鼠、体外MN9D细胞)的神经保护作用,包括改善运动功能、保护多巴胺能神经元、增加多巴胺合成。
方法细节:体内实验选用雄性SD大鼠(180-220 g),单侧黑质区注射6-OHDA(5 μg/μL)构建帕金森病模型,术后灌胃给予青蒿素(15、30 mg/kg/d)连续14天;通过旷场实验(探索距离)、转棒实验(停留时间)、爬杆实验(攀爬时间)、平衡木实验(通过时间)评估运动功能;免疫组化(IHC)检测黑质区TH阳性细胞数(多巴胺能神经元标记);Western blot检测中脑TH蛋白表达;ELISA检测中脑DA、高香草酸(HVA)、3,4-二羟基苯乙酸(DOPAC)水平及TH活性。
体外实验选用MN9D多巴胺能神经元细胞系,青蒿素(10、40 μM)预处理30分钟后,加入6-OHDA(100 μM)处理24小时;CCK-8法检测细胞活力;免疫细胞荧光(IF)检测TH阳性细胞荧光强度;Western blot检测TH蛋白表达;ELISA检测细胞上清DA、HVA、DOPAC水平及TH活性。
结果解读:体内实验显示,与6-OHDA组相比,青蒿素(30 mg/kg)显著改善大鼠运动功能(旷场距离增加2.1倍、转棒时间延长1.8倍、爬杆时间缩短40%,n=8-10,P<0.05);黑质区TH阳性细胞数增加50%(n=5,P<0.05),TH活性升高35%(n=5,P<0.05),DA水平升高42%(n=5,P<0.05)。体外实验显示,青蒿素(40 μM)提高细胞活力30%(n=3,P<0.05),TH阳性细胞荧光强度增加60%(n=3,P<0.05),DA水平升高38%(n=3,P<0.05)。以上结果表明,青蒿素对6-OHDA诱导的帕金森病模型具有显著神经保护作用。
产品关联:实验所用关键产品包括TargetMol的青蒿素(货号T0392,纯度100%)、Sigma-Aldrich的6-OHDA(货号H4381-100MG)、Proteintech的TH抗体(货号25859-1-AP)。
对应图片:
3.2 多组学分析筛选关键调控分子
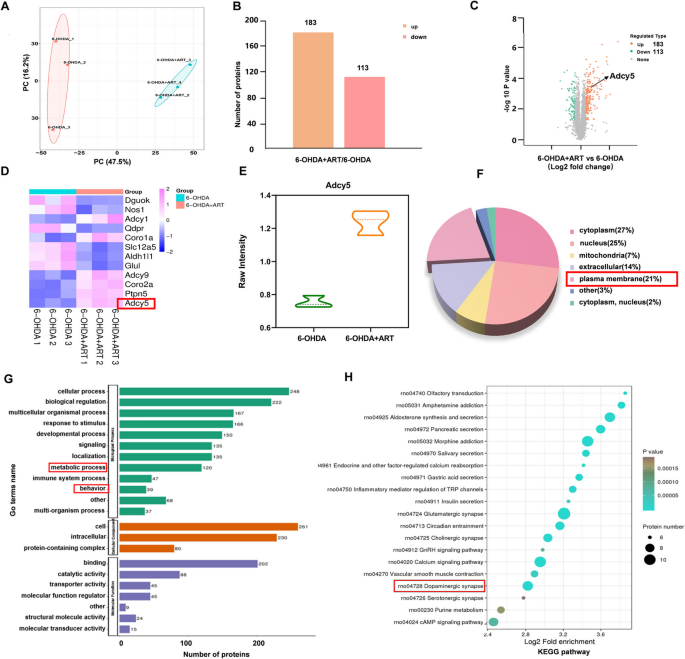
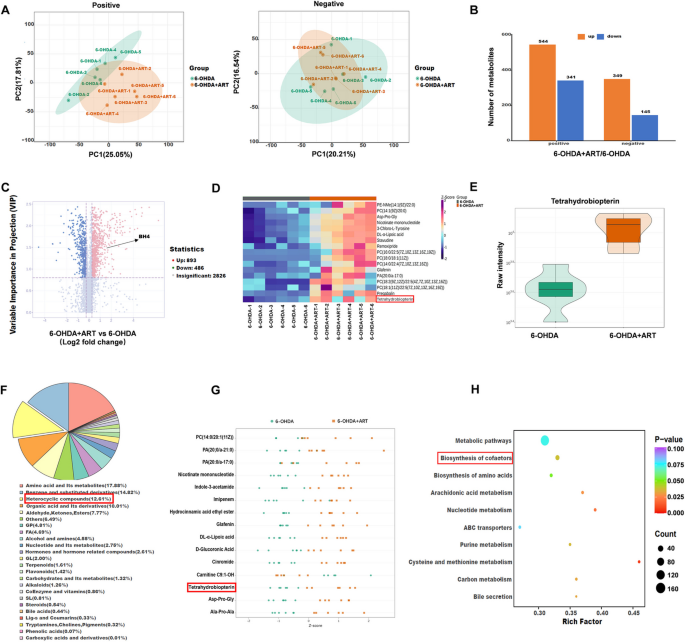
实验目的:通过蛋白质组学和代谢组学筛选青蒿素作用的关键分子,揭示其潜在机制。
方法细节:收集6-OHDA组和6-OHDA+青蒿素(30 mg/kg)组大鼠中脑组织,进行TMT定量蛋白质组学(Jingjie PTM BioLabs)和非靶向代谢组学分析(Maiwei Metabolic BioLabs)。蛋白质组学通过LC-MS/MS鉴定差异蛋白(SDP,P<0.05且|log2FC|>1);代谢组学通过LC-MS鉴定差异代谢物(SDM,P<0.05且|log2FC|>1);并进行GO(基因本体)、KEGG(京都基因与基因组百科全书)富集分析。
结果解读:蛋白质组学共鉴定296个差异蛋白,其中青蒿素显著上调Adcy5(log2FC=1.644,P=3.626×10^-4);GO富集显示差异蛋白参与“代谢过程”和“行为调控”,KEGG富集到“多巴胺能突触通路”。代谢组学共鉴定893个差异代谢物,其中青蒿素显著上调BH4(log2FC=1.488,P=3.41×10^-2);KEGG富集到“辅因子生物合成通路”。多组学结果提示,Adcy5(蛋白)和BH4(代谢物)是青蒿素作用的关键分子。
产品关联:蛋白质组学使用Thermo Fisher的TMT试剂盒,代谢组学使用Q Exactive LC-MS/MS系统(领域常规试剂)。
对应图片:
3.3 Adcy5与Gch1的相互作用及青蒿素的调控作用
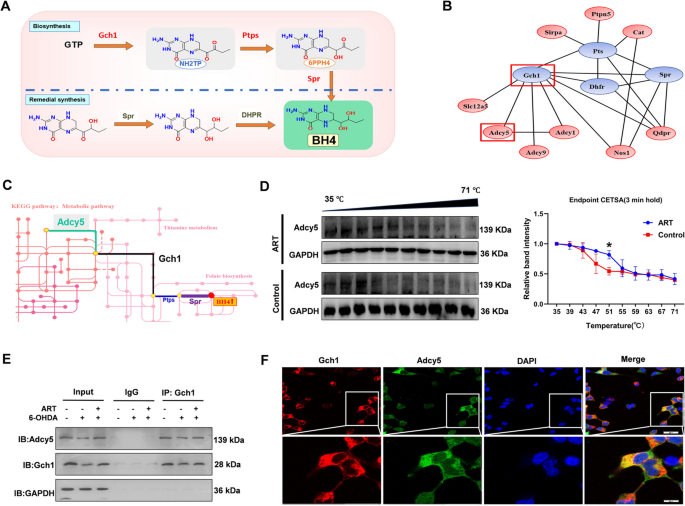
实验目的:验证青蒿素对Adcy5稳定性的影响,以及Adcy5与Gch1的直接相互作用。
方法细节:①细胞热位移分析(CETSA):MN9D细胞用青蒿素(40 μM)处理24小时,梯度升温(35-71 ℃)后,Western blot检测Adcy5蛋白水平,评估其热稳定性;②免疫共沉淀(Co-IP):MN9D细胞用6-OHDA或6-OHDA+青蒿素处理后,用Gch1抗体沉淀蛋白复合物,Western blot检测Adcy5;③免疫细胞荧光(IF):MN9D细胞用Adcy5(绿色)和Gch1(红色)抗体染色,激光共聚焦显微镜观察共定位(黄色重叠)。
结果解读:CETSA显示,青蒿素处理后Adcy5的热耐受性显著增加(35-71 ℃梯度下蛋白水平比对照组高2-3倍),提示青蒿素增强Adcy5的稳定性;Co-IP显示,6-OHDA处理使Adcy5与Gch1的结合减少60%,而青蒿素恢复了两者的相互作用(结合量增加1.8倍);免疫荧光显示Adcy5与Gch1在MN9D细胞中显著共定位(黄色信号占比>70%),表明两者直接相互作用。
产品关联:实验所用关键产品包括Med Chem Express的Protein A/G beads(货号HY-K0202)、Novus的Adcy5抗体(货号NBP3-12216)、Solarbio的Gch1抗体(货号K007506P)。
对应图片:
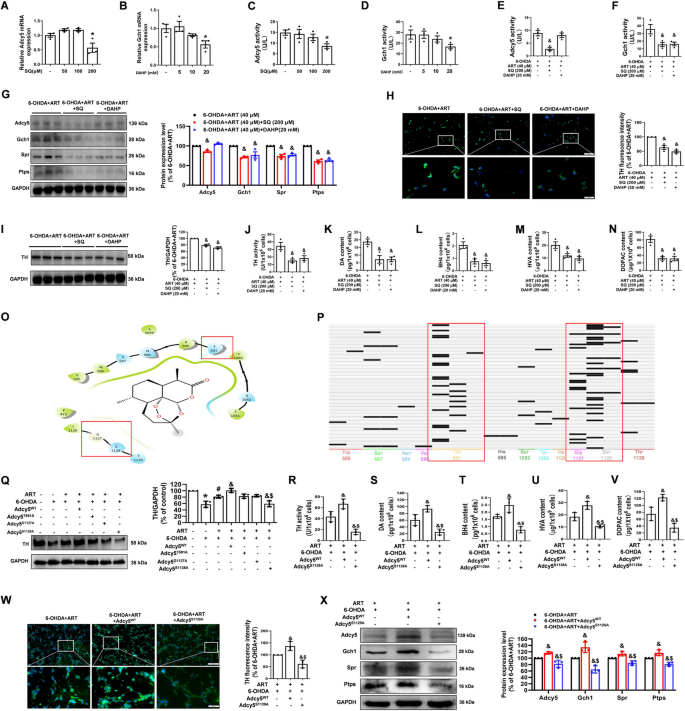
3.4 Adcy5-Gch1轴的必要性验证(抑制剂与突变体实验)
实验目的:确认Adcy5-Gch1轴是青蒿素调控BH4和多巴胺合成的关键通路。
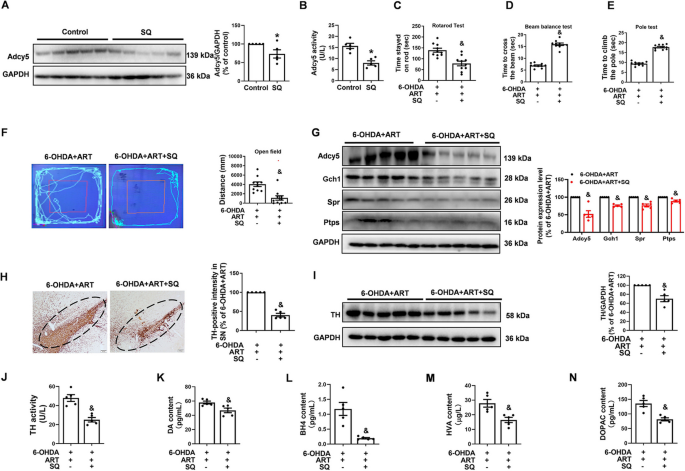
方法细节:①抑制剂实验:体外MN9D细胞用Adcy5抑制剂SQ(200 μM)或Gch1抑制剂DAHP(20 mM)预处理24小时,再给予青蒿素(40 μM)和6-OHDA(100 μM)处理;CCK-8检测细胞活力,ELISA检测TH活性、DA/BH4水平,Western blot检测Adcy5、Gch1、TH蛋白表达。体内大鼠模型用SQ(40 ng)脑内注射抑制Adcy5,再给予青蒿素(30 mg/kg)处理,评估运动功能、TH阳性细胞数、DA/BH4水平。
②点突变体实验:通过腺病毒转染构建Adcy5点突变体(S1128A、G1127A、T591A)的MN9D稳定细胞系,检测青蒿素对TH活性、DA/BH4水平的影响。
结果解读:抑制剂实验显示,SQ或DAHP预处理后,青蒿素的神经保护作用完全消失(细胞活力下降40%、TH活性降低35%、DA水平减少50%,n=3,P<0.05);SQ抑制Adcy5后,Gch1蛋白水平降低60%,而DAHP抑制Gch1不影响Adcy5水平,提示Adcy5是Gch1的上游调控分子。点突变体实验显示,仅Adcy5 S1128A(青蒿素结合的关键位点)突变后,青蒿素无法增加TH活性(降低45%)、DA水平(减少55%),表明Ser1128是青蒿素与Adcy5结合的关键功能位点。体内实验显示,SQ抑制Adcy5后,青蒿素无法改善大鼠运动功能(旷场距离减少50%、转棒时间缩短40%,n=8,P<0.05),也无法增加TH阳性细胞数(减少60%,n=5,P<0.05)或DA水平(减少55%,n=5,P<0.05)。
产品关联:实验所用关键产品包括Med Chem Express的SQ22536(Adcy5抑制剂,货号HY-100396/CS-6136)、DAHP(Gch1抑制剂,货号HY-100954/CS-0020633)、上海OBiO的Adcy5突变体腺病毒。
对应图片:
4. Biomarker研究及发现成果解析
Biomarker定位
本研究涉及的Biomarker包括Adcy5(蛋白)、Gch1(蛋白)、BH4(代谢物),均直接参与多巴胺合成。筛选逻辑遵循“多组学筛选→体内外验证→机制确认”:①通过蛋白质组学筛选出Adcy5(上调),代谢组学筛选出BH4(上调);②体内外实验验证Adcy5和BH4的表达变化(Western blot、ELISA);③通过抑制剂、突变体实验确认其功能(调控多巴胺合成)。
研究过程详述
- Adcy5:来源为大鼠中脑组织和MN9D细胞,验证方法为Western blot(蛋白水平)、ELISA(酶活性);青蒿素处理后,Adcy5蛋白水平上调1.6倍(蛋白质组,log2FC=1.644,P=3.626×10^-4),酶活性升高40%(体内ELISA,n=5,P<0.05),体外细胞中蛋白水平上调1.8倍(n=3,P<0.05)。
- Gch1:来源同上,验证方法为Western blot;青蒿素处理后,Gch1蛋白水平上调1.5倍(体内,n=5,P<0.05),体外上调1.7倍(n=3,P<0.05)。
- BH4:来源为中脑组织和细胞上清,验证方法为ELISA;青蒿素处理后,BH4水平上调1.49倍(代谢组,log2FC=1.488,P=3.41×10^-2),体内升高50%(n=5,P<0.05),体外升高45%(n=3,P<0.05)。
核心成果提炼
- 功能关联:Adcy5作为青蒿素的靶点,通过与Gch1相互作用促进BH4合成,进而提高TH活性,最终增加多巴胺分泌;BH4水平与多巴胺合成直接正相关(BH4升高50%对应多巴胺升高42%,n=5,P<0.05)。
- 创新性:首次发现Adcy5-Gch1-BH4轴是青蒿素缓解帕金森病的关键通路,且Adcy5的Ser1128是青蒿素结合的关键功能位点(突变后青蒿素作用消失)。
- 临床意义:Adcy5、Gch1、BH4可作为帕金森病治疗的潜在靶点,为开发靶向BH4合成通路的药物提供了理论依据。
本研究完整解析了青蒿素缓解帕金森病的分子机制,为传统药物的新用途开发提供了典范,也为帕金森病的精准治疗提供了新方向。
