1. 领域背景与文献引入
文献英文标题:In vivo rescue of genetic dilated cardiomyopathy by systemic delivery of nexilin;发表期刊:Genome Biology;影响因子:14.028(2023年);研究领域:遗传性扩张型心肌病的基因治疗。
扩张型心肌病(Dilated Cardiomyopathy, DCM)是全球范围内导致心力衰竭的主要病因之一,以心室腔扩大、收缩功能障碍为特征,患病率约1:2500,5年死亡率高达30%~50%。遗传因素是DCM的重要病因,已发现包括NEXN在内的多个心肌基因突变为致病因素。NEXN编码的Nexilin蛋白是心肌 junctional membrane complex的关键组分,参与T管形成和Ca²+信号调控,其纯合或杂合突变可导致严重DCM,甚至新生儿早逝。目前DCM的治疗以利尿剂、ACEI等对症药物为主,仅能缓解症状;终末期依赖心脏移植,但供体短缺限制了应用,缺乏针对遗传突变的病因治疗。
尽管NEXN突变与DCM的关联已明确,但尚未有靶向Nexilin的治疗策略。腺相关病毒(Adeno-Associated Virus, AAV)因低免疫原性、可靶向心肌等优势,是基因治疗的理想载体,但未应用于NEXN相关DCM。本研究旨在探索AAV介导的Nexilin基因替代治疗对Nexn缺陷DCM小鼠的疗效,解决遗传DCM的病因治疗难题,为临床转化提供实验依据。
2. 文献综述解析
文献综述围绕“DCM的遗传病因→现有治疗局限→NEXN的功能与突变关联→基因治疗潜力”展开核心评述。现有研究的关键结论包括:①NEXN是心肌T管形成和Ca²+处理的必需蛋白,Nexn全敲除(gKO)小鼠出生后10天内死亡,表现为严重DCM;②G645del(对应人类G650del)突变小鼠再现人类DCM表型(心室扩大、功能下降);③现有治疗无法逆转遗传突变的致病作用,移植供体不足;④AAV载体是基因治疗的理想工具,但未用于NEXN相关DCM。
现有研究的局限性:①未探索Nexilin基因替代的长期疗效;②未明确Nexilin的最小功能域(解决AAV包装容量限制);③未验证人源NEXN对突变模型的效果。本研究的创新点在于:①首次验证AAV介导的Nexilin基因替代对Nexn gKO和G645del小鼠的短期(1个月)和长期(19个月)疗效;②发现Nexilin截断体S3(含一个ABD和C端IGcam域)足以维持心肌功能;③证明人源NEXN可挽救G645del小鼠的DCM,为临床转化提供依据。
3. 研究思路总结与详细解析
本研究以“Nexn缺陷DCM的基因治疗”为核心,构建AAV-Nexn载体(小鼠全长长、截断体、人源),输注新生Nexn缺陷小鼠,从体重、心脏形态、功能(超声)、蛋白表达等层面评估疗效,最终验证长期效果。技术路线为“载体构建→体内输注→表型检测→机制验证→长期观察”的闭环。
3.1 AAV-Nexn载体构建与promoters心肌特异性验证
实验目的:构建可表达Nexilin的AAV9载体,验证CMV(全身表达)和cTnt(心肌特异性)启动子的组织靶向性。
方法细节:构建AAV9-CMV-mNexn(小鼠全长长Nexn)、AAV9-cTnt-mNexn及对应的EGFP对照载体;将AAV-EGFP注射到新生WT小鼠(P0.5)面部静脉,7天后检测心脏、肝脏、肌肉的EGFP表达。
结果解读:cTnt启动子驱动的EGFP仅在心脏高表达,CMV启动子在多组织表达,证明cTnt具有心肌特异性。
产品关联:文献未提及具体AAV包装试剂,领域常规使用AAV2/9 capsid载体系统(如AAVpro® Helper Free System)。
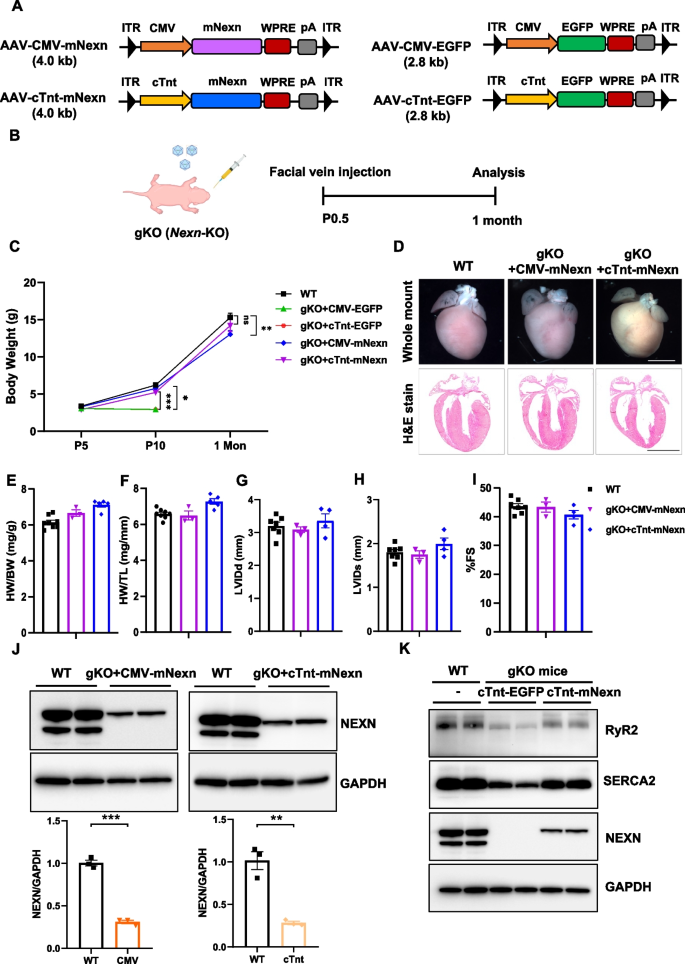
3.2 Nexn gKO小鼠的AAV-Nexn治疗效果评估
实验目的:验证AAV介导的Nexilin基因替代对Nexn gKO小鼠的疗效(存活、心脏功能恢复)。
方法细节:将AAV-CMV-mNexn或AAV-cTnt-mNexn(1×10¹¹ vg)注射到P0.5的Nexn gKO小鼠面部静脉;对照组注射AAV-EGFP;1个月后检测体重、心脏H&E染色、超声心动图(HW/BW、LVIDd、FS)及心肌Nexilin表达(免疫印迹)。
结果解读:对照组gKO小鼠体重显著下降(n=3,P<0.01),10天内死亡;治疗组小鼠体重增长与WT一致,存活至1个月;心脏形态恢复正常(H&E染色显示心室无扩大);超声参数中,HW/BW(心脏重量/体重)、LVIDd(左心室舒张末期内径)恢复至WT水平,FS(射血分数)从<20%恢复至>40%(n=3-5,P<0.01);免疫印迹显示治疗组Nexilin表达恢复至WT的30%(n=3,P<0.01)。
产品关联:超声心动图使用VisualSonics Vevo 2100系统;免疫印迹检测Nexilin的抗体未明确,领域常规使用anti-Nexilin抗体(如Abcam ab124916)。
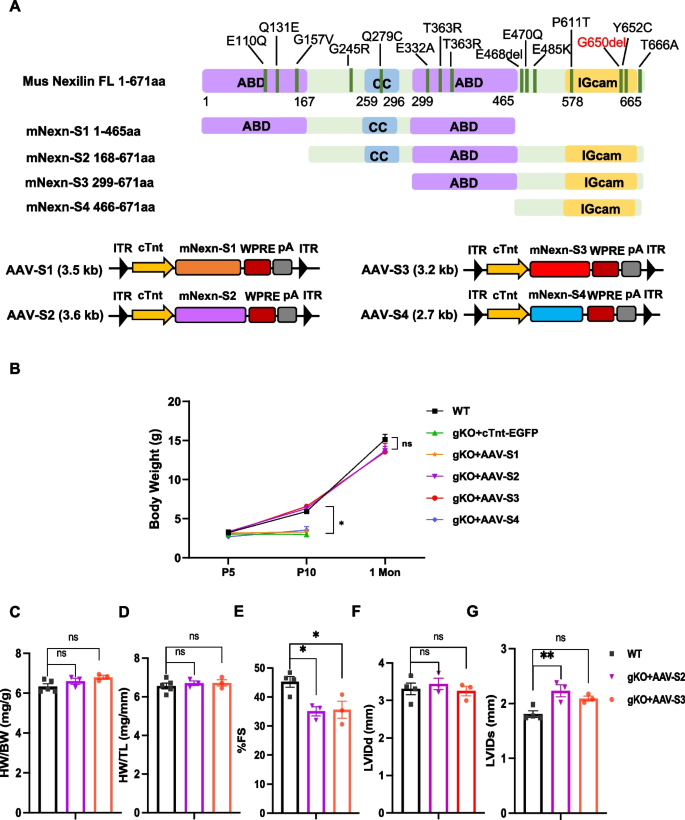
3.3 Nexilin功能域的鉴定
实验目的:明确Nexilin的最小功能域,解决AAV包装容量(~4.7 kb)限制。
方法细节:构建Nexilin截断体(S1:缺失C端IGcam;S2:缺失N端ABD;S3:缺失N端ABD和卷曲螺旋域;S4:仅含C端IGcam),包装成AAV9-cTnt-截断体;注射到P0.5的Nexn gKO小鼠,1个月后检测体重、超声参数(FS、LVIDd)。
结果解读:S1和S4治疗组小鼠10天内死亡;S2和S3治疗组小鼠体重、FS(>40%)、LVIDd与WT一致(n=3,P<0.05);证明Nexilin的C端IGcam域和至少一个ABD域是必需的,S3(含一个ABD和IGcam)是最小功能单位。
产品关联:文献未提及截断体构建试剂,领域常规使用PCR克隆和限制性内切酶(如BamHI)。
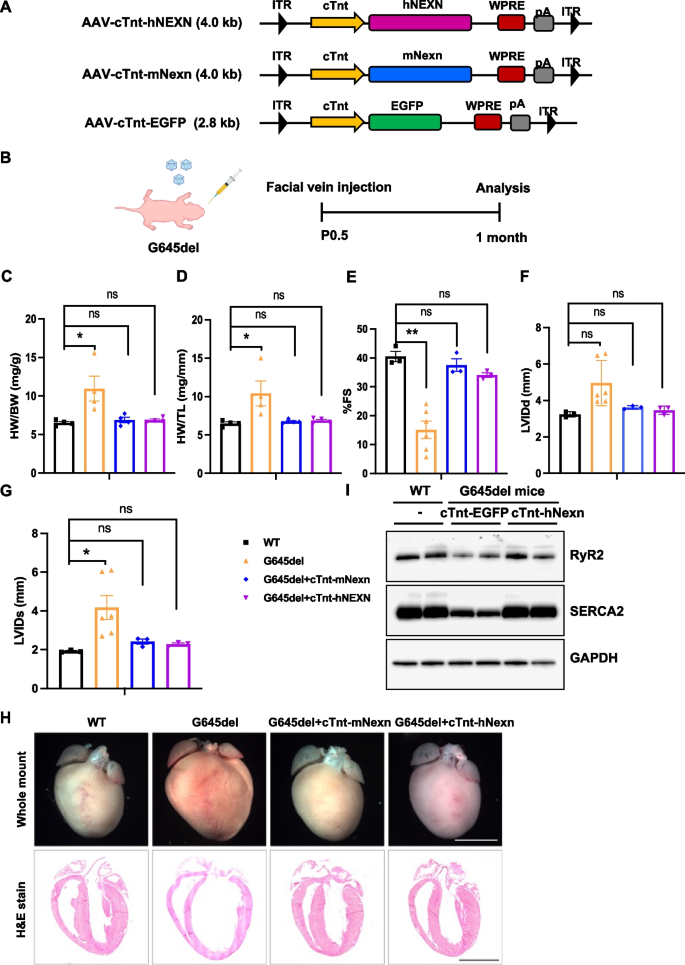
3.4 G645del突变小鼠的人源NEXN治疗效果
实验目的:验证人源NEXN对G645del突变DCM小鼠的疗效,为临床转化提供依据。
方法细节:构建AAV9-cTnt-hNEXN(人全长长NEXN),注射到P0.5的G645del小鼠面部静脉;对照组注射AAV-EGFP;1个月后检测超声参数(FS、LVIDd)、心脏H&E染色及Ca²+处理蛋白(RyR2、SERCA2)表达(免疫印迹)。
结果解读:对照组G645del小鼠FS显著下降(n=6,P<0.01),心室扩大;治疗组FS恢复至WT水平,心脏形态正常;免疫印迹显示RyR2、SERCA2表达较对照组上调(n=3,P<0.05),证明人源NEXN可恢复Ca²+处理功能。
产品关联:人源NEXN的cDNA来自人类心肌细胞RNA反转录,领域常规使用TRIzol(Invitrogen)提取RNA。
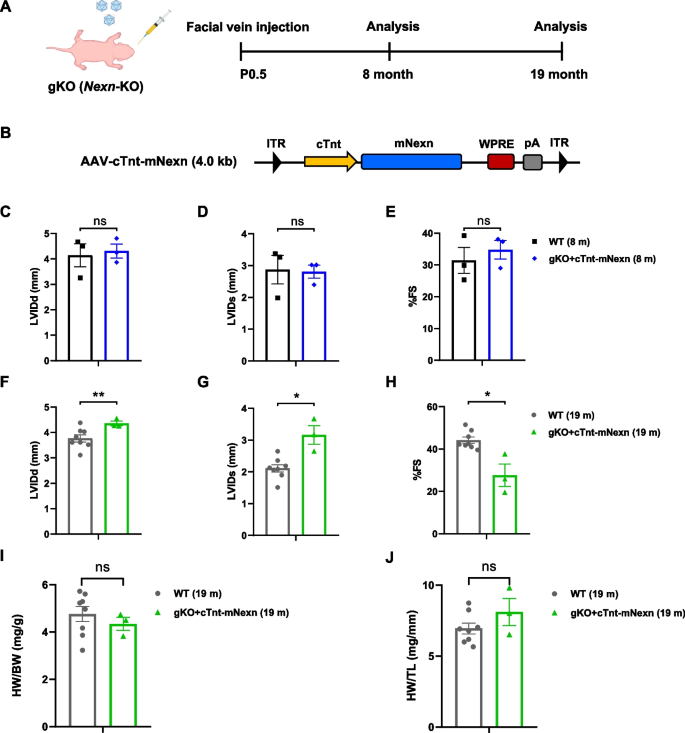
3.5 AAV-Nexn的长期疗效观察
实验目的:评估AAV介导的Nexilin基因替代对Nexn gKO小鼠的长期(19个月)疗效。
方法细节:将AAV-cTnt-mNexn注射到P0.5的Nexn gKO小鼠,分别在8个月和19个月检测超声参数(LVIDd、FS)及HW/BW。
结果解读:8个月时,治疗组小鼠的超声参数与WT一致;19个月时,FS略有下降但仍高于未治疗组(n=3,P<0.05),HW/BW与WT无显著差异;小鼠寿命从10天延长至19个月,证明单次AAV注射具有长期疗效。
产品关联:长期观察使用的超声设备与短期实验一致(VisualSonics Vevo 2100)。
4. Biomarker研究及发现成果解析
Biomarker定位:本研究的Biomarker为Nexilin蛋白,其表达缺失或突变是Nexn缺陷DCM的致病原因,恢复其表达可作为治疗效果的评估指标,属于“功能型治疗靶点Biomarker”。筛选/验证逻辑:基于Nexn gKO小鼠的DCM表型→AAV-Nexn治疗后Nexilin表达恢复→伴随心脏功能和Ca²+处理蛋白上调,验证其作为治疗靶点的有效性。
研究过程详述
Nexilin的来源为心肌组织;验证方法包括:①免疫印迹检测心肌Nexilin的表达水平(恢复至WT的30%,n=3,P<0.01);②超声心动图检测心脏功能(FS从<20%恢复至>40%,n=3-5,P<0.01);③免疫印迹检测Ca²+处理蛋白(RyR2、SERCA2)的表达(治疗后上调,n=3,P<0.05)。特异性数据:cTnt启动子驱动的Nexilin仅在心脏表达,不影响其他组织;敏感性数据:Nexilin表达恢复30%即可显著改善心脏功能。
核心成果提炼
①Nexilin可作为Nexn缺陷DCM的特异性治疗靶点,AAV介导的基因替代能恢复其表达并逆转DCM表型;②Nexilin的截断体S3(含一个ABD和C端IGcam)具有与全长长蛋白相当的功能,解决了AAV包装容量(~4.7 kb)的限制;③人源NEXN可有效挽救G645del突变小鼠的DCM,为临床治疗NEXN突变相关DCM提供依据;④长期疗效数据显示,单次AAV注射可延长Nexn gKO小鼠寿命至19个月,证明基因治疗的耐久性。
本研究首次验证了AAV介导的Nexilin基因替代治疗遗传性DCM的有效性,为NEXN突变相关DCM的临床转化提供了关键实验依据,有望成为遗传DCM的病因治疗新策略。
