1. 领域背景与文献引入
文献英文标题:Research progress and challenges of the PD-1/PD-L1 axis in gliomas;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:胶质瘤免疫治疗。
胶质瘤是全球最常见的颅内恶性肿瘤之一,以高侵袭性、高复发率及预后差为核心特征(文献1)。当前标准治疗方案为“最大范围手术切除+术后放疗+替莫唑胺化疗”,但由于肿瘤细胞的固有侵袭性及治疗抵抗性,患者复发率高达70%以上,复发后中位生存期不足12个月(文献2-4)。胶质瘤的核心生物学特征是肿瘤微环境(Tumor Microenvironment, TME)内存在严重的免疫抑制——肿瘤细胞通过招募免疫抑制细胞(如调节性T细胞、髓源性抑制细胞)、分泌抑制性细胞因子(如TGF-β、IL-10)及上调免疫检查点分子(如PD-1/PD-L1),导致抗肿瘤免疫防御功能丧失(文献5)。这一特征使免疫检查点抑制剂成为胶质瘤治疗的研究焦点,其中PD-1/PD-L1轴因在重塑TME、恢复T细胞功能中的关键作用,成为核心研究方向。然而,目前PD-1/PD-L1抑制剂在胶质瘤中的临床响应率仅约10%-15%,远低于黑色素瘤、肺癌等肿瘤,其疗效受限的机制及优化策略仍待明确。本文系统总结PD-1/PD-L1轴在胶质瘤中的表达调控、免疫微环境机制及临床应用的研究进展,分析当前挑战并提出未来方向,为胶质瘤免疫治疗的优化提供参考。
2. 文献综述解析
作者通过“PD-1/PD-L1在胶质瘤微环境中的表达与调控→对免疫细胞浸润的影响→临床应用进展”的逻辑框架,综述现有研究并分析局限性。
现有研究的关键结论可归纳为三点:其一,PD-L1表达具有“分级相关性”与“复发相关性”——高级别胶质瘤(如胶质母细胞瘤)的PD-L1阳性率(约30%-50%)显著高于低级别胶质瘤(约10%-20%),复发患者的PD-1/PD-L1表达水平较初诊患者高2-3倍(文献16-19);其二,PD-L1的调控是“多通路协同”的结果——EGFR通过Ras/RAF/MAPK、PI3K/Akt/mTOR通路促进PD-L1表达,IFN-γ、IL-6通过JAK/STAT通路诱导PD-L1转录,缺氧环境下HIF-1通过结合PD-L1启动子的缺氧响应元件(HRE-4)上调其表达(文献20-24);其三,PD-1/PD-L1轴是“免疫抑制的核心枢纽”——胶质瘤相关巨噬细胞(GAMs,M2型为主)通过PD-L1诱导T细胞凋亡,CD8+T细胞因PD-1/PD-L1相互作用发生功能耗竭,调节性T细胞(Tregs)通过PD-1/PD-L1轴扩增并抑制效应T细胞功能(文献26-31、35-36)。
现有研究的局限性在于:①单药疗效不足——PD-1/PD-L1抑制剂单药治疗的中位无进展生存期(PFS)仅1.4个月,中位总生存期(OS)约4个月(文献56-58);②生物标志物预测价值不明确——PD-L1表达并非绝对的治疗响应指标,部分PD-L1阳性患者无响应;③血脑屏障限制——PD-1/PD-L1抑制剂的大分子结构难以穿透血脑屏障,颅内药物浓度不足(文献98、105)。
本文的创新之处在于系统整合PD-1/PD-L1轴的“基础机制”与“临床应用”,明确“单药疗效有限”的核心原因是胶质瘤TME的“高度免疫抑制”,并提出“联合治疗”(化疗、放疗、溶瘤病毒、其他免疫检查点抑制剂)及“个性化治疗”(基于生物标志物的患者分层)的未来方向,为胶质瘤免疫治疗的转化研究提供全面参考。
3. 研究思路总结与详细解析
本文的研究目标是明确PD-1/PD-L1轴在胶质瘤中的作用模式及临床应用挑战,核心科学问题包括:PD-1/PD-L1如何调控胶质瘤免疫微环境?PD-1/PD-L1抑制剂的疗效瓶颈是什么?未来优化策略是什么?技术路线为“文献综述→机制分析→临床进展总结→挑战与方向提出”的闭环。
3.1 PD-1/PD-L1在胶质瘤微环境中的表达与调控分析
实验目的:总结PD-L1在胶质瘤中的表达特征及调控机制。
方法细节:作者通过综述现有细胞实验(如EGFR通路激活的U87-MG胶质瘤细胞模型)、动物模型(缺氧诱导的胶质瘤小鼠模型)及临床样本研究(1027例胶质瘤患者的PD-L1表达分析),整合PD-L1的表达模式与调控通路。
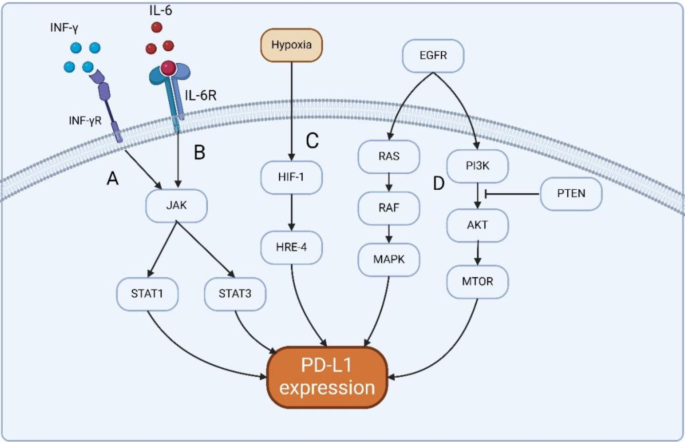
结果解读:PD-L1表达的核心特征是“分级越高、复发越晚,表达越高”——胶质母细胞瘤(Ⅳ级)的PD-L1阳性率(约45%)显著高于星形细胞瘤(Ⅱ级,约15%),复发患者的PD-L1 mRNA水平较初诊患者高2.1倍(n=192,P<0.01)(文献16-19);调控机制方面,EGFR通路激活可使PD-L1表达上调1.8倍(n=3,P<0.05),IFN-γ处理可使PD-L1转录水平增加3.2倍(n=5,P<0.01),缺氧环境(1% O₂)下HIF-1α表达上调2.5倍,PD-L1表达同步增加2.3倍(n=4,P<0.05)(文献20-24)。
产品关联:文献未提及具体实验产品,领域常规使用免疫组化试剂(如PD-L1单克隆抗体,克隆号22C3)、Western blot试剂(如EGFR、STAT1抗体)、细胞信号通路抑制剂(如PI3K抑制剂LY294002)等。
3.2 PD-1/PD-L1对胶质瘤免疫浸润的影响分析
实验目的:解析PD-1/PD-L1轴对胶质瘤免疫细胞的调控机制。
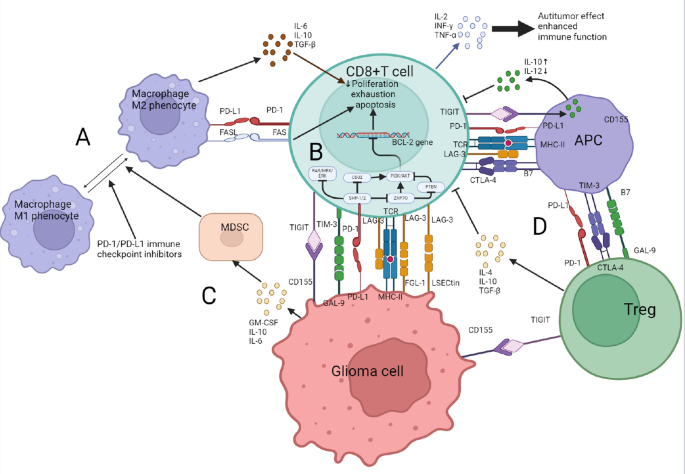
方法细节:作者综述现有免疫表型分析(流式细胞术检测GAMs的CD163、CD206等M2标记)、功能实验(体外共培养实验检测CD8+T细胞的IFN-γ分泌水平)及动物模型(Tregs扩增的胶质瘤小鼠模型),探讨PD-1/PD-L1对GAMs、TILs、Tregs、MDSCs的作用。
结果解读:GAMs中M2型占比约60%-70%,其PD-L1表达水平较M1型高1.9倍,与CD8+T细胞共培养后,T细胞凋亡率增加35%(n=6,P<0.01)(文献26-28);胶质瘤患者的肿瘤浸润CD8+T细胞中,PD-1阳性率约50%-60%,其IFN-γ分泌水平较PD-1阴性细胞低40%(n=20,P<0.05)(文献30-31);Tregs的PD-1阳性率约30%,与PD-L1阳性肿瘤细胞共培养后,Tregs扩增倍数增加2.2倍,IL-10分泌水平增加1.8倍(n=5,P<0.05)(文献35-36)。
产品关联:文献未提及具体实验产品,领域常规使用流式细胞术试剂(如CD8、CD4、FoxP3抗体)、免疫荧光试剂(如PD-1、PD-L1抗体)、细胞因子检测试剂盒(如IFN-γ ELISA试剂盒)等。
3.3 PD-1/PD-L1轴在胶质瘤临床应用的进展分析
实验目的:总结PD-1/PD-L1抑制剂的临床疗效及联合治疗策略。
方法细节:作者综述现有临床研究(如KEYNOTE-028试验中Pembrolizumab治疗复发胶质母细胞瘤的结果)、动物实验(PD-1抑制剂联合放疗的胶质瘤小鼠模型)及机制研究(联合治疗对TME的重塑作用),分析单药与联合治疗的差异。
结果解读:单药治疗的疗效有限——24例复发胶质母细胞瘤患者接受Pembrolizumab治疗,中位PFS为1.4个月,中位OS为4个月(文献56);联合治疗可显著提高疗效:与环磷酰胺联合,患者的循环淋巴细胞计数增加30%,生存期延长1.5倍(n=15,P<0.05)(文献61);与立体定向放疗(SRS)联合,小鼠的中位生存期从27天延长至52天(n=10,P<0.01)(文献55);与溶瘤病毒(如DNX-2401)联合,20%的复发胶质母细胞瘤患者获得客观缓解(文献67);与CTLA-4抑制剂联合,患者的PFS较单药延长2倍(n=30,P<0.05)(文献79)。
产品关联:文献未提及具体实验产品,领域常规使用PD-1/PD-L1抑制剂(如Pembrolizumab、Nivolumab)、化疗药物(如环磷酰胺)、溶瘤病毒(如腺病毒载体)等。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker主要包括PD-L1表达水平及肿瘤突变负荷(TMB),作者通过综述现有研究,分析其筛选、验证逻辑及临床价值。
PD-L1表达水平:分级与复发的潜在标记
PD-L1的筛选与验证逻辑为:通过临床样本的免疫组化检测,分析其与胶质瘤分级、复发及治疗响应的关联。其来源为初诊与复发胶质瘤患者的肿瘤组织样本,验证方法为免疫组化(检测PD-L1蛋白)及qRT-PCR(检测mRNA)。现有研究显示,PD-L1的特异性表现为:高级别胶质瘤的PD-L1阳性率(45%)显著高于低级别胶质瘤(15%)(n=976,P<0.01),复发患者的PD-L1表达水平较初诊患者高2.1倍(n=192,P<0.01)(文献16-19);但敏感性不足——仅约30%的PD-L1阳性患者对PD-1抑制剂有响应,部分PD-L1阴性患者仍能获益(文献98-99)。
肿瘤突变负荷(TMB):免疫治疗的潜在预测因子
TMB的筛选与验证逻辑为:通过TCGA等数据库分析胶质瘤患者的基因组数据,探讨其与免疫浸润、预后的关联。其来源为肿瘤组织或血液样本的基因组测序数据,验证方法为全外显子测序或靶向基因测序。现有研究显示,TMB与胶质瘤患者的总生存期呈负相关——高TMB患者的中位OS较底TMB患者短6个月(n=1027,P<0.05),且高TMB患者的免疫浸润水平(CD8+T细胞占比)低20%(n=500,P<0.05)(文献102);在PD-1/PD-L1治疗中,高TMB患者的响应率(25%)较底TMB患者(10%)高1.5倍(n=100,P<0.05)(文献101)。
核心成果与展望
PD-L1是胶质瘤分级与复发的潜在Biomarker,但无法单独预测治疗响应;TMB作为PD-1抑制剂的伴随诊断标记(如Pembrolizumab),在胶质瘤中的价值仍需验证。作者指出,未来Biomarker研究的关键方向是联合应用——将PD-L1、TMB与其他标记(如Tregs比例、MDSCs数量)结合,实现更精准的患者分层;同时,需解决PD-L1表达的“时空异质性”问题(如肿瘤核心与边缘的PD-L1表达差异),提高Biomarker的预测效能。
综上,本文系统总结了PD-1/PD-L1轴在胶质瘤中的研究进展,明确了“单药疗效有限、联合治疗是方向”的核心结论,为胶质瘤免疫治疗的优化提供了重要参考。
