1. 领域背景与文献引入
文献英文标题:Copper chelation suppresses epithelial-mesenchymal transition by inhibition of canonical and non-canonical TGF-β signaling pathways in cancer;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:癌症转移与铜代谢调控。
上皮-间质转化(EMT)是癌症转移的关键步骤,转移性癌细胞通过EMT获得迁移、侵袭能力及治疗抵抗。转化生长因子-β(TGF-β)是EMT的核心调控因子,通过经典(SMAD2/3)和非经典(PI3K/AKT、ERK1/2)信号通路驱动EMT。然而,直接靶向TGF-β的药物因严重副作用(如心脏瓣膜损伤)在临床试验中失败,亟需低毒替代方案。同时,铜代谢异常与癌症进展密切相关:肿瘤细胞铜水平升高,促进血管生成和转移;铜螯合剂(如四乙烯五胺TEPA)用于治疗Wilson病(铜代谢障碍),近年发现其抑制肿瘤生长,但分子机制不明,尤其是如何抑制转移,这是临床转化的主要障碍。
本研究假设铜螯合通过降低TGF-β水平、抑制TGF-β/EMT轴抑制癌症转移,旨在揭示铜螯合剂的分子机制,为其作为靶向TGF-β/EMT轴的低毒治疗方案提供依据。
2. 文献综述解析
作者围绕“EMT与癌症转移”“TGF-β信号通路的调控”“铜代谢异常与癌症”“铜螯合剂的研究现状”四大维度展开综述,系统梳理现有研究的关键结论、优势与局限性,突出本研究的创新价值。
现有研究显示:EMT促进癌症转移,TGF-β是EMT的核心调控因子;铜水平升高促进癌症进展,铜螯合剂抑制肿瘤生长;铜螯合剂已用于临床(Wilson病),安全性高,但抑制转移的分子机制不明,尤其是与TGF-β/EMT的关系。本研究的创新点在于首次揭示铜螯合剂通过抑制经典与非经典TGF-β信号通路抑制EMT,为铜螯合剂的临床转化提供分子机制;相比直接靶向TGF-β,铜螯合是低毒替代方案。
3. 研究思路总结与详细解析
本研究以“铜螯合→抑制TGF-β信号→抑制EMT→减少转移”为核心逻辑,采用“细胞实验-动物模型-机制验证”的闭环设计,从转录组、蛋白水平、动物表型多层面验证假设。
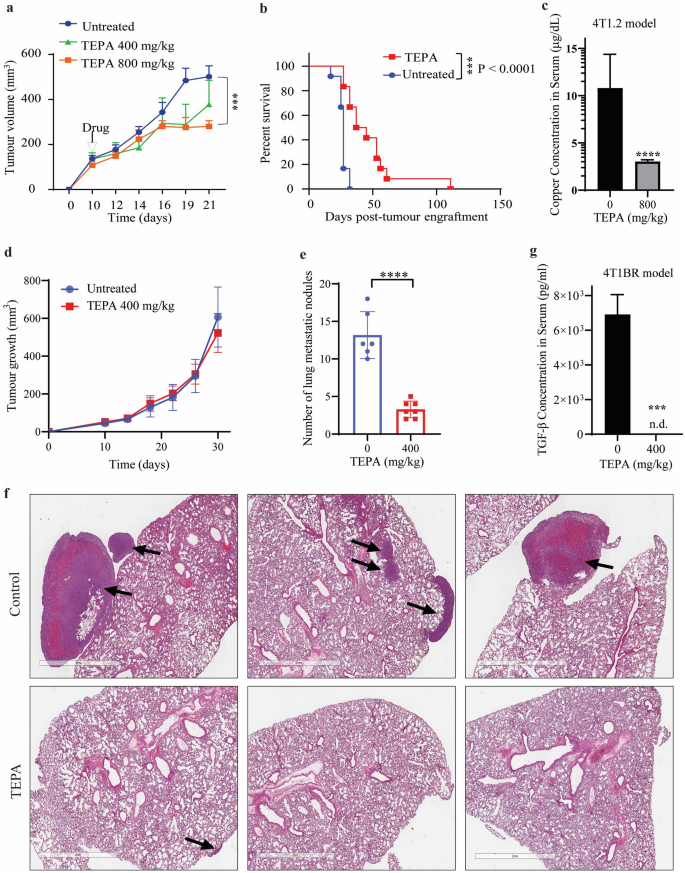
3.1 铜螯合剂TEPA对TNBC小鼠模型肿瘤生长与转移的影响
实验目的:验证TEPA在体内对三阴性乳腺癌(TNBC)肿瘤生长、转移及TGF-β水平的作用。
方法细节:使用4T1.2(自发转移)和4T1BR(肺转移)小鼠模型,TEPA剂量为400/800 mg/kg口服,治疗21天;测量肿瘤体积、生存时间、肺转移结节数(H&E染色)、血清铜(电感耦合等离子体质谱)和TGF-β水平(ELISA)。
结果解读:800 mg/kg TEPA显著抑制4T1.2肿瘤生长(与对照组相比,p<0.001),延长生存(中位生存从27天至41天,n=6,p=0.0002),降低血清铜水平(p<0.05);400 mg/kg TEPA不影响4T1BR原发肿瘤,但显著减少肺转移结节数(对照组vs TEPA组,n=6,p<0.001),降低血清TGF-β水平(p<0.05)。
产品关联:实验所用关键产品:Invitrogen的murine TGF-β ELISA kit(货号BMA608-4)、Emgrid Australia的4%多聚甲醛(货号15710)。
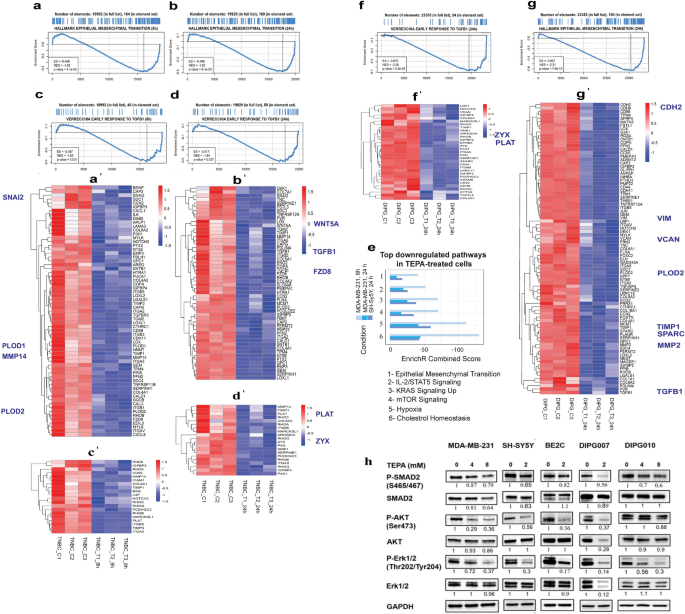
3.2 铜螯合对癌症细胞EMT相关基因与信号通路的调控
实验目的:探究TEPA在细胞水平对EMT基因、TGF-β信号通路的影响。
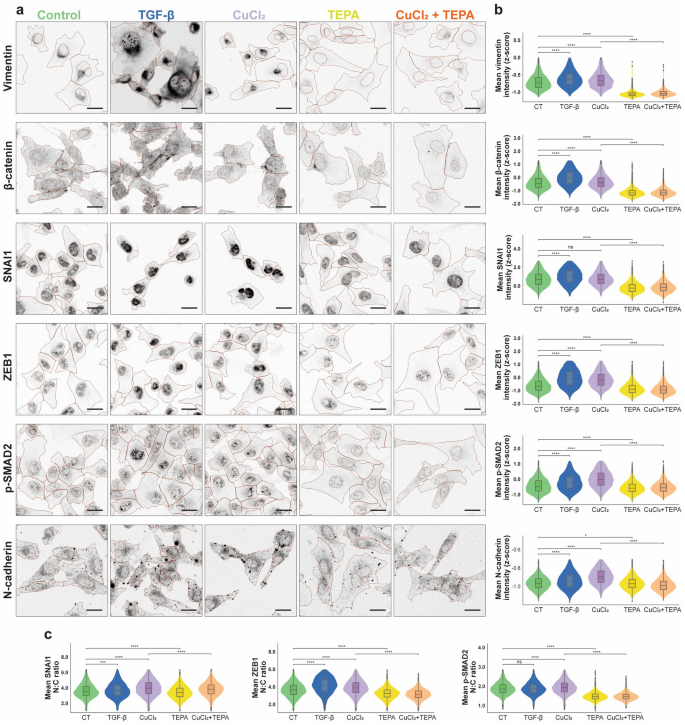
方法细节:对MDA-MB-231(TNBC)、SH-SY5Y(神经母细胞瘤)、DIPG010(弥漫性内生性桥脑胶质瘤)细胞用TEPA处理(MDA-MB-231/DIPG010:4/8 mM,24 h;SH-SY5Y:2 mM,24 h);进行RNA-seq(Illumina NovaSeq 6000)、Western blot(检测SMAD2、p-SMAD2、AKT、p-AKT、ERK1/2、p-ERK1/2、MMP-9、Vimentin)、免疫荧光染色(检测ZEB1、p-SMAD2、β-catenin的核定位)。
结果解读:RNA-seq显示,TEPA处理后EMT相关基因(如MMP-9、Vimentin、ZEB1)下调,上皮marker E-cadherin上调,TGF-β信号通路基因(如TGFBR2、SNAI2)下调;Western blot显示,TEPA降低SMAD2、AKT、ERK1/2的磷酸化水平,下调MMP-9、Vimentin蛋白表达;免疫荧光显示,TEPA处理后ZEB1、p-SMAD2从核转移至细胞质,抑制其转录活性。
产品关联:实验所用关键产品:Qiagen的RNEasy RNA提取试剂盒(货号74104)、Cell Signaling的SMAD2抗体(货号3122)、AKT抗体(货号9272)。
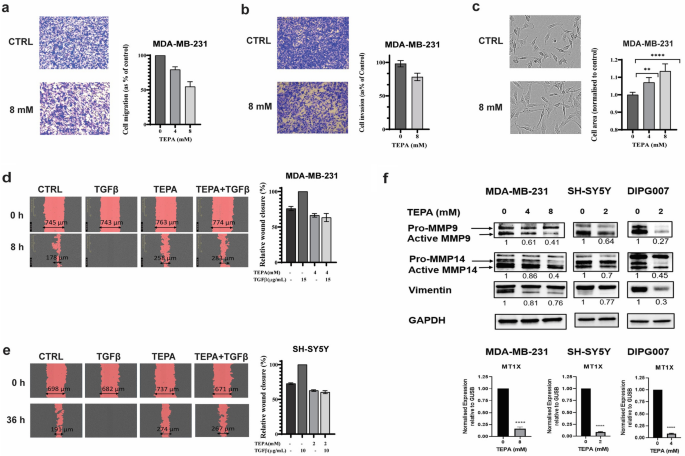
3.3 铜螯合对癌症细胞迁移与侵袭的抑制作用
实验目的:验证TEPA对EMT介导的细胞迁移、侵袭的抑制作用。
方法细节:①Transwell迁移/侵袭实验:MDA-MB-231细胞用TEPA处理(0/4/8 mM,24 h),接种于Transwell小室,测量迁移/侵袭细胞数;②划痕实验:MDA-MB-231(4 mM TEPA)、SH-SY5Y(2 mM TEPA)预处理2 h,加入TGF-β(15 ng/ml for MDA-MB-231,10 ng/ml for SH-SY5Y),IncuCyte S3监测伤口愈合率。
结果解读:8 mM TEPA显著抑制MDA-MB-231迁移(降低45%,n=3,p<0.001)和侵袭(p<0.0001);TEPA预处理后,TGF-β诱导的伤口愈合率显著降低(MDA-MB-231:14 h愈合率从60%降至20%,p<0.0001;SH-SY5Y:36 h愈合率从70%降至30%,p<0.0001)。
产品关联:实验所用关键产品:Corning的Costar Transwell小室(货号3422)、Satorious的IncuCyte S3活细胞成像系统。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker包括“血清TGF-β”(转移相关)、“EMT分子(MMP-9、Vimentin、p-SMAD2)”(EMT状态)、“MT1X”(细胞内铜水平),通过“细胞实验-动物模型-机制验证”的逻辑链筛选与验证,揭示其与铜螯合、转移的关联。
Biomarker定位与研究过程
- 血清TGF-β:转移预测Biomarker,来自4T1BR小鼠血清,用ELISA检测,TEPA处理后水平显著降低(n=6,p<0.05),与肺转移结节数减少显著相关。
- EMT分子:EMT状态Biomarker,MDA-MB-231、SH-SY5Y、DIPG010细胞用Western blot检测,TEPA处理后MMP-9、Vimentin、p-SMAD2水平下调(n=3,p<0.001),提示EMT抑制。
- MT1X:细胞内铜水平Biomarker,用qPCR检测,TEPA处理后MDA-MB-231(p<0.0001)、SH-SY5Y(p<0.001)、DIPG007(p<0.01)中表达显著下调,反映细胞内铜水平降低。
核心成果提炼
①血清TGF-β是转移相关Biomarker:其水平降低与肺转移抑制直接相关,可作为铜螯合剂疗效的无创监测指标;②EMT分子是EMT状态Biomarker:其下调提示铜螯合对EMT的抑制作用;③MT1X是细胞内铜水平Biomarker:其表达与铜螯合效果一致,可用于监测细胞内铜代谢状态。创新性在于首次将铜螯合与TGF-β/EMT轴的Biomarker关联,为铜螯合剂的临床疗效监测提供潜在指标,解决了铜螯合剂机制不明的关键问题。
