1. 领域背景与文献引入
文献英文标题:Antibody engineering improves neutralization activity against K417 spike mutant SARS-CoV-2 variants;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:冠状病毒感染与中和抗体工程。
2019年底爆发的新型冠状病毒肺炎(COVID-19)由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起,已在全球范围内造成超7亿人次感染、690余万人死亡(WHO,2024)。中和抗体作为靶向SARS-CoV-2刺突蛋白(S蛋白)受体结合域(RBD)的特效治疗手段,通过阻断病毒与宿主细胞表面血管紧张素转换酶2(ACE2)的结合,有效降低患者住院率和死亡率,多款抗体(如bamlanivimab、casirivimab)已获紧急使用授权(EUA)。然而,SARS-CoV-2的快速进化产生了多个关切变异株(VOCs),如B.1.351(南非株)、P.1(巴西株)等,其RBD区域携带K417N/T突变——这一突变直接破坏了部分中和抗体与RBD的关键相互作用,导致现有抗体对变异株的中和活性显著降低甚至完全失效(如REGN10933对P.1的中和活性下降80%)。因此,开发针对K417突变株的新型中和抗体或通过工程改造增强现有抗体的活性,成为应对变异株威胁的关键需求。
本文针对这一挑战,从COVID-19康复患者外周血单核细胞(PBMC)中筛选到高亲和力中和抗体R3P1-E4,通过结构生物学解析其与RBD的相互作用机制,并利用虚拟突变技术改造获得对K417突变株中和活性增强的工程化抗体,为变异株的治疗提供了新策略。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“中和抗体的作用机制-变异株的挑战-现有技术的应用与局限”展开:
1. 中和抗体的作用与局限:现有中和抗体多靶向RBD的受体结合基序(RBM),但变异株的RBD突变(如K417N/T、E484K)可通过改变RBD构象或直接破坏抗体结合位点,导致抗体失效;
2. 抗体筛选方法:噬菌体展示技术可从患者PBMC中快速构建scFv文库,筛选高亲和力抗体,避免杂交瘤技术的低效率问题;
3. 结构生物学的价值:解析抗体与RBD的共晶结构,可明确关键相互作用位点,为抗体工程改造提供理论依据,但现有研究缺乏针对K417突变的精准改造策略。
现有研究的核心局限在于:部分筛选的抗体对变异株无效,且缺乏针对K417突变的工程化解决方案。本文的创新点在于整合噬菌体展示筛选、结构解析与虚拟突变技术,针对K417突变株开发了高效工程化抗体,填补了这一研究空白。
3. 研究思路总结与详细解析
本文的研究思路遵循“抗体筛选-功能表征-体内验证-变异株测试-结构解析-工程改造”的闭环逻辑,具体实验环节如下:
3.1 抗SARS-CoV-2 RBD抗体的筛选与亲和力验证
实验目的:从COVID-19患者PBMC中筛选高亲和力的RBD结合抗体。
方法细节:构建患者scFv噬菌体展示文库(将VH和VL基因通过linker连接,克隆到M13噬菌体载体),用纯化的WT RBD蛋白进行4轮生物淘洗;通过ELISA验证抗体结合活性,表面等离子体共振(SPR)测定亲和力(使用BIAcore T200系统)。
结果解读:筛选到6个高亲和力抗体,其中R3P1-E4的结合解离常数(Kd)最低(0.82 nM),与阳性对照S309(Kd=1.99 nM)相当,表明其对RBD具有强亲和力。
产品关联:实验所用关键产品包括Roche的Ni-TED beads(纯化scFv)、GE Healthcare的Superdex S75层析柱(蛋白纯化)、ThermoFisher Scientific的EDC/NHS活化试剂(SPR芯片活化);抗体CB6、REGN10933由AtaGenix Laboratories表达纯化。
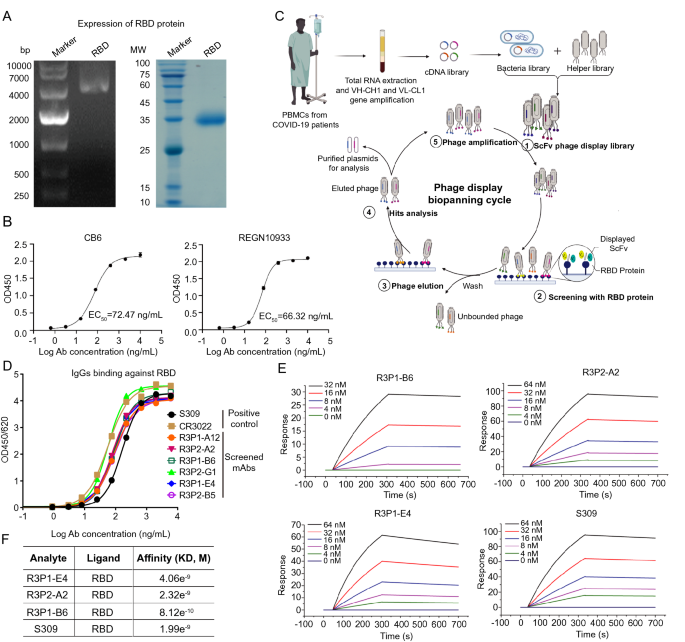
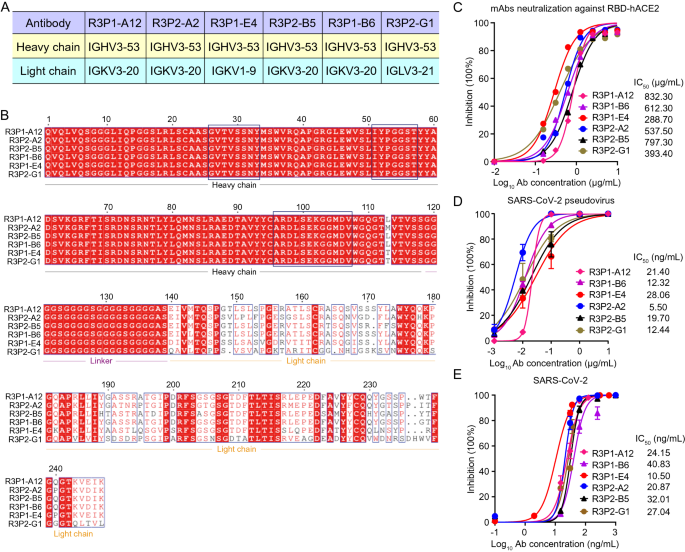
3.2 抗体的序列分析与中和活性表征
实验目的:分析抗体序列特征,验证其中和SARS-CoV-2的功能。
方法细节:测序抗体scFv区域,通过IMGT/V-Quest分析免疫球蛋白基因片段使用情况;采用竞争ELISA检测抗体与hACE2竞争结合RBD的能力;用HIV-based假病毒(表达WT S蛋白)和活病毒(SARS-CoV-2 WT株)感染hACE2-293T细胞,通过荧光素酶报告基因或qRT-PCR检测中和活性。
结果解读:6个抗体共享IGHV3-53重链片段(与已知中和抗体P4A1、B38一致),轻链来自IGKV3-20、IGKV1-9等片段;R3P1-E4可剂量依赖性抑制hACE2与RBD的结合(抑制率达90%,n=3,P<0.01),对假病毒的中和半数抑制浓度(IC50)最低(0.1 ng/ml),对活病毒的IC50为0.5 ng/ml(n=3,P<0.01)。
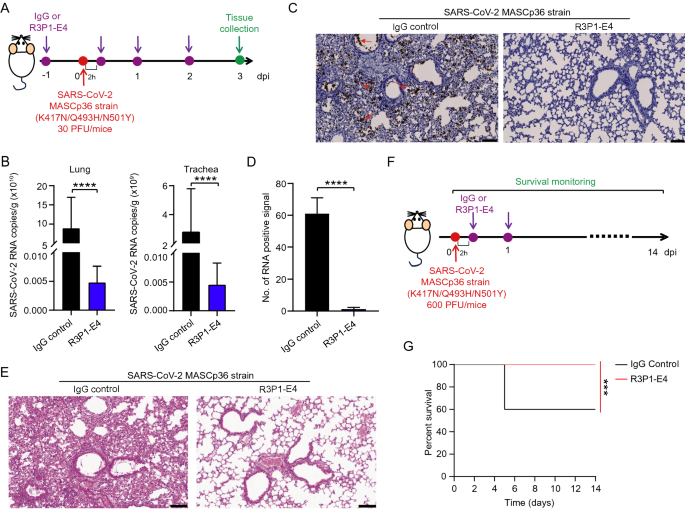
3.3 R3P1-E4的体内抗病毒效果验证
实验目的:验证R3P1-E4在体内对SARS-CoV-2的抑制作用。
方法细节:用小鼠适应株MASCp36感染8月龄Balb/c小鼠(30 PFU/只),腹腔注射R3P1-E4(25 mg/kg)或IgG对照;3天 post感染(dpi)收集肺和气管组织,通过qRT-PCR、RNA scope检测病毒载量;用H&E染色评估肺损伤;另设致死剂量组(600 PFU/只),观察14 dpi的生存率。
结果解读:R3P1-E4处理组的肺病毒载量较对照组降低90%(n=5,P<0.0001),气管病毒载量降低85%(n=5,P<0.0001);肺组织病理损伤减轻(肺泡渗出减少、炎症细胞浸润减少);致死剂量感染时,R3P1-E4组100%存活,对照组仅60%存活(n=5,P<0.05)。
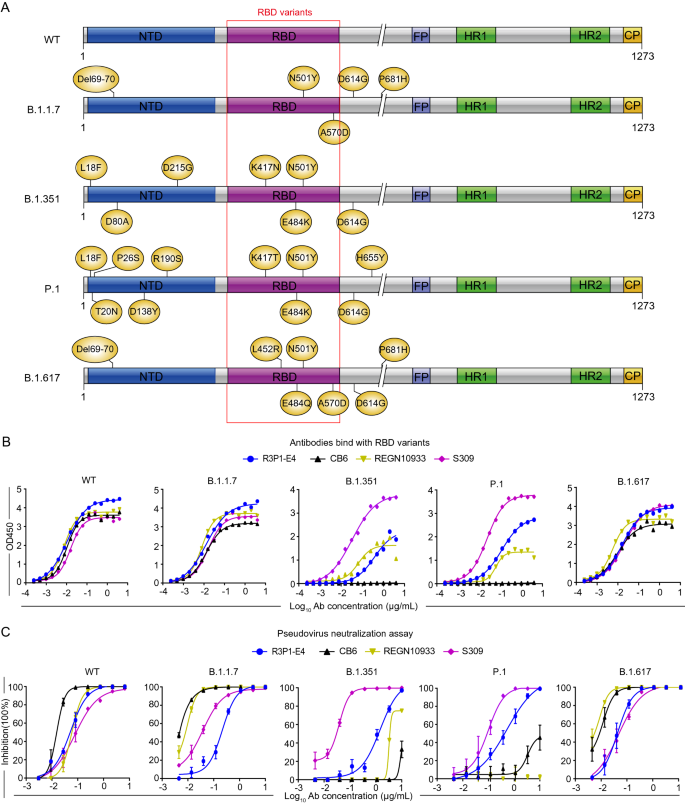
3.4 R3P1-E4对SARS-CoV-2变异株的活性评估
实验目的:测试R3P1-E4对不同变异株的结合与中和活性。
方法细节:表达并纯化B.1.1.7、B.1.351、P.1、B.1.617变异株的RBD蛋白;通过ELISA检测R3P1-E4的结合亲和力;用表达变异株S蛋白的假病毒感染hACE2-293T细胞,检测中和活性。
结果解读:R3P1-E4对WT RBD的EC50为0.5 nM,但对B.1.351和P.1 RBD的EC50升至5 nM(n=3,P<0.05);假病毒中和实验显示,R3P1-E4对B.1.351的IC50从WT的0.1 ng/ml升至10 ng/ml(n=3,P<0.05),对P.1的IC50升至8 ng/ml(n=3,P<0.05),而对B.1.1.7和B.1.617的活性影响较小(IC50分别为0.2 ng/ml和0.3 ng/ml)。
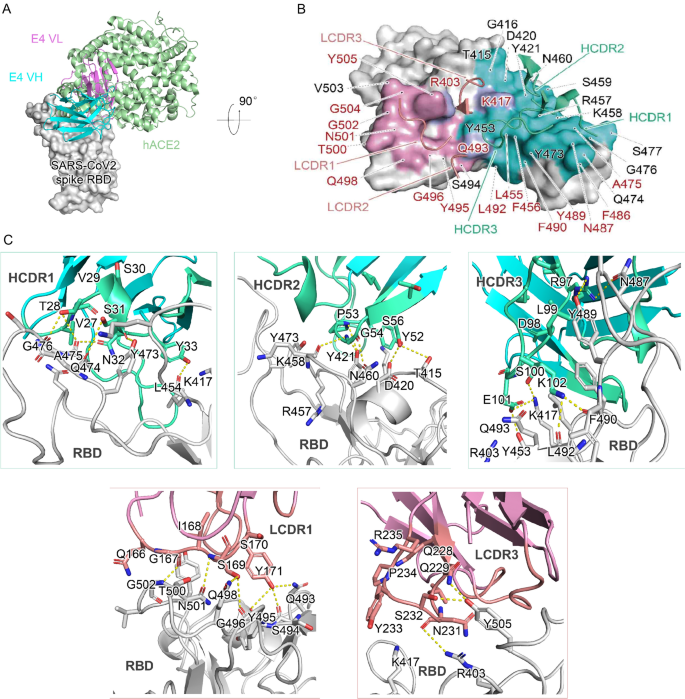
3.5 R3P1-E4与RBD复合物的结构解析
实验目的:揭示R3P1-E4与RBD的相互作用机制,解释K417突变的影响。
方法细节:将R3P1-E4 scFv与RBD按1.5:1摩尔比混合,通过Superdex S75层析柱纯化复合物;采用悬滴vapor-diffusion法结晶(母液:20% PEG3350、0.2 M柠檬酸钾);在上海同步辐射设施BL17U1线站收集X射线衍射数据(波长0.979 Å),用分子置换法解析结构(PDB ID: 7VMU)。
结果解读:复合物结构分辨率为2.9 Å,显示R3P1-E4的重链(HCDR1、HCDR2)和轻链(LCDR1、LCDR3)均与RBD的RBM区域结合,结合位点与hACE2高度重叠(重叠率达80%);关键相互作用包括重链Y33与RBD K417的氢键、重链E101与RBD K417的静电相互作用——K417N/T突变会破坏这些相互作用,导致抗体结合亲和力降低。
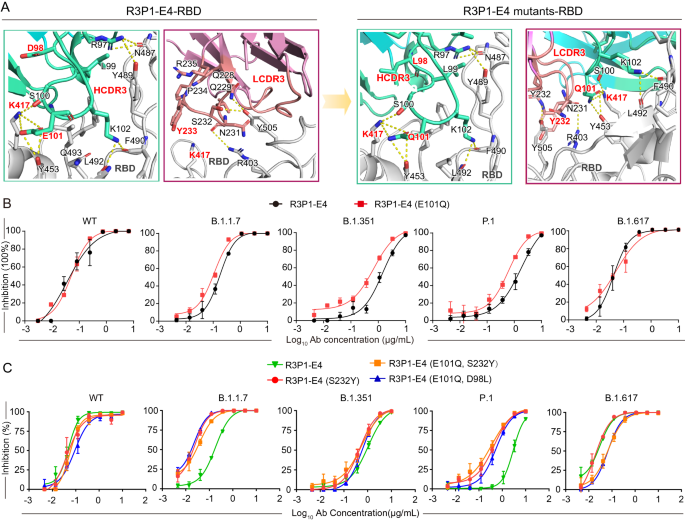
3.6 工程化抗体的构建与活性验证
实验目的:通过突变改造提高R3P1-E4对K417突变株的中和活性。
方法细节:用AbRSA工具识别R3P1-E4的CDR区;对CDR区 residues进行虚拟突变(19种氨基酸替换),用EvoEF2评分筛选潜在突变体;构建E101Q(重链HCDR2)等突变体,表达纯化后用假病毒中和实验验证活性。
结果解读:虚拟突变预测E101Q可增加与K417N/T RBD的氢键相互作用;功能验证显示,E101Q突变体对B.1.351的IC50从10 ng/ml降至2 ng/ml(n=3,P<0.01),对P.1的IC50降至1.5 ng/ml(n=3,P<0.01),对B.1.1.7的IC50也从0.2 ng/ml降至0.1 ng/ml(n=3,P<0.05)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本文涉及两类关键Biomarker:
1. 治疗性生物标志物:中和抗体R3P1-E4及其工程化突变体(如E101Q)——作为针对SARS-CoV-2 WT和K417突变株的治疗靶点;
2. 耐药性生物标志物:RBD的K417位点突变(N/T)——作为预测抗体疗效的分子标志物。
筛选与验证逻辑:
- 治疗性Biomarker:通过“噬菌体文库筛选→ELISA/SPR验证结合活性→假病毒/活病毒中和实验验证功能→体内实验验证疗效”的流程;
- 耐药性Biomarker:通过“结构解析明确K417与抗体的关键相互作用→结合实验验证突变对亲和力的影响→中和实验验证突变对疗效的影响”的流程。
4.2 研究过程详述
治疗性Biomarker(R3P1-E4及其突变体):
- 来源:COVID-19康复患者PBMC构建的噬菌体文库;
- 验证方法:ELISA(结合活性)、SPR(亲和力)、假病毒/活病毒中和实验(功能)、体内实验(疗效);
- 特异性与敏感性:R3P1-E4对WT的中和IC50为0.1 ng/ml(n=3,P<0.01),对B.1.351的IC50为10 ng/ml(n=3,P<0.05);工程化突变体E101Q对B.1.351的IC50降至2 ng/ml(n=3,P<0.01)。
耐药性Biomarker(K417突变):
- 来源:SARS-CoV-2变异株的RBD区域;
- 验证方法:结构分析(K417与抗体的相互作用)、ELISA(突变对结合亲和力的影响)、中和实验(突变对疗效的影响);
- 特异性与敏感性:K417N/T突变使R3P1-E4的结合亲和力降低10倍(EC50从0.5 nM升至5 nM,n=3,P<0.05),中和活性降低100倍(IC50从0.1 ng/ml升至10 ng/ml,n=3,P<0.05)。
4.3 核心成果提炼
- 治疗性Biomarker:R3P1-E4是一种高效中和抗体,可抑制WT和部分变异株感染;工程化突变体E101Q显著提高了对K417突变株的中和活性(IC50降低5倍);
- 耐药性Biomarker:K417位点突变是导致抗体耐药的关键因素,可作为预测抗体疗效的分子标志物;
- 创新性:首次通过“结构解析+虚拟突变”策略,针对K417突变株开发了工程化抗体,为变异株的治疗提供了新方案。
综上,本文通过整合噬菌体展示、结构生物学与抗体工程技术,解决了现有中和抗体对K417突变株无效的问题,为COVID-19变异株的治疗提供了重要的理论与技术支撑。
