1. 领域背景与文献引入
文献英文标题:Cellular prostatic acid phosphatase (cPAcP) serves as a useful biomarker of histone deacetylase (HDAC) inhibitors in prostate cancer cell growth suppression;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:前列腺癌精准治疗与生物标志物研究。
前列腺癌是美国最常见的实体瘤及第二大癌症致死原因,在中国的发病率也呈快速上升趋势,已成为国内主要癌症相关死因之一。领域共识:雄激素剥夺治疗(ADT)是转移性前列腺癌的一线标准治疗方案,但多数患者最终会进展为去势抵抗性前列腺癌(CRPC),此时ADT失效,且缺乏有效的治疗响应预测标志物。组蛋白去乙酰化酶(HDAC)抑制剂作为表观遗传治疗药物,已被证实可抑制肿瘤细胞增殖、诱导分化,在前列腺癌治疗中展现出潜力,但目前仍缺乏能筛选HDAC抑制剂敏感患者的特异性生物标志物,导致治疗精准性不足、医疗资源浪费。针对这一研究空白,本研究聚焦细胞型前列腺酸性磷酸酶(cPAcP),验证其作为HDAC抑制剂治疗前列腺癌的生物标志物价值,为CRPC的精准治疗提供新的靶点与预测工具。
2. 文献综述解析
作者对领域内现有研究的分类维度主要分为三个方向:前列腺癌治疗的演进路径(ADT到CRPC的治疗困境)、HDAC抑制剂的作用机制与临床研究现状、cPAcP的生物学功能与前列腺癌的关联。
现有研究显示,ADT通过降低雄激素水平或阻断雄激素受体(AR)功能抑制前列腺癌生长,但无法阻止疾病向CRPC进展,且CRPC患者的治疗选择有限,缺乏有效的疗效预测指标;HDAC抑制剂可通过调控组蛋白及非组蛋白的乙酰化状态,抑制肿瘤细胞增殖,已有多项临床前研究证实其对前列腺癌的抑制作用,但尚未明确能区分敏感患者的生物标志物;cPAcP作为前列腺上皮特异性的肿瘤抑制因子,可通过去磷酸化ErbB-2调控雄激素敏感性,其表达缺失与前列腺癌发生发展相关,但此前未被关联到HDAC抑制剂的疗效预测中。现有研究的局限性在于,HDAC抑制剂的临床应用缺乏精准的患者分层策略,而cPAcP的功能研究未拓展到表观治疗的疗效预测领域。本研究的创新价值在于,首次明确cPAcP可作为HDAC抑制剂治疗前列腺癌的特异性生物标志物,尤其是在模拟临床ADT的低激素环境下,能有效区分对HDAC抑制剂敏感的细胞亚群,为CRPC的精准治疗提供了新的依据。
3. 研究思路总结与详细解析
本研究的核心科学问题是验证cPAcP是否可作为HDAC抑制剂抑制前列腺癌细胞生长的有效生物标志物,研究目标是明确cPAcP表达水平与HDAC抑制剂敏感性的关联,以及HDAC抑制剂对cPAcP表达和细胞雄激素响应性的调控作用,技术路线遵循“假设提出→细胞系基础表达分析→HDAC抑制剂处理后的功能验证→低激素环境下的敏感性验证→结论总结”的闭环逻辑。
3.1 前列腺癌细胞系基础蛋白表达检测
实验目的是明确不同前列腺癌细胞系中AR、cPAcP、前列腺特异性抗原(PSA)的基础表达水平,筛选出AR/cPAcP阳性与阴性的细胞模型用于后续实验。方法细节为选取LNCaP系列(C-33、C-81、C4-2、C4-2B)、MDA PCa2b系列(雄激素敏感型AS、雄激素非敏感型AI)、PC-3、DU145共10种前列腺癌细胞系,常规培养后提取总蛋白,采用免疫印迹(Western blot)技术检测目标蛋白表达,以β-肌动蛋白作为内参对照。结果解读显示,LNCaP C-33等6种细胞系为AR/cPAcP阳性,均表达AR、cPAcP和PSA,其中LNCaP C-33的AR表达水平最高,MDA PCa2b-AS的cPAcP基础表达水平显著高于其他细胞系;PC-3和DU145为AR/cPAcP阴性细胞系,不表达上述三种蛋白。
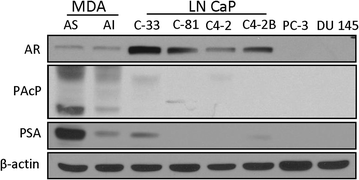
实验所用关键产品:免疫印迹相关试剂来自Bio-Rad、Pierce,一抗包括抗AR、抗PSA(Santa Cruz Biotechnology),兔抗人PAcP抗体(ATM-3,前期自制),抗β-肌动蛋白(Sigma)。
3.2 HDAC抑制剂对cPAcP表达及细胞生长的调控
实验目的是验证HDAC抑制剂对cPAcP表达的诱导作用,以及该变化与细胞生长抑制的关联。方法细节为选取LNCaP C-33、C4-2B、MDA PCa2b-AS细胞,用1mM丙戊酸(VPA,一种HDAC抑制剂)处理48小时,部分细胞后续加入10nM二氢睾酮(DHT)处理2天,通过细胞计数检测生长情况,免疫印迹检测cPAcP、PSA、AR的蛋白水平。结果解读显示,VPA处理后,LNCaP C-33和C4-2B的cPAcP蛋白水平显著升高(n=3×2,P<0.05),后续DHT处理则使cPAcP水平降低;MDA PCa2b-AS因基础cPAcP水平较高,仅出现轻微升高。细胞生长变化与cPAcP水平呈负相关:VPA处理后细胞生长抑制率显著提升,DHT处理后生长部分恢复(n=3×2,P<0.05)。
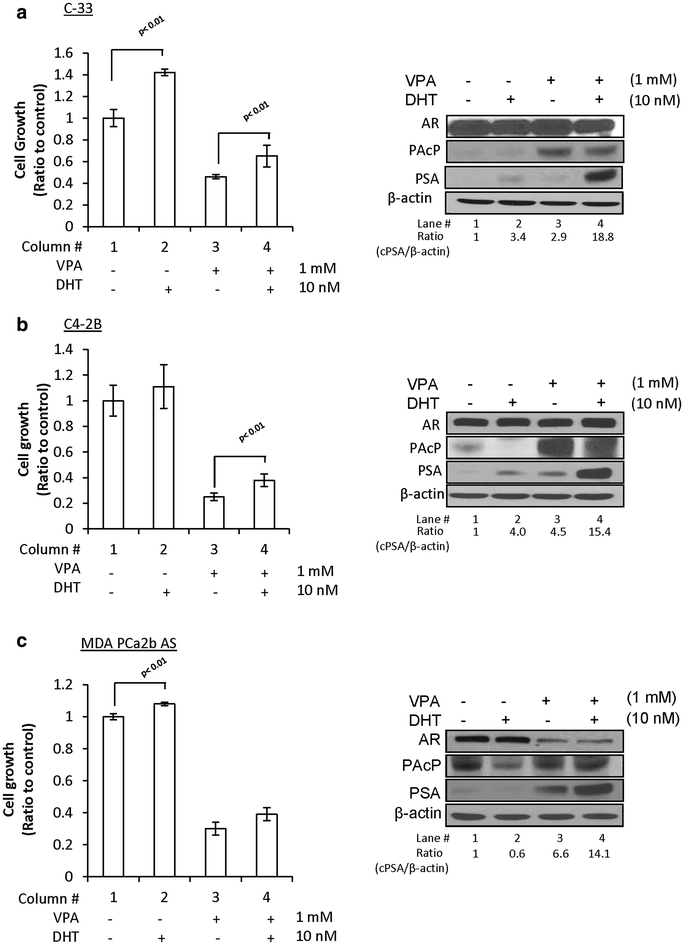
实验所用关键产品:VPA、DHT购自Sigma,细胞计数采用Nexcelom Bioscience的Cellometer Auto T4细胞计数仪。
3.3 多种HDAC抑制剂对雄激素响应性的影响
实验目的是验证不同类型HDAC抑制剂是否均能通过诱导cPAcP表达增强前列腺癌细胞的雄激素响应性。方法细节为选取具有CRPC特征的LNCaP C-81细胞,分别用丁酸钠(NaB)、SAHA、PxD101、MS-275、AR42五种HDAC抑制剂处理48小时,后续加入1nM或10nM DHT处理3天,通过细胞计数检测生长情况,免疫印迹检测cPAcP、PSA、AR的蛋白水平。结果解读显示,所有HDAC抑制剂均能显著诱导cPAcP的38kDa中间体和50kDa成熟体表达(n=3×2,P<0.05),且后续DHT处理会降低cPAcP水平;HDAC抑制剂预处理后,DHT诱导的PSA蛋白水平最高提升至对照组的12倍(n=3×2,P<0.05),但仅MS-275和AR42预处理组的细胞生长刺激作用显著增强。
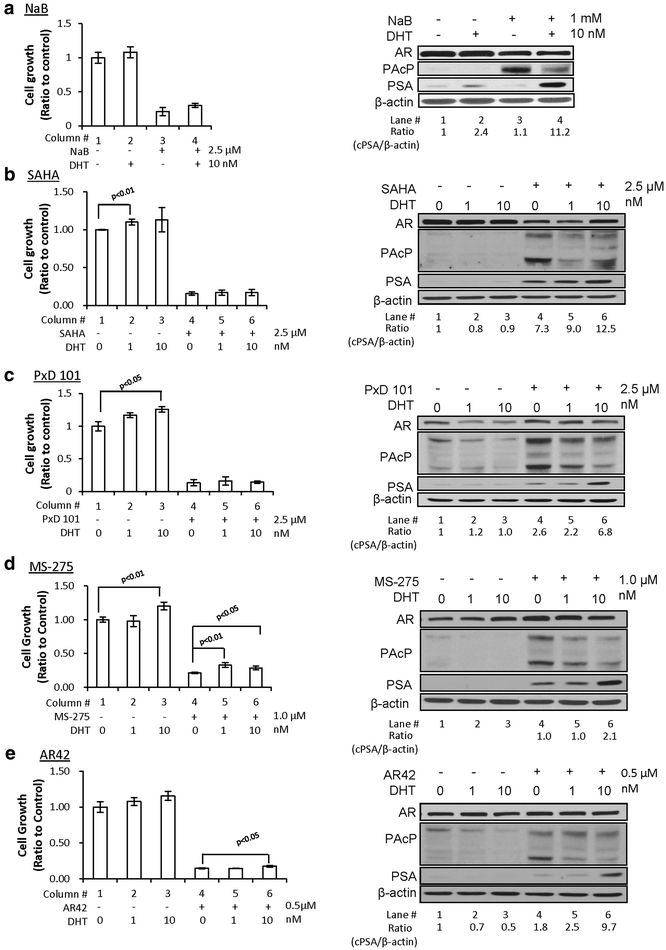
实验所用关键产品:NaB购自Sigma,SAHA、AR42、MS-275由俄亥俄州立大学Ching-Shih Chen博士惠赠,PxD101由内布拉斯加大学医学中心Jue Wang博士惠赠。
3.4 低激素环境下HDAC抑制剂的细胞敏感性验证
实验目的是模拟临床ADT的低激素环境,验证cPAcP表达水平与HDAC抑制剂敏感性的关联。方法细节为选取6种AR/cPAcP阳性细胞系和4种阴性细胞系(包括2种神经内分泌前列腺癌细胞系NE1-3、NE1-8),用1mM VPA处理48小时后,在类固醇减少培养基中培养3天,通过细胞计数检测生长抑制率。结果解读显示,AR/cPAcP阳性细胞系的生长抑制率均超过50%(n=3×2,P<0.05),而AR/cPAcP阴性细胞系的生长抑制率均低于50%,证明cPAcP表达水平与HDAC抑制剂的生长抑制效率正相关。
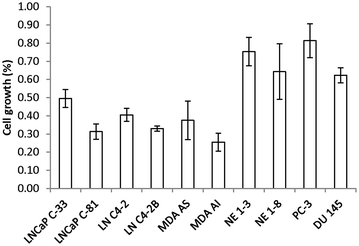
实验所用关键产品:类固醇减少胎牛血清购自Atlanta Biologicals。
4. Biomarker研究及发现成果
本研究发现的核心生物标志物为细胞型前列腺酸性磷酸酶(cPAcP),属于细胞内蛋白类生物标志物,其筛选逻辑基于前期研究发现cPAcP是HDAC抑制剂的作用靶点,本研究通过多细胞系实验验证其作为HDAC抑制剂疗效预测标志物的价值,验证逻辑为“基础表达分层→HDAC抑制剂处理后的表达调控→低激素环境下的敏感性关联”的完整链条。
该Biomarker的来源为前列腺癌细胞内的蛋白组分,验证方法包括免疫印迹技术检测蛋白表达水平,细胞计数法检测HDAC抑制剂处理后的生长抑制率。在模拟临床ADT的类固醇减少环境下,AR/cPAcP阳性细胞系对VPA的生长抑制率超过50%(n=3×2,P<0.05),而阴性细胞系的抑制率低于50%;HDAC抑制剂预处理后,DHT诱导的PSA蛋白水平最高提升至对照组的12倍,这一变化与cPAcP的诱导表达直接相关。
核心成果方面,cPAcP可作为HDAC抑制剂治疗前列腺癌的有效生物标志物,尤其是在低激素环境下,能精准区分对HDAC抑制剂敏感的患者亚群,为CRPC的精准治疗提供了新的患者分层策略;首次明确cPAcP的表达水平与HDAC抑制剂的生长抑制效率正相关,HDAC抑制剂可通过诱导cPAcP表达增强前列腺癌细胞的雄激素响应性,这为HDAC抑制剂与ADT的联合治疗提供了理论依据;此外,研究还发现血清PSA无法作为HDAC抑制剂的疗效预测标志物,而cPAcP作为细胞内蛋白,可通过活检样本检测实现患者分层,具有重要的临床转化价值。
