1. 领域背景与文献引入
文献英文标题:Anticancer bioactive peptide-3 inhibits human gastric cancer growth by targeting miR-338-5p;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:胃癌干细胞靶向治疗、肿瘤miRNA调控机制
胃癌是全球范围内威胁人类健康的高发恶性肿瘤,东亚地区新发病例占全球总量的60%以上,中国自2010年起癌症已成为居民首要死因,胃癌是其中最主要的恶性肿瘤类型之一。领域共识:癌症干细胞(CSCs)被认为是肿瘤复发、转移及耐药性产生的核心根源,胃癌干细胞(GCSCs)因具有自我更新能力、放化疗抗性等特性,导致现有治疗手段难以彻底清除肿瘤细胞,患者5年生存率始终未得到显著提升,因此靶向GCSCs的新型治疗策略成为当前胃癌研究的核心热点方向。
天然抗肿瘤药物因低毒性、高抗肿瘤活性的特点受到广泛关注,前期研究已证实抗癌活性肽-3(ACBP-3)可诱导GCSCs凋亡并降低其致瘤性,但具体分子调控机制尚未明确。MicroRNA(miRNA)作为非编码RNA分子,在肿瘤干细胞的增殖、凋亡及耐药性调控中发挥关键作用,可作为潜在的治疗靶点与生物标志物。本研究针对ACBP-3调控GCSCs的分子机制空白,通过miRNA芯片筛选结合功能验证,明确了miR-338-5p在ACBP-3抑制GCSCs过程中的核心作用,为天然药物联合化疗的胃癌干细胞靶向治疗提供了新的理论依据与靶点。
2. 文献综述解析
作者围绕胃癌临床诊疗现状、癌症干细胞的病理作用、天然抗肿瘤药物的应用价值、miRNA的基因调控功能四个核心维度展开综述,系统梳理了领域内现有研究的进展与不足。
现有临床研究显示,胃癌发病率与死亡率居高不下,现有放化疗手段对GCSCs的清除效果有限,导致患者5年生存率难以提升;癌症干细胞相关研究证实,GCSCs是胃癌复发、转移及耐药的关键驱动因素,但其靶向调控机制尚未完全阐明;天然抗肿瘤药物如ACBP-3已被证实可在体外及体内抑制GCSCs增殖,但具体分子通路仍不明确;miRNA作为基因表达的重要调控分子,已被证实参与肿瘤细胞的增殖、凋亡等过程,但针对GCSCs中miRNA与天然抗肿瘤药物的关联研究仍较为匮乏。
本研究的创新价值在于首次通过miRNA芯片筛选结合功能验证实验,明确了ACBP-3通过上调miR-338-5p调控GCSCs的增殖与凋亡过程,揭示了ACBP-3作用的分子机制,填补了天然抗肿瘤药物调控胃癌干细胞的miRNA通路研究空白,为ACBP-3联合化疗药物的临床应用提供了理论支撑。
3. 研究思路总结与详细解析
本研究的核心目标是明确ACBP-3抑制GCSCs的分子调控机制,核心科学问题为miR-338-5p在ACBP-3调控GCSCs功能中的作用及下游通路,技术路线遵循“差异分子筛选→功能验证→机制解析→联合治疗验证”的闭环逻辑,通过多维度实验验证了miR-338-5p的核心调控作用。
3.1 差异表达miRNA筛选与验证
实验目的是筛选ACBP-3处理后GCSCs中差异表达的miRNA分子,锁定核心调控靶点。方法细节:采用Affymetrix GeneChip miRNA 3.0芯片检测ACBP-3处理的MKN45和MKN74来源GCSCs的miRNA表达谱,通过生物信息学分析(基因本体GO分析、通路分析、miRNA-基因网络分析)筛选差异显著的miRNA,随后采用实时荧光定量PCR(qRT-PCR)验证miR-338-5p在GCSCs与正常胃上皮细胞中的表达差异。结果解读:芯片筛选共得到9个被ACBP-3显著上调的miRNA,其中miR-338-5p的上调幅度最为显著;qRT-PCR结果显示,MKN45和MKN74来源GCSCs中miR-338-5p的表达水平分别为正常胃上皮GES-1细胞的0.51倍和0.59倍(n=3,P<0.05),提示miR-338-5p在GCSCs中呈低表达状态。
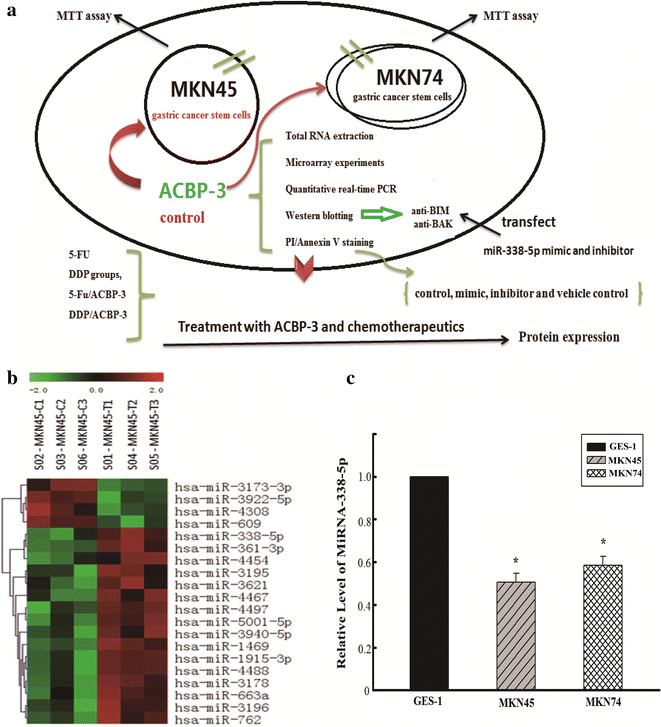
实验所用关键产品:Affymetrix GeneChip miRNA 3.0芯片、TIANGEN miRNA特异性引物、Takara SYBR-Green PCR Master Mix、Strata gene MX3000P qRT-PCR系统
3.2 miR-338-5p对GCSCs增殖的调控作用
实验目的是验证miR-338-5p对GCSCs增殖能力的直接调控作用。方法细节:将miR-338-5p模拟物或抑制剂通过Lipofectamine 2000转染至MKN45和MKN74来源GCSCs,采用MTT法检测转染后24、48、72小时的细胞增殖情况,同时通过活细胞计数实验验证结果的可靠性。结果解读:转染miR-338-5p模拟物后,MKN45和MKN74来源GCSCs中miR-338-5p的表达水平分别上调19.71倍和28.29倍(n=3,P<0.01);MTT实验显示,转染72小时后MKN45来源GCSCs的增殖抑制率为43.89%±5.72(n=3,P<0.01),MKN74来源GCSCs的增殖抑制率为48.21%±4.91(n=3,P<0.05);活细胞计数结果显示,转染48小时后MKN45和MKN74来源GCSCs的细胞数量分别降至对照组的25.33%±2.14和34.51%±4.02(n=3,P<0.01、P<0.05),而miR-338-5p抑制剂对细胞增殖无显著影响(n=3,P>0.05)。
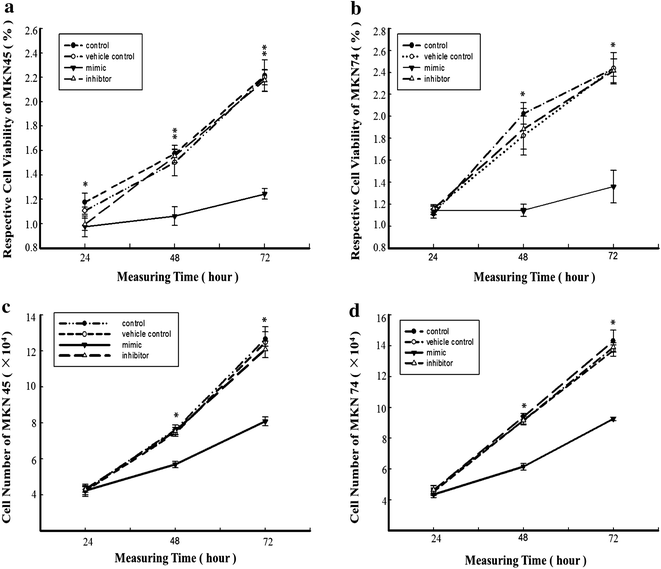
实验所用关键产品:RIBOBIO miR-338-5p模拟物/抑制剂、Thermo Fisher Lipofectamine 2000、Sigma MTT试剂、Biotek ELISA酶标仪
3.3 miR-338-5p对GCSCs凋亡与细胞周期的调控
实验目的是明确miR-338-5p调控GCSCs的具体细胞生物学过程及下游分子通路。方法细节:转染miR-338-5p模拟物或抑制剂48小时后,采用Annexin V-PI双染色流式细胞术检测细胞凋亡情况及细胞周期分布,同时通过蛋白质免疫印迹(Western Blot)检测促凋亡蛋白BAK和BIM的表达水平。结果解读:流式细胞术结果显示,miR-338-5p模拟物处理后,MKN45来源GCSCs的凋亡率为13.23%±0.09(对照组为3%±0.27,n=3,P<0.05),MKN74来源GCSCs的凋亡率为23.87%±0.16(对照组为17.6%±0.45,n=3,P<0.05);细胞周期分析显示,miR-338-5p模拟物处理后GCSCs的G0/G1期细胞比例降低,S和G2/M期细胞比例显著升高(n=3,P<0.01);Western Blot结果显示,转染miR-338-5p模拟物后,MKN45和MKN74来源GCSCs中BAK和BIM的蛋白表达水平均显著上调(n=3,P<0.05),提示miR-338-5p通过调控BCL-2家族促凋亡蛋白诱导GCSCs凋亡。
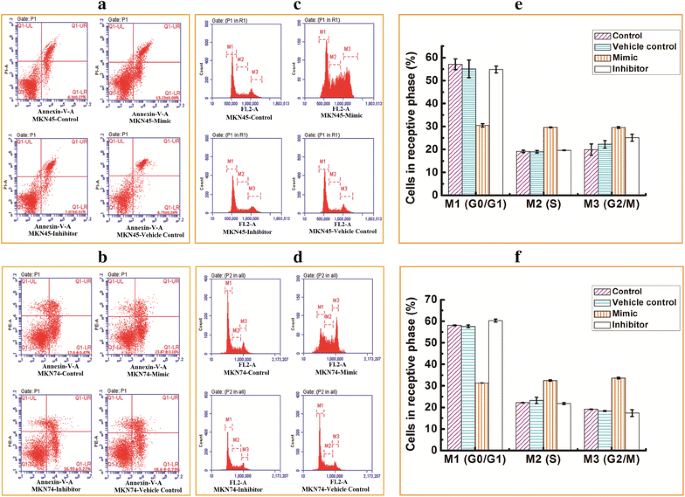
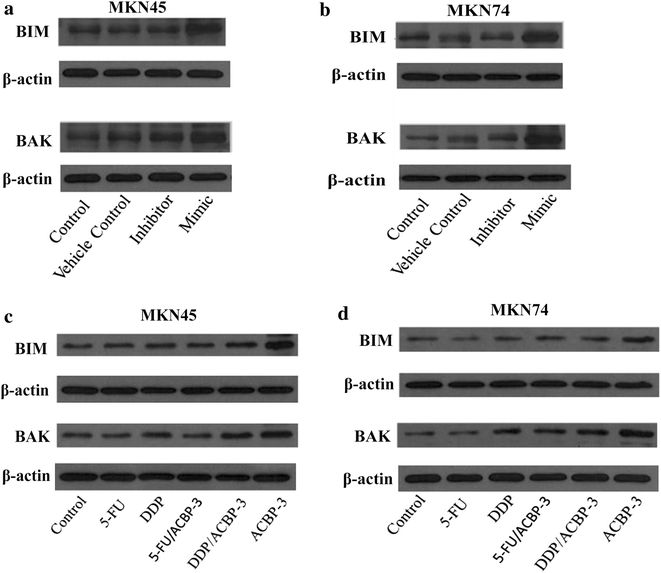
实验所用关键产品:eBioscience Annexin V凋亡检测试剂盒、BD流式细胞仪、Abcam BIM/BAK特异性抗体、Pierce BCA蛋白定量试剂盒
3.4 ACBP-3与化疗药物的协同作用验证
实验目的是验证ACBP-3联合化疗药物对GCSCs的协同抑制作用,并明确其与miR-338-5p的关联。方法细节:采用MTT法检测不同浓度顺铂(DDP)和5-氟尿嘧啶(5-FU)对GCSCs的增殖抑制率,确定半数抑制浓度(IC50);将GCSCs用0.5 IC50的DDP或5-FU联合22μg/ml ACBP-3处理48小时,检测细胞增殖抑制率;通过qRT-PCR检测miR-338-5p的表达水平,Western Blot检测BAK和BIM的蛋白表达。结果解读:DDP和5-FU对GCSCs的抑制作用呈剂量和时间依赖性;联合处理后,MKN45来源GCSCs的增殖抑制率显著高于单独化疗组(n=3,P<0.01),MKN74来源GCSCs的DDP联合组抑制率显著高于单独DDP组(n=3,P<0.01);qRT-PCR结果显示,联合处理后miR-338-5p的表达水平较单独化疗组显著上调(n=3,P<0.01),BAK和BIM的蛋白表达也同步升高,提示ACBP-3通过上调miR-338-5p增强化疗药物对GCSCs的抑制作用。
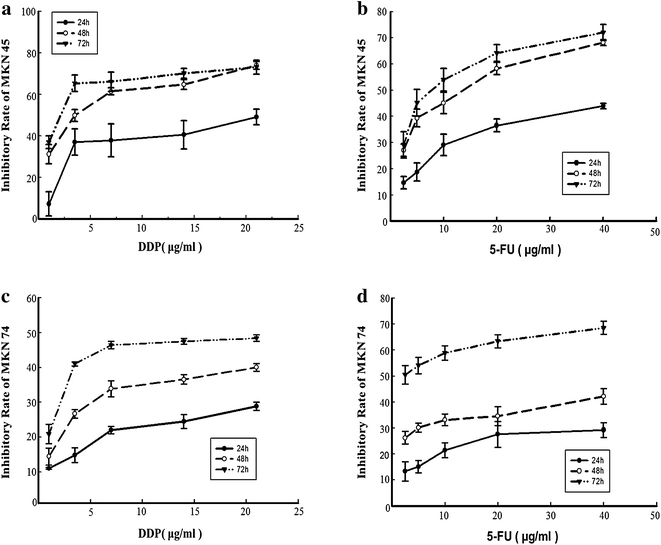
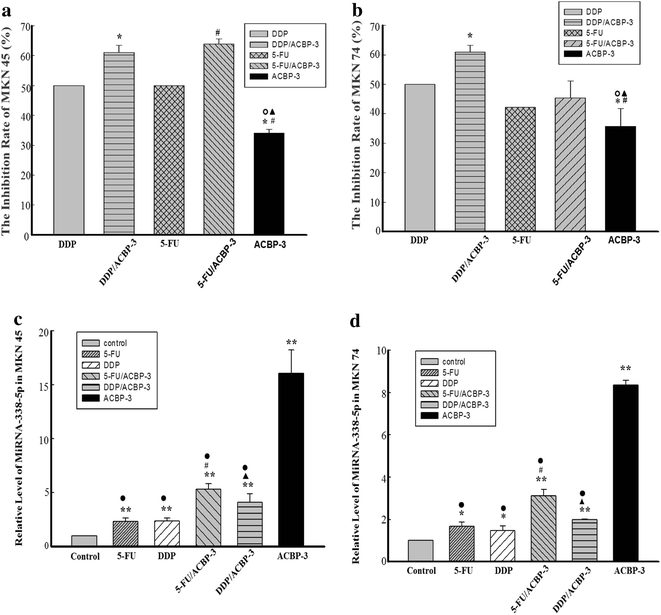
实验所用关键产品:Jinyao 5-氟尿嘧啶、Haosen顺铂、Sigma MTT试剂
4. Biomarker研究及发现成果
本研究中鉴定的Biomarker为miR-338-5p,属于细胞内miRNA类型,筛选与验证逻辑为“miRNA芯片筛选差异表达→qRT-PCR验证组织表达差异→细胞功能实验验证调控作用→联合治疗实验验证临床应用价值”,形成了完整的证据链。
研究过程中,miR-338-5p来源于GCSCs细胞内,验证方法包括qRT-PCR检测表达水平、细胞转染实验验证功能、Western Blot检测下游蛋白表达;特异性方面,GCSCs中miR-338-5p的表达水平显著低于正常胃上皮细胞(差异倍数为1.71-1.96倍,n=3,P<0.05);敏感性方面,ACBP-3处理后miR-338-5p的表达水平显著上调,可作为ACBP-3作用的响应标志物。
核心成果方面,miR-338-5p作为抑癌miRNA,可显著抑制GCSCs的增殖并诱导其凋亡,首次发现其通过调控BCL-2家族促凋亡蛋白BAK和BIM的表达介导细胞凋亡;同时,ACBP-3可通过上调miR-338-5p降低化疗药物的有效剂量,为胃癌干细胞的靶向治疗提供了新的生物标志物与治疗策略。文献未明确提供miR-338-5p作为预后标志物的风险比(HR)数据,基于实验结果推测其可作为胃癌患者预后评估的潜在标志物。
