1. 领域背景与文献引入
文献英文标题:ARPC1A correlates with poor prognosis in prostate cancer and is up-regulated by glutamine metabolism to promote tumor cell migration, invasion and cytoskeletal changes;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:肿瘤学-泌尿生殖系统肿瘤(前列腺癌)
前列腺癌是全球男性第二常见的恶性肿瘤,也是第五大癌症相关死因,其具有高度异质性,多数患者表现为惰性病程,5年生存率超过90%,但部分患者会进展为侵袭性极强的转移性前列腺癌,5年生存率不足30%。尽管近年来的功能研究加深了对前列腺癌发病机制的理解,但目前仍缺乏可靠的生物标志物用于区分惰性与侵袭性前列腺癌,以精准评估患者风险、指导预后判断和临床管理。因此,筛选与前列腺癌进展和转移相关的特异性生物标志物,并明确其生物学功能及调控机制,成为该领域亟待解决的核心问题。本文通过生物信息学分析结合体内外实验,旨在填补这一研究空白,为前列腺癌的精准诊疗提供新的靶点和理论依据。
2. 文献综述解析
作者围绕前列腺癌的临床异质性、生物标志物研究现状、ARP2/3复合物的肿瘤功能及谷氨酰胺代谢的调控作用四个维度展开综述,系统梳理了领域内现有研究的进展与不足。
首先,作者总结了前列腺癌的临床现状,指出其异质性导致的预后差异是临床诊疗的关键难点,现有研究虽对发病机制有一定认知,但缺乏能有效区分惰性与侵袭性病变的生物标志物。其次,作者回顾了生物信息学技术在肿瘤生物标志物筛选中的应用,提到加权基因共表达网络分析(WGCNA)已成功用于前列腺癌的hub基因筛选,但针对ARPC1A的研究尚未见报道。再者,作者梳理了ARP2/3复合物在其他肿瘤中的功能,该复合物通过调控细胞骨架动态参与肿瘤细胞的迁移和侵袭,在膀胱癌、胶质瘤、胃癌等多种肿瘤中被证实与不良预后相关,但ARPC1A作为复合物的亚基,其在前列腺癌中的具体作用仍不明确。此外,作者提及谷氨酰胺代谢作为肿瘤代谢重编程的关键环节,调控多种肿瘤生物学过程,但谷氨酰胺代谢与ARPC1A的关联尚未被揭示。
现有研究的优势在于利用多组学数据和生物信息学工具高效筛选潜在靶点,为肿瘤机制研究提供了方向;局限性则体现在缺乏针对前列腺癌转移特异性靶点的深入研究,尤其是ARPC1A的功能及上游调控机制的空白。本文的创新价值在于首次将ARPC1A作为前列腺癌的核心研究靶点,明确其表达特征、预后价值及生物学功能,并揭示谷氨酰胺代谢对其的上游调控作用,填补了该领域的研究空白,为前列腺癌的生物标志物研发和治疗靶点选择提供了新的思路。
3. 研究思路总结与详细解析
本研究以“生物信息学筛选-临床验证-功能实验-机制解析”为闭环技术路线,核心目标是筛选前列腺癌进展和转移的潜在生物标志物并明确其生物学功能及调控机制,解决的核心科学问题包括ARPC1A在前列腺癌中的表达模式、预后价值、生物学功能,以及谷氨酰胺代谢对ARPC1A的调控机制。
3.1 生物信息学筛选前列腺癌相关hub基因
实验目的:从公共数据库的前列腺癌基因表达数据中筛选与肿瘤进展和转移密切相关的hub基因。方法细节:研究人员下载癌症基因组图谱(TCGA)数据库中434例前列腺癌样本的基因表达数据及临床信息,经过数据清洗和质量控制后,采用WGCNA构建共表达网络,选择软阈值β=16(无标度拓扑拟合指数R²=0.93)以确保网络的无标度特性;通过模块识别得到6个基因模块,进一步分析模块与临床特征(T分期、N分期)的相关性,筛选出与T分期、N分期相关性最强的turquoise模块(包含137个基因);对该模块进行基因本体(GO)富集分析、Metascape通路分析及基因集富集分析(GSEA),并利用STRING数据库构建蛋白质-蛋白质相互作用(PPI)网络,通过Cytoscape软件的Centiscape插件计算节点连接度,筛选出hub基因。结果解读:GO富集分析显示turquoise模块基因主要参与细胞组分组织、代谢过程、细胞周期等生物学过程,通路分析富集于微管细胞骨架组织、有丝分裂细胞周期等通路;PPI网络分析显示ARPC1A的连接度最高,提示其可能是参与前列腺癌进展的核心基因。
产品关联:文献未提及具体实验产品,领域常规使用R语言WGCNA包、STRING数据库、Cytoscape软件等生物信息学工具。
3.2 ARPC1A表达水平与预后价值的临床验证
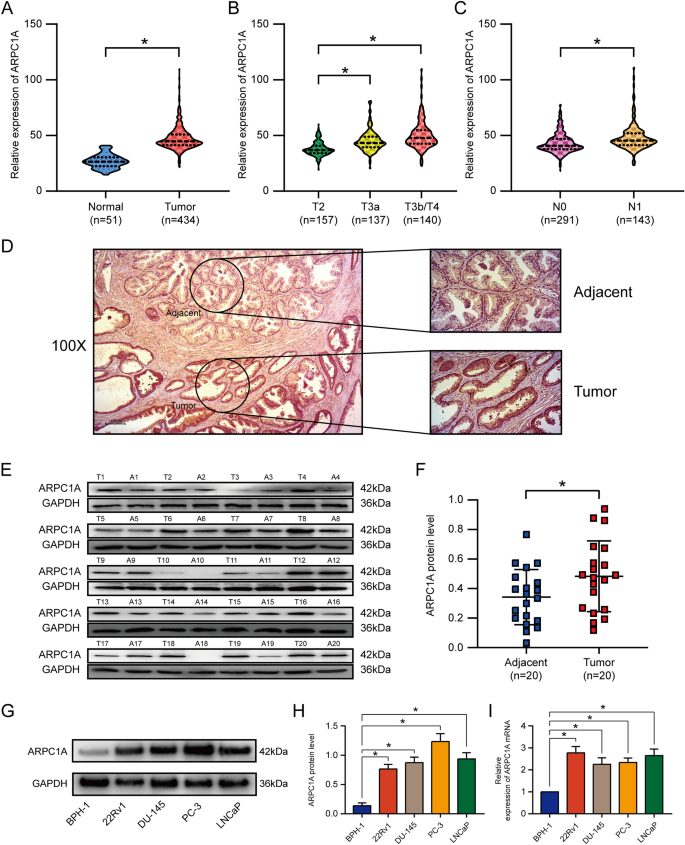
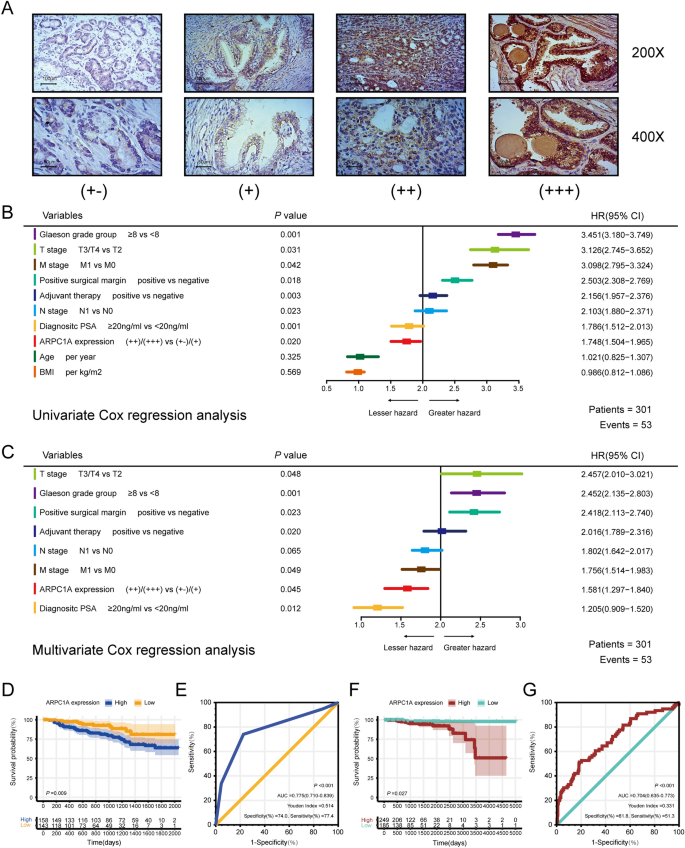
实验目的:验证ARPC1A在前列腺癌组织和细胞系中的表达差异,并评估其作为预后生物标志物的价值。方法细节:首先分析TCGA数据库中434例前列腺癌组织和51例正常前列腺组织的ARPC1A mRNA表达水平;收集本院20对前列腺癌及癌旁正常组织样本,通过实时荧光定量聚合酶链反应(qRT-PCR)、蛋白质免疫印迹(WB)检测ARPC1A的mRNA和蛋白表达;构建包含301例前列腺癌患者的组织芯片(TMA),采用免疫组化(IHC)染色,通过半定量H-score法(染色强度×阳性细胞比例)评估ARPC1A蛋白表达;利用单因素、多因素Cox比例风险回归模型分析ARPC1A与患者生化复发(BCR)及总生存期(OS)的相关性,采用Kaplan-Meier法绘制生存曲线并进行log-rank检验,通过受试者工作特征(ROC)曲线评估其预后预测效能。结果解读:TCGA数据库分析显示,前列腺癌组织中ARPC1A mRNA表达显著高于正常组织(n=485,P<0.05),且与T分期、N分期呈正相关;本院临床样本检测显示,前列腺癌组织中ARPC1A蛋白表达显著高于癌旁组织(n=20,P<0.05);前列腺癌细胞系(PC-3、DU-145、22Rv1、LNCaP)中ARPC1A的mRNA和蛋白表达均显著高于正常前列腺上皮细胞系BPH-1(n=3,P<0.05)。多因素Cox回归分析显示,ARPC1A高表达是前列腺癌患者根治术后BCR的独立预后因子(HR=1.581,n=301,P<0.05);Kaplan-Meier生存分析显示,高表达ARPC1A的患者BCR累积发生率更高(TMA队列,n=301,P<0.05),OS更短(TCGA队列,n=434,P<0.05);ROC曲线显示,ARPC1A预测BCR的曲线下面积(AUC)为0.775,特异性为74.0%,敏感性为77.4%(n=301),预测OS的AUC为0.704,特异性为81.8%,敏感性为51.3%(n=434)。
产品关联:实验所用关键产品:抗ARPC1A抗体(Abcam)、抗GAPDH抗体(Abcam)、qRT-PCR试剂盒(Takara)、免疫组化试剂盒(Zhongshan Biotech)等。
3.3 ARPC1A对前列腺癌细胞功能的体外实验验证
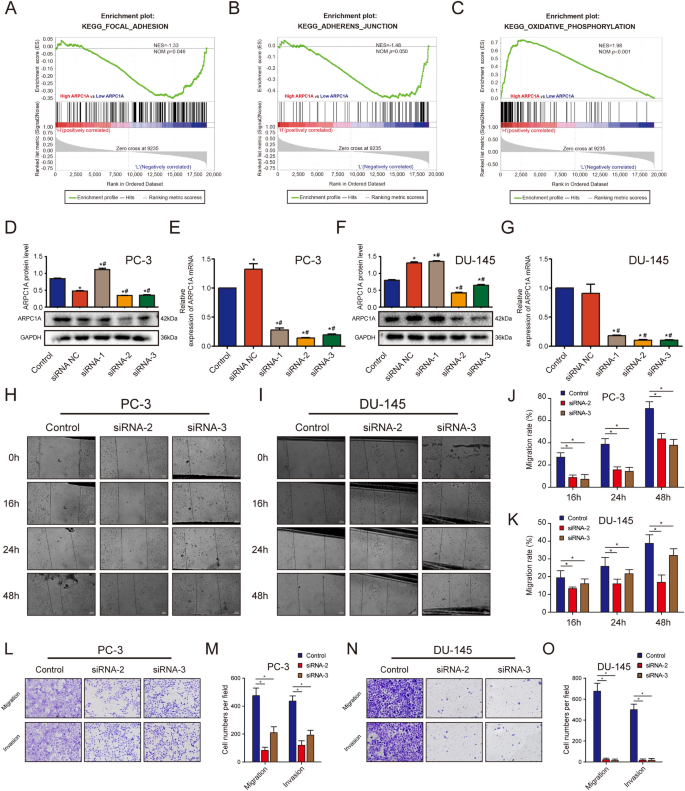
实验目的:明确ARPC1A在前列腺癌细胞迁移、侵袭、增殖、细胞周期及细胞骨架形成中的作用。方法细节:在PC-3和DU-145细胞中设计3条靶向ARPC1A的小干扰RNA(siRNA),通过qRT-PCR和WB验证敲低效率,筛选出2条高效siRNA(siRNA-2、siRNA-3)用于后续实验;采用划痕实验检测细胞迁移能力,Transwell实验(未包被Matrigel用于迁移,包被Matrigel用于侵袭)检测细胞迁移和侵袭能力;CCK-8实验检测细胞增殖活性;流式细胞术检测细胞周期分布;采用FITC标记的鬼笔环肽进行免疫荧光染色,观察细胞骨架的变化;同时构建ARPC1A过表达的PC-3稳定细胞系,通过慢病毒转染结合嘌呤霉素筛选获得阳性克隆,并用qRT-PCR和WB验证过表达效率。结果解读:敲低ARPC1A后,PC-3和DU-145细胞的划痕愈合率显著降低(n=3,P<0.05),Transwell迁移和侵袭实验中穿膜细胞数显著减少(n=3,P<0.05);CCK-8实验显示,敲低ARPC1A对细胞增殖活性无显著影响(n=3,P>0.05);流式细胞术检测显示,细胞周期分布无显著变化(n=3,P>0.05);免疫荧光染色显示,敲低ARPC1A后,细胞内肌动蛋白丝的数量减少,细胞骨架形成受抑制;ARPC1A过表达的PC-3细胞系构建成功,其mRNA和蛋白表达水平显著高于对照组(n=3,P<0.05)。
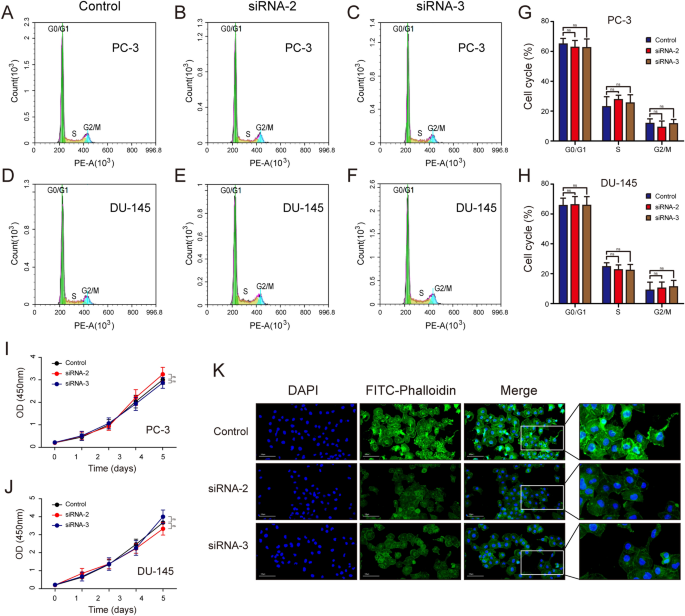
产品关联:实验所用关键产品:Lipofectamine 3000转染试剂(Life Technologies)、CCK-8试剂盒(Dojindo)、Transwell小室(Corning Costar)、Matrigel(BD Biocoat)、FITC标记鬼笔环肽(MDL Biotechnology)、慢病毒载体(GeneChem Corporation)等。
3.4 ARPC1A对前列腺癌体内生长和转移的实验验证
实验目的:验证ARPC1A在体内对前列腺癌生长和转移的调控作用。方法细节:构建裸鼠皮下移植瘤模型,将ARPC1A过表达或对照PC-3细胞注射到裸鼠右侧背部皮下,每组8只,28天后处死小鼠,测量肿瘤的大小和重量;构建裸鼠肺转移模型,将ARPC1A过表达或对照PC-3细胞通过尾静脉注射到裸鼠体内,每组10只,28天后采用IVIS Lumina II活体成像系统检测肺转移的荧光信号,随后取肺组织进行HE染色,计数转移结节的数量。结果解读:皮下移植瘤模型中,ARPC1A过表达组与对照组的肿瘤大小和重量无显著差异(n=8,P>0.05);肺转移模型中,ARPC1A过表达组的肺转移荧光信号强度显著高于对照组,HE染色显示转移结节数显著增多(n=10,P<0.05),提示ARPC1A在体内促进前列腺癌的肺转移,但对肿瘤生长无明显影响。
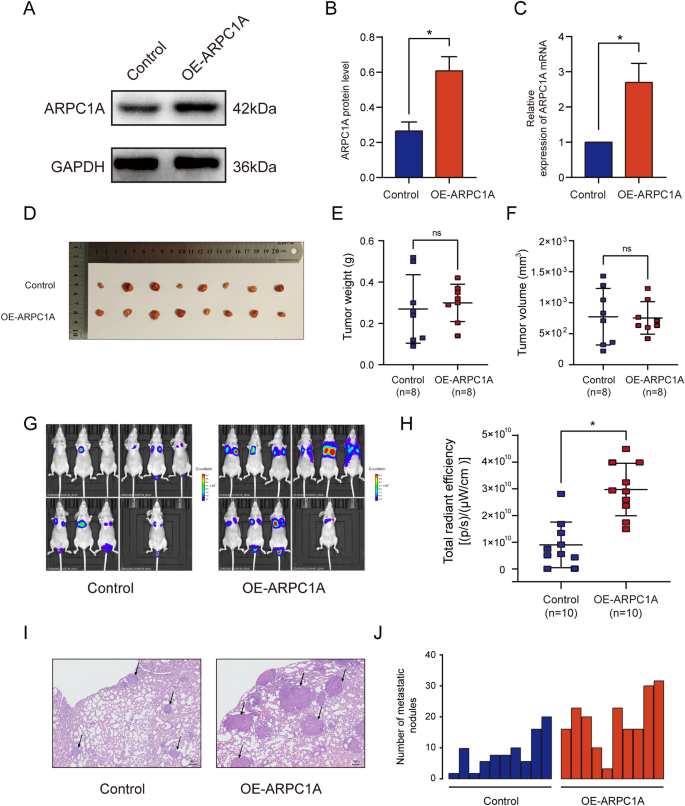
产品关联:实验所用关键产品:IVIS Lumina II活体成像系统(Perkin Elmer)等。
3.5 谷氨酰胺代谢对ARPC1A的调控机制研究
实验目的:明确谷氨酰胺代谢对ARPC1A表达及前列腺癌细胞功能的调控作用。方法细节:首先通过GSEA分析ARPC1A表达与谷氨酰胺代谢通路的相关性;将PC-3细胞分别培养于谷氨酰胺剥夺、葡萄糖剥夺的培养基中,或添加谷氨酰胺酶抑制剂CB-839,通过qRT-PCR和WB检测ARPC1A的表达,采用划痕实验、Transwell实验检测细胞迁移和侵袭能力,免疫荧光染色观察细胞骨架变化;同时在谷氨酰胺剥夺或CB-839处理的细胞中添加可透过细胞膜的二甲α-酮戊二酸(DKG),或过表达ARPC1A,观察表型的逆转情况。结果解读:GSEA分析显示,ARPC1A高表达与谷氨酰胺代谢通路呈显著正相关;谷氨酰胺剥夺或CB-839处理可显著抑制ARPC1A的表达,同时抑制细胞的迁移、侵袭和细胞骨架形成(n=3,P<0.05),而葡萄糖剥夺对上述指标无显著影响(n=3,P>0.05);添加DKG可逆转谷氨酰胺剥夺或CB-839处理导致的ARPC1A表达下调及细胞功能抑制(n=3,P<0.05),过表达ARPC1A也可逆转谷氨酰胺代谢抑制导致的细胞迁移、侵袭和细胞骨架形成的抑制(n=3,P<0.05),提示谷氨酰胺代谢通过上调ARPC1A的表达,促进前列腺癌细胞的迁移、侵袭和细胞骨架变化。
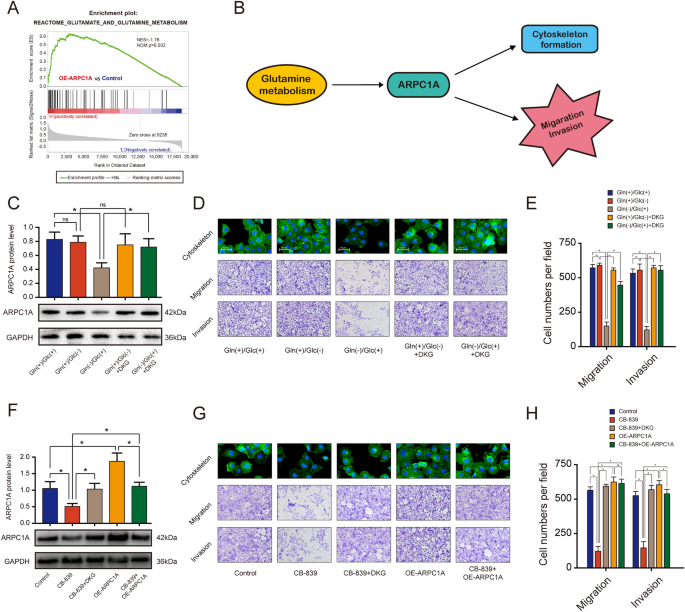
产品关联:实验所用关键产品:CB-839(谷氨酰胺酶抑制剂)、DKG(二甲α-酮戊二酸)等。
4. Biomarker研究及发现成果解析
本研究筛选并验证的Biomarker为肌动蛋白相关蛋白2/3复合物亚基1A(ARPC1A),属于蛋白质类生物标志物,其筛选与验证遵循“生物信息学筛选-临床样本验证-体内外功能实验-机制解析”的完整逻辑链条。
Biomarker定位:ARPC1A作为ARP2/3复合物的亚基,通过调控细胞骨架动态参与前列腺癌的转移过程,其筛选过程为:从TCGA数据库的前列腺癌基因表达数据中通过WGCNA筛选出与肿瘤进展相关的turquoise模块,再通过PPI网络分析得到连接度最高的hub基因ARPC1A,随后通过临床组织样本、细胞系验证其表达特征,通过体内外实验验证其生物学功能,最后通过机制实验明确其上游调控机制。
研究过程详述:ARPC1A的检测样本包括前列腺癌组织、癌旁正常组织、前列腺癌细胞系及正常前列腺上皮细胞系,验证方法包括qRT-PCR、WB、免疫组化等;其特异性表现为在前列腺癌组织和细胞系中表达显著高于正常组织和细胞系(n=485/20/3,P<0.05),且与T分期、N分期等恶性临床特征相关;敏感性方面,其预测前列腺癌根治术后BCR的敏感性为77.4%,预测OS的敏感性为51.3%,ROC曲线AUC分别为0.775和0.704。
核心成果提炼:ARPC1A是前列腺癌的独立预后因子,高表达患者根治术后BCR的风险升高1.581倍(HR=1.581,n=301,P<0.05),OS显著缩短(n=434,P<0.05);首次发现ARPC1A通过调控细胞骨架动态促进前列腺癌细胞的迁移和侵袭,但对细胞增殖无影响;首次揭示谷氨酰胺代谢通过上调ARPC1A的表达,介导前列腺癌细胞的迁移、侵袭和细胞骨架变化;该Biomarker的创新性在于首次明确了ARPC1A在前列腺癌中的功能及调控机制,为前列腺癌的转移预警和治疗靶点选择提供了新的理论依据,具有重要的临床转化价值。
