1. 领域背景与文献引入
文献英文标题:Low-dose Diosbulbin-B (DB) activates tumor-intrinsic PD-L1/NLRP3 signaling pathway mediated pyroptotic cell death to increase cisplatin-sensitivity in gastric cancer (GC);发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:胃癌化疗耐药与天然药物增敏研究
胃癌是全球范围内发病率和死亡率均位居前列的恶性肿瘤,化疗是晚期胃癌的核心治疗手段,顺铂作为一线化疗药物,在临床应用中面临严重的化疗耐药问题,成为制约治疗效果的关键瓶颈。领域发展关键节点显示,2000年后肿瘤干细胞(CSCs)被证实是介导胃癌化疗耐药的核心因素之一,2010年后焦亡作为新型程序性细胞死亡方式被发现与化疗敏感性密切相关,当前研究热点聚焦于天然药物逆转耐药、靶向CSCs或细胞死亡通路的策略开发,但仍存在未解决的核心问题:缺乏低毒高效的顺铂增敏策略,且程序性死亡配体1(PD-L1)与NOD样受体热蛋白结构域相关蛋白3(NLRP3)在胃癌耐药中的调控机制尚未明确。
针对上述研究空白,现有天然药物黄独素B(DB)因高剂量肝毒性限制了临床应用,而低剂量DB的顺铂增敏作用及分子机制尚未被系统阐明。本研究旨在探究低剂量DB通过调控PD-L1/NLRP3通路介导焦亡及抑制CSCs来逆转顺铂耐药胃癌(CR-GC)的作用机制,为临床治疗CR-GC提供新的低毒高效策略。
2. 文献综述解析
作者从胃癌化疗耐药现状、天然药物DB的应用局限、CSCs与耐药的关联、PD-L1及焦亡通路的作用四个维度对领域研究进行系统综述,明确现有研究的分类逻辑与核心结论。
现有研究表明,顺铂耐药的核心机制包括CSCs富集、细胞死亡信号通路抑制等;DB作为从中药黄独中提取的天然抗肿瘤化合物,高剂量具有显著肝毒性,低剂量单药对胃癌细胞无明显抑制作用;PD-L1不仅参与肿瘤免疫逃逸,还被证实介导多种肿瘤的化疗耐药,NLRP3介导的焦亡可增强化疗药物的细胞毒性,但PD-L1与NLRP3在胃癌耐药中的直接调控关系尚未被报道;CSCs富集是CR-GC的显著特征,靶向CSCs可逆转顺铂耐药,但低剂量DB对CSCs的调控作用及机制仍属研究空白。
本研究的创新价值在于,首次揭示低剂量DB通过下调PD-L1激活NLRP3介导的焦亡,同时抑制CSCs的富集,从而协同增强顺铂对CR-GC的细胞毒性,填补了低剂量DB增敏机制不清及PD-L1/NLRP3通路在胃癌耐药中作用的研究空白,为CR-GC的临床治疗提供了新的理论依据与潜在策略。
3. 研究思路总结与详细解析
本研究的核心目标是阐明低剂量DB逆转CR-GC顺铂耐药的分子机制,核心科学问题聚焦于低剂量DB如何通过PD-L1/NLRP3信号通路调控焦亡及CSCs功能,技术路线遵循“模型构建→体外功能验证→机制探究→体内验证”的闭环逻辑,系统解析低剂量DB的增敏作用及分子通路。
3.1 顺铂耐药胃癌细胞系与动物模型构建
实验目的:建立稳定的CR-GC细胞系及体内异种移植模型,为后续功能与机制研究提供实验基础。方法细节:从Resistant Cancer Cell Line Collection获取CR-GC细胞系(SGC7901/CDDP、BGC823/CDDP),亲本顺铂敏感胃癌(CS-GC)细胞系来自美国典型培养物保藏中心(ATCC);通过逐步递增顺铂浓度(0.5-5μg/ml,持续80天)诱导CS-GC细胞获得获得性顺铂耐药细胞系(ACR-GC);构建BALB/c裸鼠异种移植模型,将2×10^7个CR-GC细胞接种于裸鼠背部皮下,每5天监测肿瘤体积,30天后处死小鼠并称重肿瘤组织。结果解读:CR-GC细胞对顺铂具有显著耐药性,低剂量DB(12.5μM)单药或顺铂单药处理对CR-GC细胞活力无显著影响(P>0.05),而低剂量DB联合顺铂处理可显著抑制CR-GC细胞增殖与活力(P<0.05);体内实验显示,联合处理组肿瘤重量与体积均显著低于单药组(P<0.05),表明低剂量DB可在体内增强顺铂对CR-GC的抗肿瘤作用。
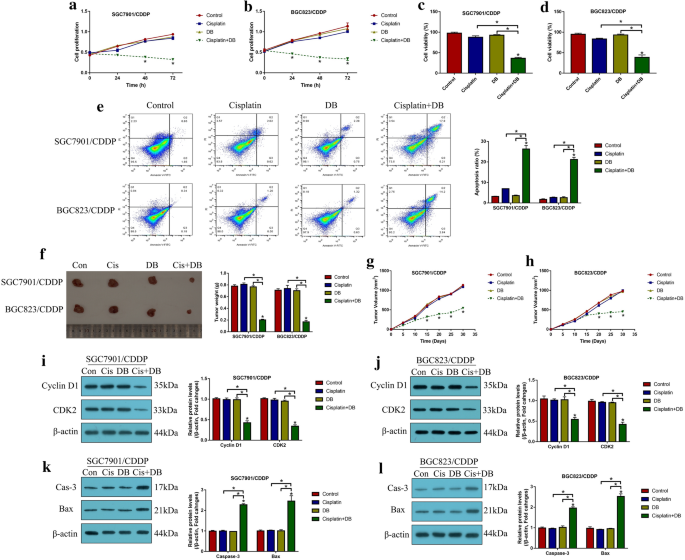
产品关联:实验所用关键产品包括细胞计数试剂盒-8(CCK-8,Beyotime)、台盼蓝染色液(Sigma-Aldrich)、流式细胞凋亡检测试剂盒(BD Bioscience)、Lipofectamine 2000转染试剂(Invitrogen)等。
3.2 低剂量DB联合顺铂诱导细胞死亡类型鉴定
实验目的:明确低剂量DB联合顺铂诱导CR-GC细胞死亡的主要类型及依赖通路。方法细节:分别用凋亡抑制剂(Z-VAD-FMK)、焦亡抑制剂(Necrosulfonamide,NSA)、自噬抑制剂(氯喹)、铁死亡抑制剂(Ferrostatin-1,Fer-1)预处理CR-GC细胞2小时,再用顺铂联合低剂量DB处理48小时;通过CCK-8、台盼蓝染色检测细胞活力,Annexin V-FITC/PI双染流式检测细胞凋亡率,蛋白质免疫印迹(Western Blot)检测焦亡标志物(NLRP3、ASC、IL-1β、IL-18)及凋亡标志物(活化的Caspase-3、Bax)的表达;沉默NLRP3后检测联合处理对细胞死亡的影响。结果解读:仅凋亡抑制剂与焦亡抑制剂可显著逆转联合处理对CR-GC细胞活力的抑制作用(P<0.05),联合处理可显著上调焦亡与凋亡标志物的表达(P<0.05);沉默NLRP3可完全逆转联合处理诱导的细胞死亡(P<0.05),表明低剂量DB联合顺铂通过NLRP3介导的焦亡诱导细胞凋亡,进而增强顺铂的细胞毒性。
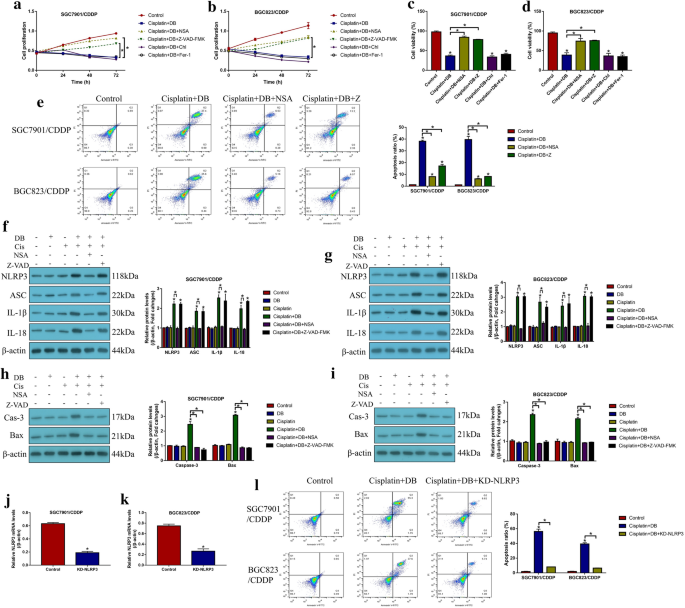
产品关联:文献未提及具体抗体品牌,领域常规使用Cell Signaling Technology、Abcam等品牌的特异性抗体。
3.3 肿瘤干细胞在CR-GC中的富集及DB的调控作用
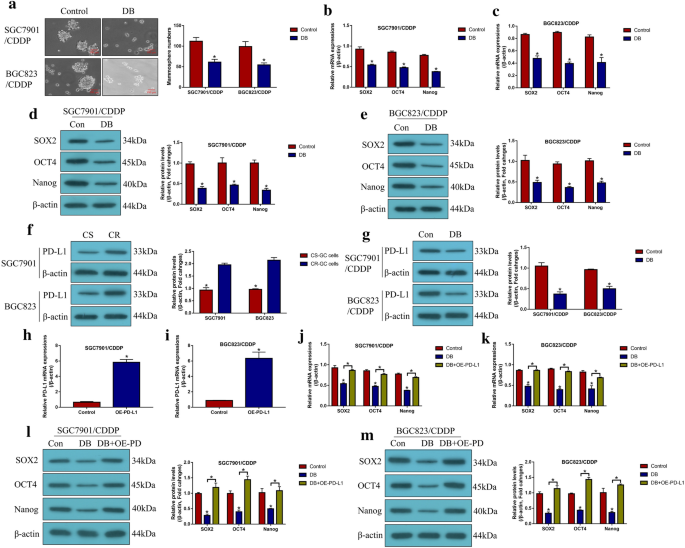
实验目的:验证CSCs在CR-GC中的富集特征及低剂量DB对CSCs功能的调控作用。方法细节:采用无血清球形成实验检测CR-GC、ACR-GC及CS-GC细胞的球形成能力,通过实时荧光定量PCR(qRT-PCR)及蛋白质免疫印迹检测CSCs标志物(SOX2、OCT4、Nanog)的表达;用低剂量DB处理CR-GC细胞48小时,检测球形成能力及标志物表达;通过过表达PD-L1,验证DB对CSCs的调控是否依赖PD-L1。结果解读:CR-GC与ACR-GC细胞的球形成能力显著高于CS-GC细胞(P<0.05),CSCs标志物表达显著上调;低剂量DB可显著抑制CR-GC细胞的球形成能力及CSCs标志物表达(P<0.05),过表达PD-L1可完全逆转低剂量DB对CSCs的抑制作用(P<0.05),表明低剂量DB通过下调PD-L1抑制CR-GC细胞的CSCs功能。
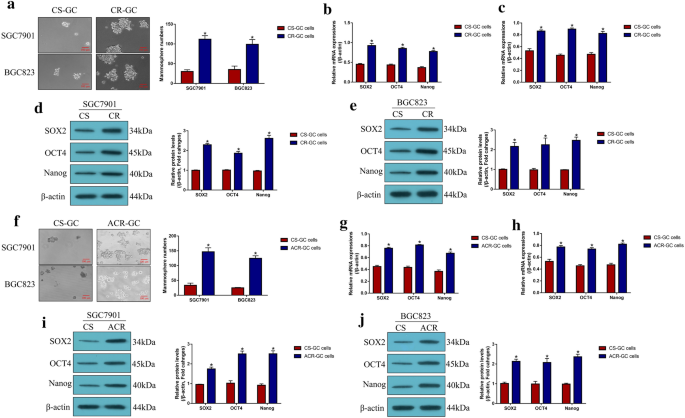
产品关联:球形成实验所用无血清培养基添加B27添加剂、表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF),均购自Gibco。
3.4 PD-L1/NLRP3信号通路调控机制验证
实验目的:阐明PD-L1对NLRP3的调控关系及低剂量DB的作用靶点。方法细节:通过转染PD-L1过表达载体或小干扰RNA(siRNA),检测CR-GC细胞中NLRP3及焦亡标志物的表达;沉默NLRP3后,检测PD-L1沉默对顺铂处理后CR-GC细胞死亡的影响;用低剂量DB处理CR-GC细胞,检测PD-L1与NLRP3的表达变化;过表达PD-L1后,检测联合处理对NLRP3表达及细胞死亡的影响。结果解读:PD-L1在CR-GC细胞中高表达,且负调控NLRP3的表达(P<0.05);沉默PD-L1可显著激活NLRP3介导的焦亡(P<0.05),该作用可被沉默NLRP3逆转;低剂量DB可显著下调PD-L1的表达,进而激活NLRP3(P<0.05);过表达PD-L1可完全逆转低剂量DB联合顺铂对NLRP3的激活及细胞死亡的诱导作用(P<0.05),表明低剂量DB通过下调PD-L1激活NLRP3介导的焦亡,协同增强顺铂的细胞毒性。
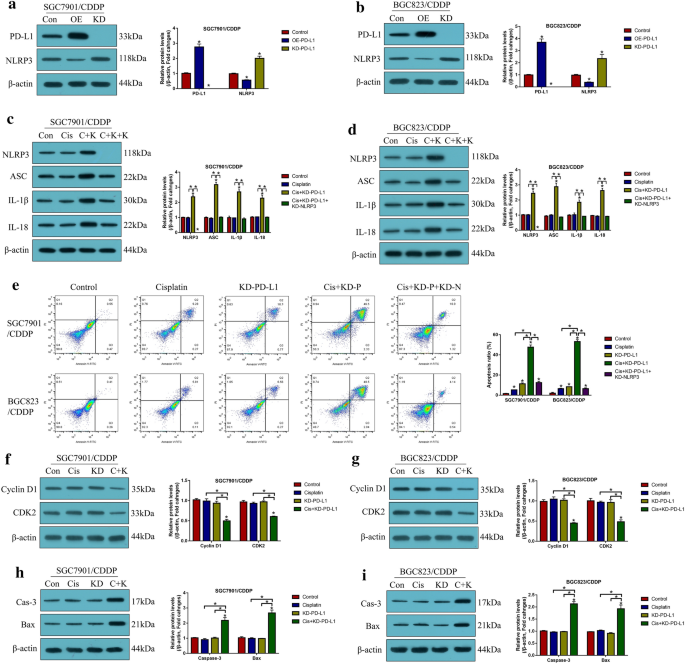
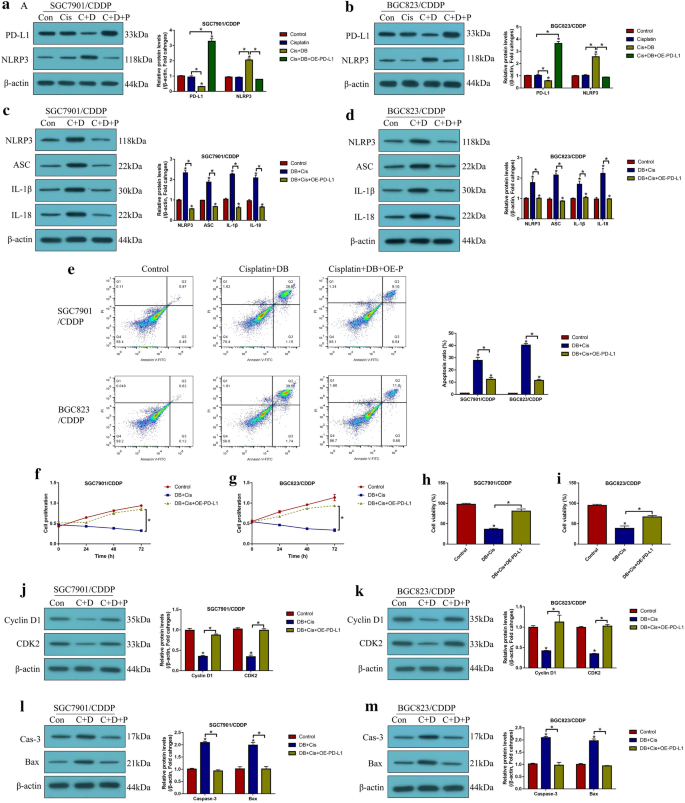
产品关联:PD-L1 siRNA由Sangon Biotech合成,PD-L1过表达载体由Vazamy构建,转染试剂为Lipofectamine 2000(Invitrogen)。
3.5 体内实验验证低剂量DB联合顺铂的治疗效果
实验目的:在体内水平验证低剂量DB联合顺铂对CR-GC的抗肿瘤作用及机制。方法细节:构建CR-GC细胞异种移植模型,将裸鼠分为对照组、顺铂组、低剂量DB组、联合处理组,每5天监测肿瘤体积,30天后处死小鼠,称重肿瘤组织;通过免疫组化(IHC)检测肿瘤组织中Ki67的表达,蛋白质免疫印迹检测增殖标志物(Cyclin D1、CDK2)及凋亡标志物(活化的Caspase-3、Bax)的表达。结果解读:联合处理组的肿瘤重量与体积显著低于其他组(P<0.05),Ki67表达显著下调,增殖标志物表达降低,凋亡标志物表达上调(P<0.05),表明低剂量DB可在体内协同增强顺铂对CR-GC的抗肿瘤作用,其机制与抑制细胞增殖、诱导细胞凋亡相关。
产品关联:免疫组化实验所用Ki67抗体未提及具体品牌,领域常规使用Abcam、Cell Signaling Technology等品牌的抗体。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker包括PD-L1、NLRP3及CSCs标志物(SOX2、OCT4、Nanog),筛选与验证逻辑遵循“细胞系差异表达筛选→功能验证→体内模型验证”的完整链条。
PD-L1作为核心Biomarker,来源为CR-GC细胞及肿瘤组织,通过蛋白质免疫印迹、免疫组化验证其在CR-GC中的高表达(P<0.05),低剂量DB可显著下调其表达(P<0.05);NLRP3作为焦亡通路的关键Biomarker,在CR-GC细胞中低表达,PD-L1负调控其表达(P<0.05),低剂量DB通过下调PD-L1激活NLRP3(P<0.05);CSCs标志物SOX2、OCT4、Nanog在CR-GC细胞中高表达,低剂量DB可显著下调其表达(P<0.05),该作用依赖PD-L1的下调。
核心成果提炼:PD-L1可作为CR-GC耐药的预测Biomarker,其下调可激活NLRP3介导的焦亡并抑制CSCs功能,低剂量DB通过靶向PD-L1/NLRP3通路逆转顺铂耐药,为CR-GC的治疗提供了新的潜在靶点;所有实验数据均重复至少3次,P<0.05为统计学显著差异,样本量符合实验设计要求。
