1. 领域背景与文献引入
文献英文标题:β-adrenergic receptor inhibition enhances oncolytic herpes virus propagation through STAT3 activation in gastric cancer;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:胃癌溶瘤病毒治疗与肿瘤免疫调控
溶瘤病毒(OVs)是肿瘤治疗领域的重要方向,2015年美国FDA批准首个溶瘤病毒药物Talimogene laherparepvec(T-VEC)用于晚期黑色素瘤,标志着该领域进入临床应用阶段。当前研究热点聚焦于提升溶瘤病毒的临床疗效,核心未解决问题在于:溶瘤病毒感染肿瘤细胞后会激活宿主I型干扰素(IFN-I)介导的先天免疫通路,诱导抗病毒基因表达,抑制病毒增殖,导致治疗响应率偏低(如T-VEC在晚期黑色素瘤中的响应率仅16.3%)。针对胃癌这一高发恶性肿瘤,现有溶瘤病毒治疗策略尚未有效突破I型干扰素的抗病毒抑制,缺乏可转化的联合治疗方案。本研究针对这一空白,提出β-受体阻滞剂普萘洛尔预处理可通过调控STAT3-PKR信号轴,逆转I型干扰素的抗病毒作用,增强溶瘤疱疹病毒T1012G在胃癌中的增殖与抗肿瘤疗效,为胃癌溶瘤病毒治疗提供新的协同策略。
2. 文献综述解析
作者从溶瘤病毒发展现状、宿主先天免疫耐药机制、β-肾上腺素能通路与STAT3调控关联三个维度,系统评述领域内现有研究。首先,溶瘤病毒领域,现有研究已证实其可选择性杀伤肿瘤细胞,T-VEC等药物已获批临床应用,但核心局限是宿主I型干扰素通路激活导致病毒增殖受抑,临床响应率不足;其次,先天免疫耐药机制方面,I型干扰素可激活STAT1/2介导的抗病毒基因(如蛋白激酶R,PKR)表达,抑制病毒蛋白合成,而STAT3可负调控该通路,但现有研究未充分利用STAT3的调控作用增强溶瘤病毒疗效;第三,β-肾上腺素能通路领域,已有研究表明其可通过下游激酶级联反应调控STAT3激活,但尚未将该通路与溶瘤病毒治疗结合。通过对比现有研究的未解决问题,本研究的创新价值凸显:首次将β-受体阻滞剂与溶瘤疱疹病毒结合,采用预处理策略激活STAT3,即使在I型干扰素存在的情况下仍能抑制PKR的抗病毒作用,增强病毒增殖,填补了胃癌溶瘤病毒联合治疗策略的研究空白。
3. 研究思路总结与详细解析
本研究以“验证普萘洛尔预处理增强溶瘤疱疹病毒T1012G在胃癌中的增殖与疗效”为核心目标,围绕“普萘洛尔如何通过STAT3-PKR通路逆转I型干扰素抗病毒作用”这一科学问题,构建“假设提出→细胞水平协同验证→体内疗效验证→机制深入解析→I型干扰素逆转效应验证”的闭环技术路线,系统阐明联合治疗的协同机制。
3.1 细胞模型构建与药物协同杀伤验证
实验目的:构建胃癌细胞模型,明确普萘洛尔与T1012G的协同杀伤效应及最优给药顺序。
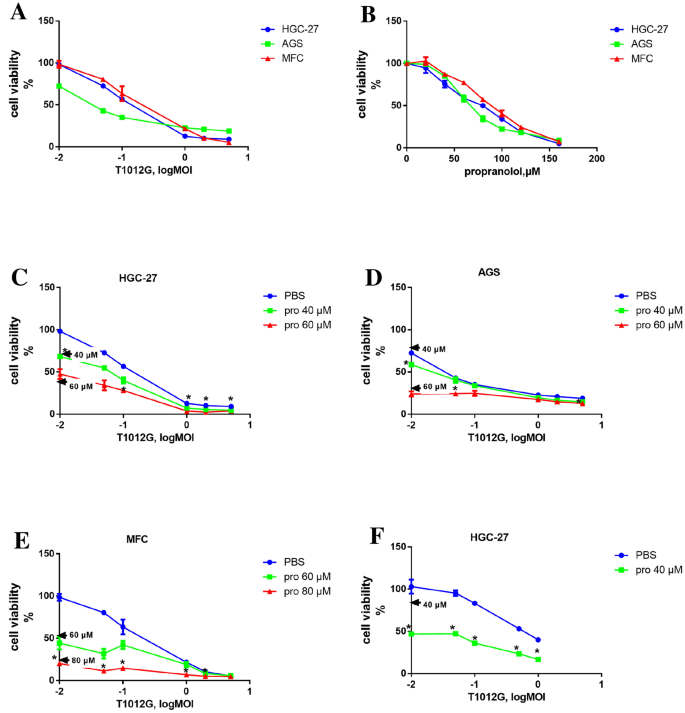
方法细节:采用人胃癌细胞HGC-27、AGS及小鼠胃癌细胞MFC,通过CCK8细胞增殖实验检测单药及联合用药的细胞活力,利用Chou-Talalay法计算联合指数(CI)评估协同效应,设置共处理、普萘洛尔预处理、病毒预处理三种给药顺序进行对比。
结果解读:HGC-27细胞中,普萘洛尔预处理使T1012G的IC50降低97.9%,病毒滴度较单药组提升7倍(n=3,P<0.001);预处理组的CI值显著低于共处理组(如0.01 MOI病毒时,CI=0.549 vs 1.023,n=3,P<0.05),证实预处理策略具有更强的协同杀伤效果。
实验所用关键产品:Sigma-Aldrich的普萘洛尔(货号P0884)、Dojindo的CCK8试剂盒、Cell Signaling Technology的STAT3及磷酸化STAT3抗体(货号12640、9145)、Abcam的PKR及磷酸化PKR抗体(货号32506、32036)。
3.2 体内外病毒增殖与抗肿瘤疗效验证
实验目的:验证普萘洛尔预处理对T1012G体内外增殖及胃癌肿瘤生长的调控作用。
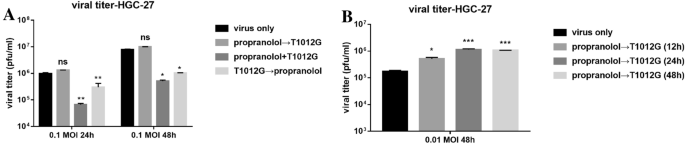
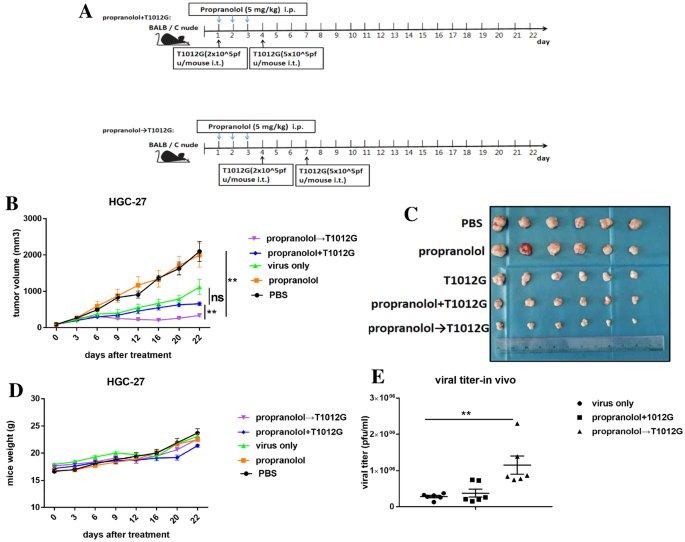
方法细节:体外采用空斑实验检测不同给药顺序下的病毒滴度;体内构建HGC-27细胞裸鼠移植瘤模型,分为空白对照组、普萘洛尔单药组、T1012G单药组、共处理组、预处理组,定期测量肿瘤体积,实验终点检测肿瘤组织中的病毒滴度。
结果解读:体外HGC-27细胞中,低剂量病毒(0.01 MOI)时普萘洛尔预处理12、24、48h后,病毒滴度分别提升3、7、6倍(n=3,P<0.05、P<0.001、P<0.001);体内模型中,预处理组肿瘤体积为335.3±36.92 mm³,显著小于T1012G单药组的1118±210.0 mm³(n=6,P<0.01),肿瘤组织中病毒滴度提升4倍(n=6,P<0.01),且小鼠体重无显著差异,证实联合治疗的安全性与有效性。
文献未提及具体实验产品,领域常规使用空斑实验用Vero细胞系、裸鼠移植瘤模型构建所需的细胞培养试剂等。
3.3 病毒蛋白表达与STAT3-PKR通路机制解析
实验目的:解析普萘洛尔预处理对病毒蛋白合成及STAT3-PKR信号轴的调控机制。
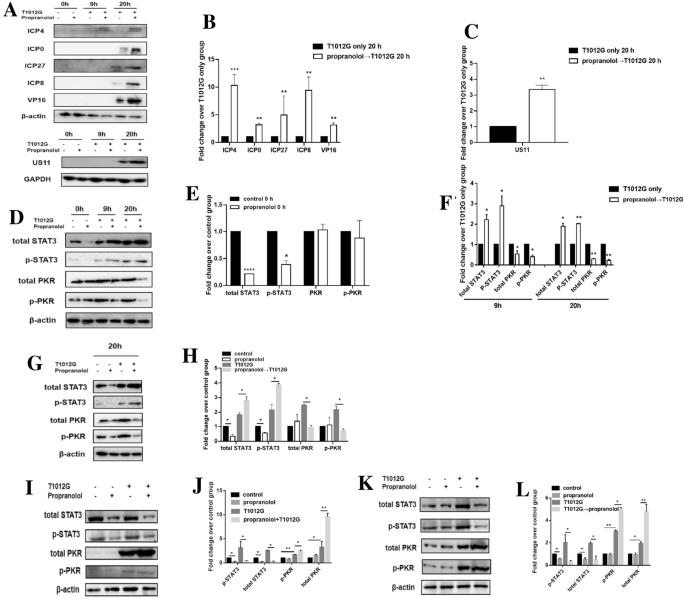
方法细节:采用免疫印迹(WB)检测不同感染时间点的病毒蛋白(即刻早期ICP4/ICP0/ICP27、早期ICP8、晚期VP16/US11)表达,以及STAT3、磷酸化STAT3(p-STAT3)、PKR、磷酸化PKR(p-PKR)的蛋白水平;通过siRNA敲低STAT3和质粒过表达STAT3,验证通路对病毒增殖的调控作用。
结果解读:预处理组中,即刻早期病毒蛋白ICP4、ICP0、ICP27分别提升10.3、3.2、5.0倍(n=3,P<0.001、P<0.01、P<0.01),早期ICP8提升9.4倍(n=3,P<0.01),晚期VP16、US11提升3.2、3.4倍(n=3,P<0.01);同时,p-STAT3提升2.9倍(n=3,P<0.05),p-PKR降低65.94%±10.11%(n=3,P<0.05);STAT3敲低后病毒滴度降低94.97%±0.30%(n=3,P<0.01),过表达后病毒滴度提升6倍(n=3,P<0.001),证实STAT3正向调控病毒增殖,负调控PKR的抗病毒作用。
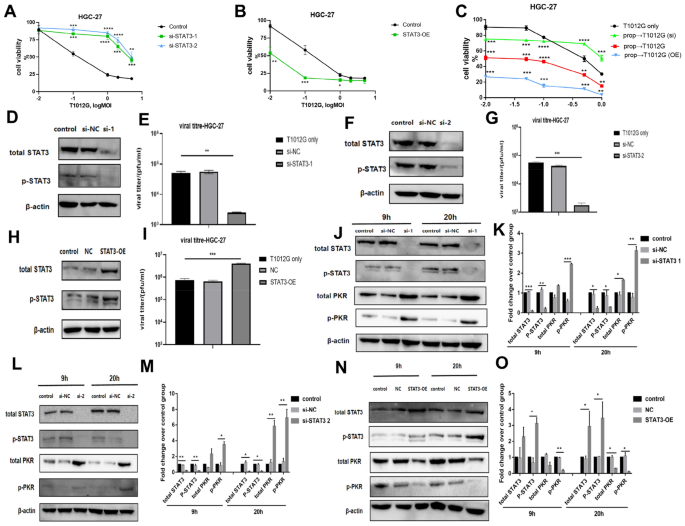
实验所用关键产品:Lipofectamine RNAiMAX转染试剂、Ribo-FECT TM CP转染试剂盒、HSV-1病毒蛋白特异性抗体(ICP4、ICP27等)。
3.4 I型干扰素通路逆转效应验证
实验目的:验证普萘洛尔预处理能否逆转I型干扰素(IFN-α/β)对病毒增殖的抑制作用。
方法细节:采用空斑实验检测IFN-α/β处理后,普萘洛尔对病毒滴度的影响;通过免疫印迹检测STAT3、PKR的蛋白水平变化;采用ELISA检测IFN-α/β的分泌水平。
结果解读:IFN-α/β处理使病毒增殖抑制>70%,普萘洛尔预处理后,病毒滴度较IFN-α组提升5.1倍(n=3,P<0.001),较IFN-β组提升4.6倍(n=3,P<0.01);同时,普萘洛尔逆转了IFN-α/β诱导的PKR激活(IFN-α组p-PKR降低92.57%±1.77%,n=3,P<0.001);病毒感染后IFN-α分泌随时间延长增加,普萘洛尔预处理进一步增强IFN-α分泌,进而促进STAT3激活,形成正向调控循环。
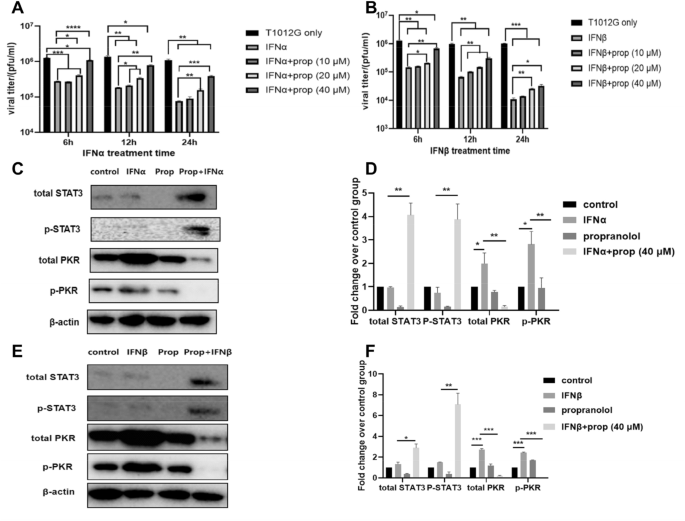
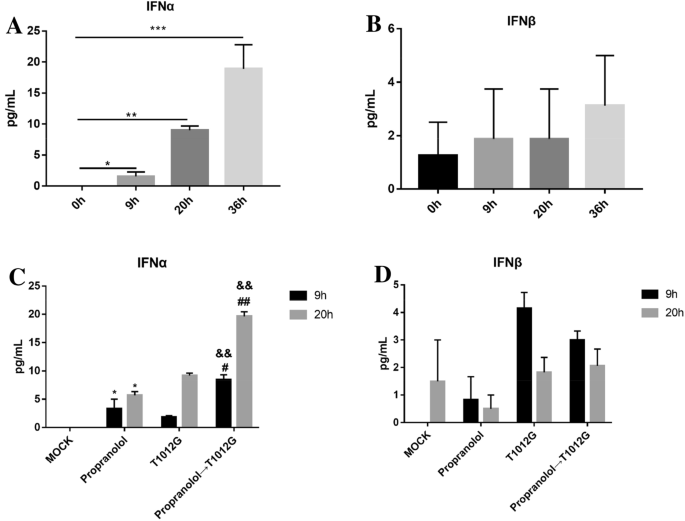
实验所用关键产品:CUSABIO的IFN-α ELISA试剂盒(货号CSB-E08636h)、Elabscience的IFN-β ELISA试剂盒(货号E-EL-H0085c)。
4. Biomarker研究及发现成果
本研究涉及的功能Biomarker为磷酸化STAT3(p-STAT3)和磷酸化PKR(p-PKR),筛选与验证逻辑为“细胞水平药物处理检测表达→基因操作验证功能→体内模型验证相关性→I型干扰素处理验证调控效应”的完整链条。Biomarker来源为胃癌细胞系及裸鼠移植瘤组织的蛋白样本,验证方法采用免疫印迹检测蛋白表达水平、空斑实验验证病毒增殖与Biomarker的关联、ELISA检测IFN-α分泌对Biomarker的调控作用。特异性与敏感性数据显示,p-STAT3在普萘洛尔预处理+病毒感染组较病毒单药组提升2.9倍(n=3,P<0.05),p-PKR降低65.94%±10.11%(n=3,P<0.05);在IFN-α处理组,普萘洛尔使p-PKR降低92.57%±1.77%(n=3,P<0.001)。核心成果方面,p-STAT3作为正向调控Biomarker,其激活水平与病毒增殖呈正相关,推测:STAT3过表达后病毒滴度提升6倍,可作为溶瘤病毒增殖增强的预测指标;p-PKR作为负向调控Biomarker,其抑制水平与病毒增殖呈正相关。本研究首次发现普萘洛尔可通过增强IFN-α分泌进而激活p-STAT3,抑制p-PKR的抗病毒作用,即使在I型干扰素存在的情况下仍能增强溶瘤病毒增殖,为胃癌溶瘤病毒治疗的联合策略提供了Biomarker指导,具有潜在的临床转化价值。
