1. 领域背景与文献引入
文献英文标题:Replication competent HIV-1 viruses that express intragenomic microRNA reveal discrete RNA-interference mechanisms that affect viral replication;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:病毒学与分子生物学(HIV-1与微小RNA的相互作用)
RNA干扰是从原生动物到哺乳动物都保守的基因表达调控机制,微小RNA(miRNA)作为RNA干扰通路的关键分子,通过引导RNA诱导沉默复合物靶向mRNA实现转录后调控。领域共识:人类细胞编码的miRNA可通过直接靶向病毒基因组或调控宿主蛋白参与HIV-1复制的调控,部分研究发现HIV-1的TAR RNA可被加工成miRNA样分子,但逆转录病毒能否自身编码并表达基因组内miRNA仍存在争议。有观点认为,Drosha和Dicer等RNA酶对miRNA的加工会破坏逆转录病毒的RNA基因组,使其丧失复制能力,而现有研究多基于慢病毒载体系统,未直接探讨复制型HIV-1基因组插入miRNA后的复制能力及机制,这一空白限制了对逆转录病毒与miRNA相互作用的深入理解。因此,本研究旨在构建携带基因组内miRNA的HIV-1分子克隆,验证其复制能力并解析miRNA影响病毒复制的具体机制,为逆转录病毒编码miRNA的可能性提供直接证据。
2. 文献综述解析
作者的文献综述以“逆转录病毒能否编码基因组内miRNA”为核心逻辑,先系统介绍RNA干扰通路及miRNA的生物发生过程,再从细胞miRNA对HIV-1的调控作用、逆转录病毒编码miRNA的争议、现有研究的局限性三个维度展开评述。现有研究已明确细胞miRNA可通过多种方式调控HIV-1复制,包括直接靶向病毒基因组的特定序列诱导沉默,或通过调控宿主细胞中Cyclin T1等病毒复制必需蛋白间接影响病毒生命周期;部分研究发现HIV-1感染细胞中存在病毒来源的miRNA样分子,如TAR RNA加工产物,但这类分子的功能及产生机制尚未完全阐明。现有研究的优势在于建立了细胞miRNA与HIV-1相互作用的基础框架,为进一步探索病毒自身编码miRNA提供了线索;局限性在于缺乏对复制型HIV-1基因组插入miRNA后的系统研究,无法明确逆转录病毒能否容纳并表达基因组内miRNA而保持复制能力,相关调控机制也未被揭示。本研究的创新价值在于首次构建了携带不同细胞miRNA的复制型HIV-1分子克隆,通过系统实验验证了部分重组病毒的复制能力,并揭示了两种截然不同的miRNA影响病毒复制的机制,直接证明逆转录病毒可以编码并表达基因组内miRNA而不丧失复制能力,填补了领域内的关键研究空白。
3. 研究思路总结与详细解析
本研究的核心目标是验证HIV-1基因组插入miRNA后是否仍具有复制能力,并解析miRNA调控病毒复制的具体机制;核心科学问题聚焦于逆转录病毒基因组能否容纳顺式嵌入的miRNA序列,以及miRNA通过何种途径影响病毒复制;技术路线遵循“构建重组克隆→验证miRNA表达→检测病毒感染性→解析调控机制→验证传播性感染”的闭环逻辑,系统验证了重组病毒的复制能力并揭示了两种不同的作用机制。
3.1 携带基因组内miRNA的HIV-1分子克隆构建
本环节的核心目标是构建插入不同细胞miRNA的HIV-1分子克隆,为后续研究提供实验模型。研究人员选择HIV-1 NL4-3分子克隆的Nef基因座作为miRNA插入位点,该基因座在培养的人类细胞中对病毒复制非必需,不会因插入序列影响病毒基本复制能力。研究人员共构建了8个重组克隆,包括5个生物信息学预测靶向HIV-1基因组的miRNA(miR28、miR29b、miR138、miR211、miR326)、2个不靶向HIV-1基因组的miRNA(let7a、miR329),以及一个无法形成miRNA发夹结构的scrambled let7a序列作为阴性对照。所有重组克隆均通过限制性内切酶酶切验证插入片段大小,并通过直接测序确认插入序列的正确性。

图1 插入miRNA的靶点预测及序列信息
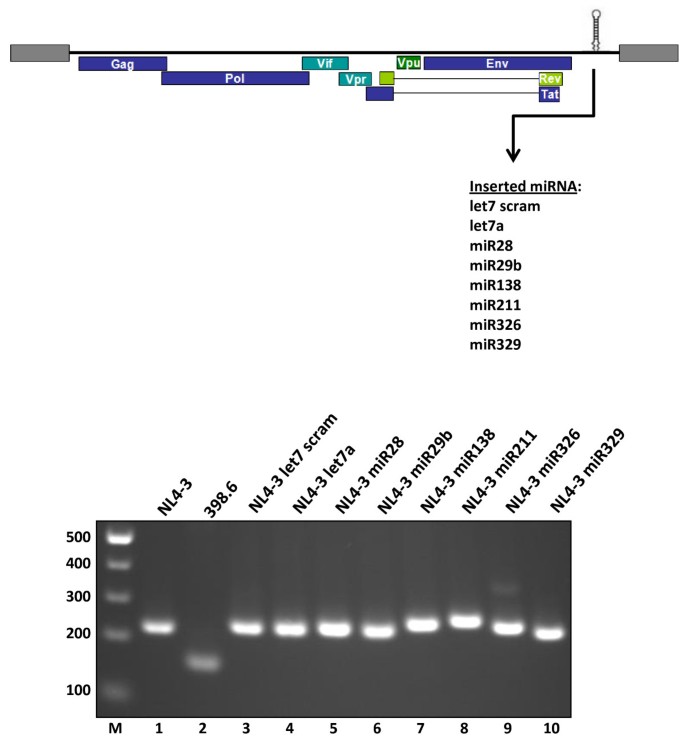
图2 重组HIV-1克隆的酶切验证结果
文献未提及具体实验产品,领域常规使用分子克隆相关试剂(如限制性内切酶、T4 DNA连接酶)、质粒提取试剂盒及DNA测序服务。
3.2 嵌合HIV-1克隆的miRNA表达检测
本环节的核心目标是验证插入的miRNA能否从HIV-1基因组中有效表达。研究人员将8个重组HIV-1分子克隆分别转染293T细胞,48小时后提取细胞总RNA,使用QuantiMiR qPCR试剂盒定量检测各miRNA的表达水平,以细胞内源性miR16作为内参,基于每细胞10pg RNA的假设计算每个细胞的miRNA拷贝数。结果显示,除let7a仅使细胞内miRNA拷贝数增加40个/细胞外,其余插入的miRNA均能有效表达,其中miR211的表达水平最高,达11597拷贝/细胞(n=3,P<0.01),miR138、miR326、miR28等miRNA的表达水平在100-1000拷贝/细胞之间,各重组克隆的miRNA表达水平与对照组相比均具有统计学显著性(n=3,P<0.05或P<0.01)。
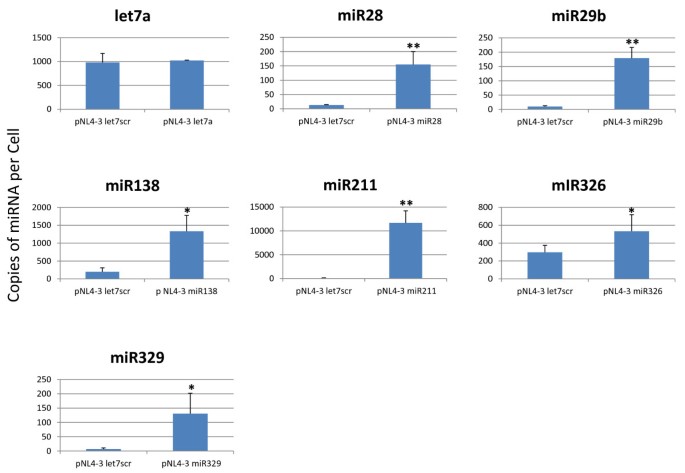
图3 重组HIV-1克隆在293T细胞中的miRNA表达水平
实验所用关键产品:QuantiMiR qPCR试剂盒(Systems Biosciences)。
3.3 基因组内miRNA对HIV-1单轮感染性的影响
本环节的核心目标是检测插入miRNA后HIV-1的单轮感染性变化。研究人员将各重组HIV-1分子克隆转染293T细胞,48小时后收集细胞上清,检测上清中的逆转录酶活性,取等量逆转录酶活性的上清感染TZMbl指示细胞,24小时后通过β-半乳糖苷酶实验计数蓝染细胞,计算相对感染性。结果显示,与阴性对照(NL4-3 let7 scr)相比,表达miR28、miR211、miR326的重组病毒感染性显著降低,分别降低49%、20%、57%(n=3,P<0.01或P<0.001),而表达let7a、miR29b、miR138、miR329的重组病毒感染性与对照组无显著差异。
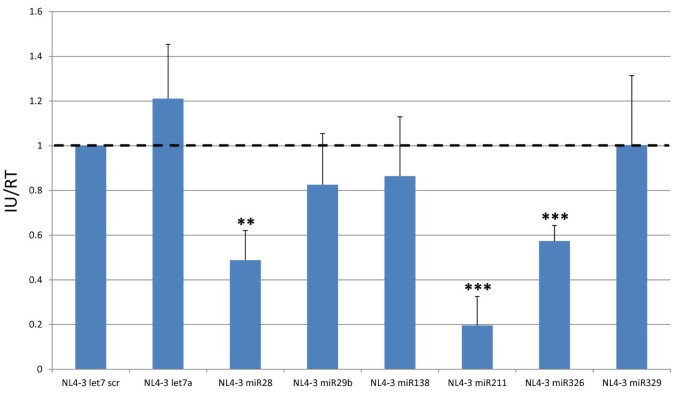
图4 重组HIV-1病毒的单轮感染性检测结果
文献未提及具体实验产品,领域常规使用TZMbl细胞系、β-半乳糖苷酶检测试剂盒及逆转录酶活性检测试剂。
3.4 miRNA影响HIV-1复制的机制研究
本环节的核心目标是解析miR211和miR326降低HIV-1感染性的具体机制。研究人员通过两组实验展开探讨:第一组为miRNA模拟物与抑制剂实验,将NL4-3 let7 scr与miR326模拟物共转染,结果显示对照病毒的感染性显著降低;将NL4-3 miR326与miR326抑制剂共转染,重组病毒的感染性显著恢复,说明miR326通过靶向HIV-1基因组的互补序列诱导沉默,从而抑制病毒复制。对于miR211,将NL4-3 let7 scr与miR211模拟物共转染不影响对照病毒感染性,将NL4-3 miR211与miR211抑制剂共转染也无法恢复重组病毒的感染性,提示miR211的作用机制并非靶向病毒基因组。第二组为Drosha和Dicer敲低实验,研究人员用siRNA分别敲低293T细胞中的Drosha、Dicer或EGFP(对照),24小时后转染重组HIV-1克隆,结果显示敲低Drosha可显著恢复NL4-3 miR211的感染性,而敲低Dicer无此效果;敲低Drosha或Dicer均可恢复NL4-3 miR326的感染性。qPCR验证结果显示,siRNA有效敲低了Drosha和Dicer的mRNA表达水平(n=3,P<0.01)。结合qPCR对病毒RNA的检测结果,NL4-3 miR211转染细胞中的全长病毒RNA水平显著降低,提示miR211的过度加工(Drosha介导的核内切割)破坏了病毒RNA基因组,导致其无法正常包装和翻译,从而抑制病毒复制。
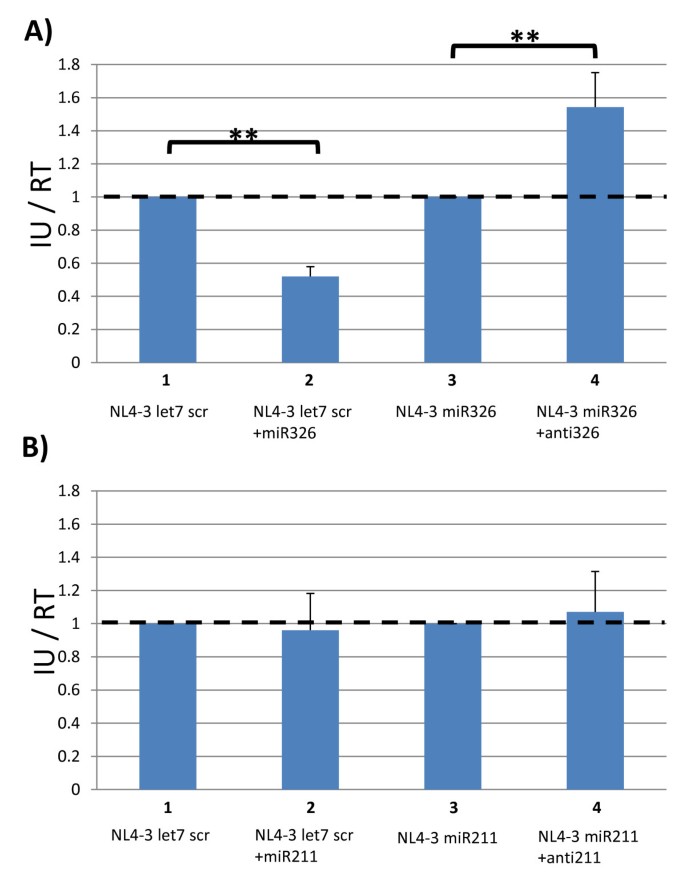
图5 miRNA模拟物与抑制剂对重组HIV-1感染性的影响
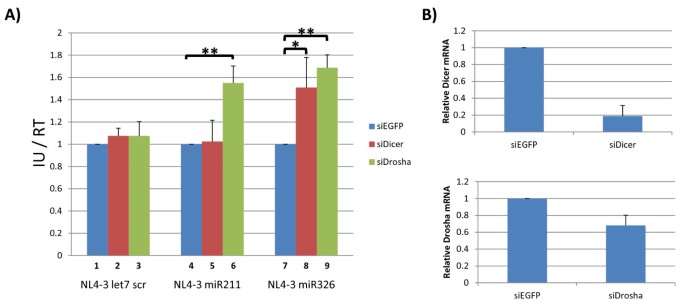
图6 Drosha和Dicer敲低对重组HIV-1感染性的影响
实验所用关键产品:siRNA(针对Drosha、Dicer、EGFP)、miRNA模拟物及抑制剂。
3.5 嵌合HIV-1病毒在T细胞中的传播性验证
本环节的核心目标是验证携带基因组内miRNA的HIV-1能否在T细胞中进行传播性感染。研究人员用NL4-3、NL4-3 let7 scr、NL4-3 let7a、NL4-3 miR211、NL4-3 miR326病毒分别感染Jurkat T细胞,在感染后2、4、6、8天收集细胞上清,检测逆转录酶活性以评估病毒复制水平。结果显示,NL4-3、NL4-3 let7 scr、NL4-3 let7a病毒的复制能力相似,均能在Jurkat T细胞中形成传播性感染;NL4-3 miR326病毒也能形成传播性感染,但第8天的逆转录酶活性比对照组降低50%(n=3,P<0.01);而NL4-3 miR211病毒无法在Jurkat T细胞中形成传播性感染,提示过度的Drosha加工对病毒复制的影响更为显著。
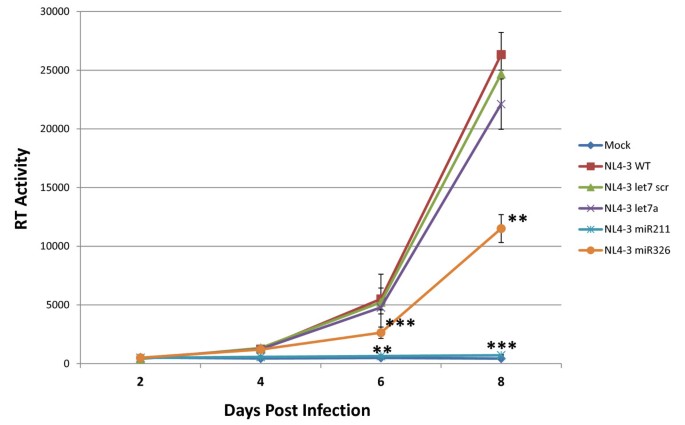
图7 重组HIV-1病毒在Jurkat T细胞中的传播性感染检测结果
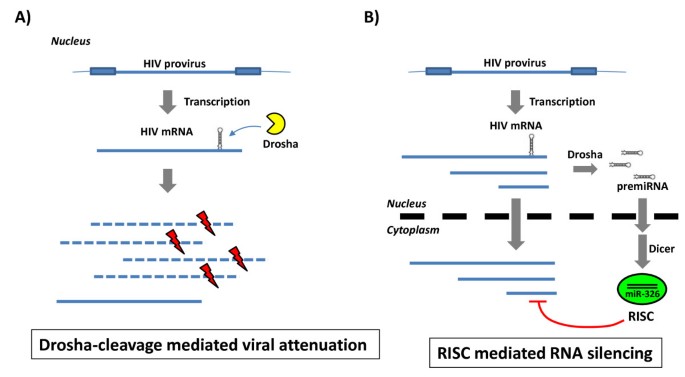
图8 miRNA影响HIV-1复制的两种机制模型
文献未提及具体实验产品,领域常规使用Jurkat T细胞系及逆转录酶活性检测试剂。
4. Biomarker研究及发现成果解析
本研究中涉及的Biomarker为人类细胞来源的miRNA(miR28、miR211、miR326等),筛选逻辑基于生物信息学预测,选择靶向或不靶向HIV-1基因组的miRNA,通过分子克隆插入HIV-1基因组后验证其表达及对病毒复制的调控作用。
研究过程中,这些miRNA均来自人类细胞基因组,通过qPCR技术验证其在重组HIV-1转染细胞中的表达水平,通过单轮感染性实验、miRNA模拟物/抑制剂实验、Drosha/Dicer敲低实验验证其对HIV-1复制的调控功能。其中miR326的特异性表现为靶向HIV-1基因组的互补序列,其抑制剂可恢复重组病毒的感染性;miR211的特异性表现为被Drosha高效加工,敲低Drosha可恢复重组病毒的感染性。敏感性数据显示,miR326可使HIV-1感染性降低57%(n=3,P<0.001),miR211可使感染性降低20%(n=3,P<0.01)。
核心成果方面,本研究首次明确了两种miRNA影响HIV-1复制的不同机制:miR326通过RNA干扰通路靶向病毒基因组抑制复制,miR211通过过度的Drosha加工破坏病毒RNA基因组抑制复制;同时证明携带基因组内miRNA的HIV-1(如NL4-3 let7a、NL4-3 miR326)可保持复制能力并在T细胞中形成传播性感染,为逆转录病毒自身编码miRNA提供了直接实验证据。这些成果拓展了对HIV-1与miRNA相互作用的理解,为开发基于miRNA的HIV-1治疗策略提供了新的思路。
