1. 领域背景与文献引入
文献英文标题:Lrp4 in hippocampal astrocytes serves as a negative feedback factor in seizures;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:神经科学-癫痫发病机制
领域共识:癫痫是全球最常见的神经系统疾病之一,影响超5000万人群,其核心特征是脑内存在持续的癫痫发作易感性,临床定义为间隔24小时以上的2次无诱因发作。现有治疗以抗癫痫药物为主,虽有25种以上药物获批,但仅约66%患者对治疗有响应,超过半数患者仍存在无法控制的发作,因此亟需从基因水平探索癫痫发作的调控机制,开发新的治疗靶点。星形胶质细胞作为脑内重要的胶质细胞,参与谷氨酸代谢、突触传递调控等多种生理过程,其功能异常与癫痫发作密切相关。此前研究发现低密度脂蛋白受体相关蛋白4(Lrp4)在小鼠海马星形胶质细胞区域化表达,可调控谷氨酸能传递,且Lrp4敲除小鼠的癫痫发作阈值升高,但Lrp4在癫痫发作过程中的动态调控机制尚未明确,这一研究空白成为本文的核心研究切入点。
2. 文献综述解析
作者在综述部分按“癫痫治疗现状-Lrp4的组织分布与功能-星形胶质细胞与癫痫的相互作用”的逻辑梳理现有研究。现有研究表明,癫痫发作的核心机制是神经元网络兴奋性与抑制性失衡,谷氨酸过度释放是关键诱因之一,星形胶质细胞通过摄取谷氨酸维持脑内谷氨酸稳态,其功能障碍会加剧癫痫发作;Lrp4作为低密度脂蛋白受体家族成员,在神经肌肉接头中是Agrin的核心受体,参与突触形成与维持,在脑内主要表达于海马星形胶质细胞,调控ATP释放进而影响谷氨酸能传递,但目前缺乏Lrp4与癫痫发作直接关联的研究。现有抗癫痫药物多靶向神经元离子通道或神经递质受体,针对星形胶质细胞的治疗靶点研究不足,且Lrp4在癫痫发作过程中的表达调控机制尚未阐明。本文的创新价值在于首次揭示癫痫发作时谷氨酸通过激活星形胶质细胞N-甲基-D-天冬氨酸(NMDA)受体上调miR-351-5p,进而下调Lrp4表达,而Lrp4下调可通过负反馈机制提高癫痫发作阈值,填补了Lrp4在癫痫调控领域的研究空白,为癫痫治疗提供了新的潜在靶点。
3. 研究思路总结与详细解析
整体研究框架为“提出假设-体内外实验验证调控通路-动物模型验证功能”,核心科学问题是明确Lrp4在癫痫发作中的动态变化及调控机制,验证Lrp4作为负反馈因子的功能。
3.1 体内癫痫模型中Lrp4表达变化检测
实验目的:验证癫痫发作是否会影响小鼠海马组织中Lrp4的表达水平。方法细节:采用匹罗卡品诱导小鼠癫痫发作模型,在注射后0、2、4、12小时分别处死小鼠(n=3/组),取海马组织,通过实时荧光定量PCR(qRT-PCR)检测Lrp4的mRNA水平,利用Lrp4-lacZ/+杂合子小鼠进行X-半乳糖苷酶染色观察Lrp4的活性分布,通过蛋白质免疫印迹(Western blot)检测Lrp4的蛋白水平。结果解读:qRT-PCR结果显示,与对照组相比,匹罗卡品处理后2小时Lrp4 mRNA水平开始显著下降,且下降趋势持续至12小时(n=3,P<0.01);X-半乳糖苷酶染色结果显示,海马腔隙分子层(LMol)和分子层(Mol)(主要为星形胶质细胞分布区域)的Lrp4活性显著降低;Western blot结果显示,Lrp4蛋白水平在4小时开始显著下降,晚于mRNA的变化时间(n=3,P<0.01)。这些结果表明癫痫发作可在体内显著下调海马组织中Lrp4的表达(包括mRNA和蛋白水平)。
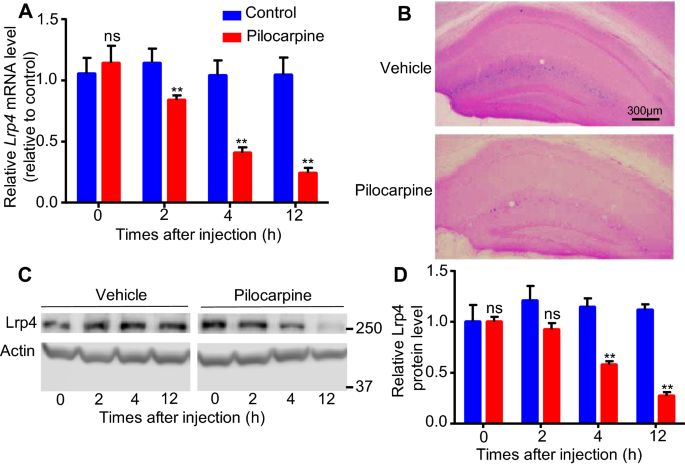
产品关联:文献未提及具体实验产品,领域常规使用qRT-PCR试剂盒、X-半乳糖苷酶染色试剂盒、蛋白质免疫印迹相关抗体与试剂等。
3.2 谷氨酸对星形胶质细胞Lrp4的调控机制
实验目的:模拟癫痫发作时谷氨酸过度释放的状态,明确其对星形胶质细胞Lrp4表达的调控及信号通路。方法细节:原代培养小鼠海马星形胶质细胞,用0.5mM谷氨酸处理0、2、4、12小时,检测Lrp4的mRNA和蛋白水平;同时设置谷氨酸联合NMDA受体拮抗剂AP5(50mM)处理组,观察AP5对谷氨酸调控Lrp4的影响。结果解读:谷氨酸处理后2小时,Lrp4 mRNA水平下降约30%,12小时下降约60%(n=3,P<0.01);蛋白水平在4小时下降约30%,12小时下降约50%(n=3,P<0.01);联合AP5处理后,12小时Lrp4 mRNA仅下降约20%,蛋白下降约25%,显著低于单独谷氨酸处理组(n=3,P<0.01)。这表明谷氨酸通过激活星形胶质细胞NMDA受体下调Lrp4的表达。
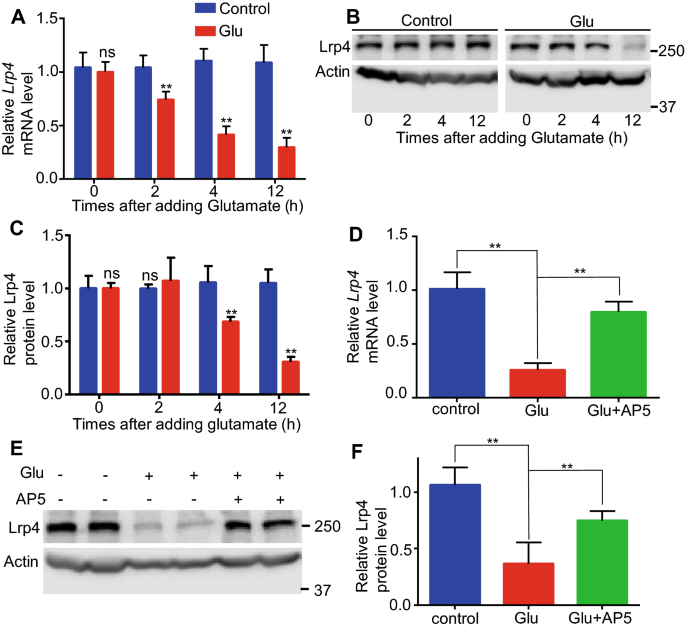
产品关联:文献未提及具体实验产品,领域常规使用原代细胞培养试剂、谷氨酸、AP5等。
3.3 miR-351-5p介导谷氨酸对Lrp4的下调作用
实验目的:明确miR-351-5p是否为谷氨酸下调Lrp4的关键调控分子。方法细节:通过TargetScan网站预测靶向Lrp4的miRNA,体内检测匹罗卡品处理后海马组织中候选miRNA的表达,体外检测谷氨酸处理后星形胶质细胞中miR-351-5p的水平;将miR-351-5p模拟物(50nM)或抑制剂(50nM)转染至星形胶质细胞,检测Lrp4的表达变化;同时检测AP5对谷氨酸诱导miR-351-5p升高的影响。结果解读:体内实验显示,匹罗卡品处理后2小时,海马组织中miR-351-5p水平升高约6倍,且持续至12小时(n=3,P<0.01);体外实验显示,谷氨酸处理后2小时,星形胶质细胞中miR-351-5p水平升高约7倍(n=3,P<0.01),AP5可部分抑制该升高;转染miR-351-5p模拟物后,Lrp4 mRNA水平下降约70%(50nM,n=3,P<0.01),蛋白水平显著降低;转染miR-351-5p抑制剂后,谷氨酸诱导的Lrp4下调被显著逆转,12小时mRNA仅下降约25%(n=3,P<0.01)。这些结果表明miR-351-5p介导了谷氨酸对Lrp4的下调作用。
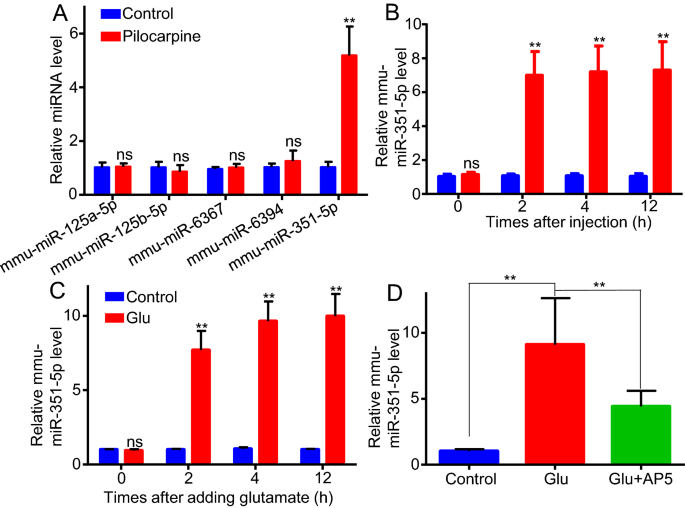
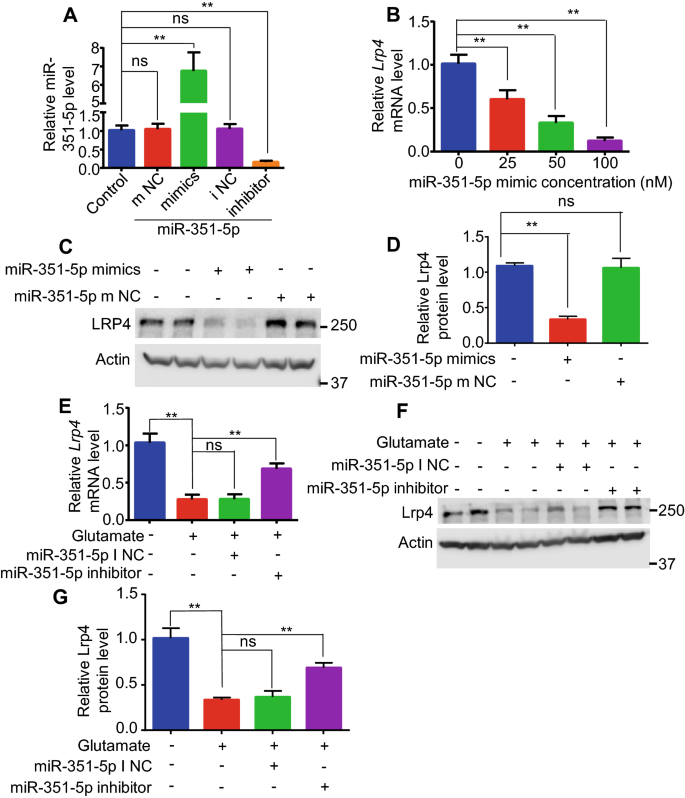
产品关联:实验所用关键产品:miR-351-5p模拟物、抑制剂(Ribobio,中国广州),Lipofectamine3000转染试剂(Invitrogen,美国)。
3.4 海马Lrp4下调对癫痫发作阈值的影响
实验目的:验证海马组织中Lrp4下调是否可提高小鼠的癫痫发作阈值。方法细节:通过立体定向注射shLrp4慢病毒至小鼠海马LMol和Mol层,2周后检测海马组织中Lrp4的蛋白水平以验证敲低效率;随后用匹罗卡品(初始200mg/kg,后续每30分钟注射100mg/kg)或戊四氮(PTZ)诱导癫痫发作,观察小鼠的发作评分及全面性惊厥发作潜伏期。结果解读:Western blot结果显示,shLrp4慢病毒注射后,海马组织中Lrp4蛋白水平下降约70%(n=3,P<0.01);匹罗卡品处理后,对照组小鼠在第5次注射后达到5级发作(剧烈抽搐、倒地、死亡),而shLrp4组小鼠在第9次注射后仍未达到5级发作(n=10,P<0.01);PTZ处理后,shLrp4组小鼠的全面性惊厥发作潜伏期显著长于对照组(n=10,P<0.01)。这些结果表明海马组织中Lrp4下调可显著提高小鼠的癫痫发作阈值。
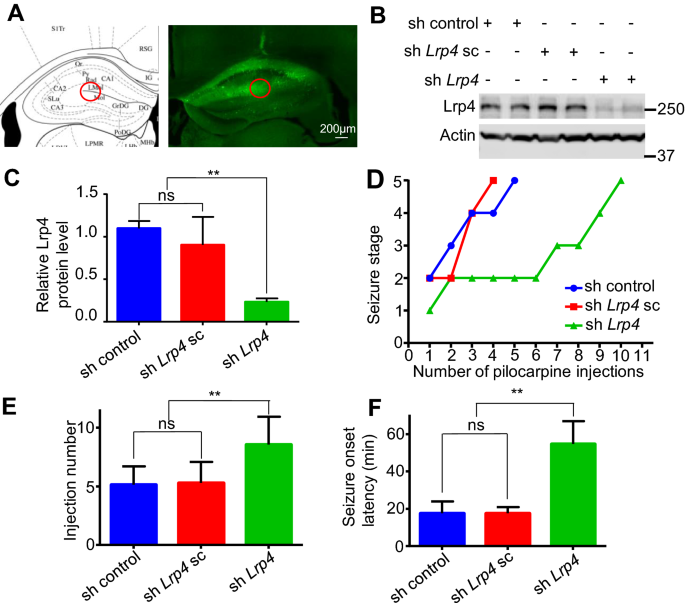
产品关联:文献未提及具体实验产品,领域常规使用慢病毒载体、立体定向注射系统等。
4. Biomarker研究及发现成果解析
Biomarker定位:本文涉及的生物标志物为分子标志物Lrp4和miR-351-5p,筛选与验证逻辑为:基于癫痫发作时谷氨酸过度释放的已知机制,结合Lrp4在海马星形胶质细胞的表达特性,通过生物信息学预测靶向Lrp4的miRNA,再通过体内外实验验证两者在癫痫发作中的表达变化及调控关系,最后在动物模型中验证Lrp4的功能。
研究过程详述:Lrp4的来源为小鼠海马组织及原代培养的海马星形胶质细胞,验证方法包括实时荧光定量PCR、蛋白质免疫印迹、X-半乳糖苷酶染色;miR-351-5p的来源为小鼠海马组织及原代星形胶质细胞,验证方法为茎环实时荧光定量PCR。特异性与敏感性数据显示,Lrp4在癫痫发作后2小时mRNA显著下降,4小时蛋白水平下降,具有时间依赖性;miR-351-5p在发作后2小时显著升高,与Lrp4的表达呈负相关。
核心成果提炼:Lrp4作为癫痫发作的负反馈因子,下调其表达可显著提高癫痫发作阈值,首次揭示miR-351-5p介导谷氨酸对Lrp4的调控通路,为癫痫治疗提供了新的潜在靶点;研究未提供Lrp4作为预后标志物的风险比数据,体内实验每组样本量为n=3或n=10,所有统计学结果均为P<0.01。
