1. 领域背景与文献引入
文献英文标题:Metabolomics of blood reveals age-dependent pathways in Parkinson’s Disease;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:神经退行性疾病(帕金森病)代谢组学生物标志物研究。
领域共识:帕金森病是全球第二大神经退行性疾病,《全球疾病负担研究》显示当前全球患者约620万,预计2040年将增至1300万。领域发展关键节点包括α-突触核蛋白聚集与帕金森病病理关联的广泛证实,但发病机制涉及的蛋白错误折叠、线粒体损伤、氧化应激及炎症等多环节尚未完全阐明。当前研究热点聚焦于早期诊断生物标志物的开发,现有诊断依赖震颤等运动症状出现,此时黑质多巴胺能神经元已发生大量丢失,而亚临床阶段的非特异性症状(抑郁、睡眠障碍、嗅觉减退)因缺乏针对性诊断手段常被忽视,导致诊断滞后于病理进程。未解决的核心问题在于,年龄是帕金森病的重要风险因素,亚临床症状可早于运动症状20年出现,但现有代谢组学研究尚未发现代谢物与帕金森病诊断及年龄的显著关联,缺乏个性化年龄依赖的早期诊断生物标志物。
本文针对这一空白,旨在通过分析血液代谢组特征,筛选具有年龄依赖模式的帕金森病差异代谢物及通路,为开发个性化早期诊断生物标志物提供依据,其学术价值在于填补了年龄因素与帕金森病代谢异常关联研究的空白,有望推动帕金森病早诊范式的革新。
2. 文献综述解析
作者对领域内现有研究的分类维度主要包括样本类型(血液、唾液、脑脊液、皮脂)、代谢通路类型(肉碱穿梭、支链氨基酸降解、脂肪酸生物合成等)以及是否关联年龄因素三个层面。现有研究的关键结论显示,帕金森病与支链氨基酸、色氨酸、脂质、能量代谢及氧化应激/氧化还原稳态等多条代谢通路的异常相关;技术方法优势在于代谢组学能够反映体内整合遗传、表观遗传及生活方式因素的生理状态,为疾病病理机制研究提供全景视角;但现有研究存在明显局限性,多数研究未发现参与代谢通路的代谢物与帕金森病诊断及年龄存在显著关联,且缺乏针对年龄依赖的帕金森病生物标志物的系统性研究,无法满足个性化早期诊断的需求。
通过对比现有研究的未解决问题,本文的创新价值凸显:首次采用监督机器学习结合无监督统计分析的整合策略,筛选出具有年龄依赖模式的帕金森病血液代谢物,并区分出三类具有不同年龄关联特征的代谢通路,为帕金森病的个性化早期诊断提供了全新的研究方向,弥补了现有研究在年龄因素与代谢异常关联分析中的不足。
3. 研究思路总结与详细解析
整体框架概括:本文的研究目标是筛选具有年龄依赖模式的帕金森病血液代谢物,开发个性化早期诊断生物标志物;核心科学问题是明确帕金森病代谢异常与年龄因素的关联机制;技术路线遵循“队列建立→代谢组检测→机器学习筛选→年龄相关性分析→通路富集验证”的闭环逻辑,确保研究结果的可靠性与科学性。
3.1 研究队列建立与样本制备
实验目的是构建匹配度良好的帕金森病患者与健康对照队列,减少混杂因素对代谢组分析的干扰。方法细节:连续纳入39名帕金森病患者和39名健康对照,所有研究对象均遵循地中海饮食;帕金森病患者符合运动障碍协会(MDS)临床确诊标准,简易精神状态检查(MMSE)评分≥24,临床痴呆评定量表(CDR)评分≤6,且接受左旋多巴治疗至少3个月;样本收集于清晨8:00-8:30,研究对象需空腹8-10小时,采集肘静脉血至EDTA管,立即离心制备血浆并保存于-80℃,随后送至Biocrates实验室采用MxP® Quant 500试剂盒定量检测630种内源性代谢物,排除与帕金森病治疗直接相关的左旋多巴和酪氨酸。实验所用关键产品:MxP® Quant 500试剂盒(Biocrates)、QTRAP® 5500质谱仪(AB Sciex)。结果解读:两组研究对象的年龄、体重指数(BMI)无显著差异(P=0.054、P=0.194),帕金森病组MMSE评分略低于对照组(P=0.047),性别比例为男:女=2:1,与帕金森病男性患病率较高的领域共识一致,吸烟、学历、饮酒、高血压等其他混杂因素在两组间无显著差异,表明队列匹配良好,可有效减少非目标因素的干扰。
3.2 差异代谢物筛选模型构建
实验目的是筛选能够有效区分帕金森病患者与健康对照的差异代谢物,并验证模型的可靠性。方法细节:首先对代谢组数据进行零均值和单位方差预处理,分别采用偏最小二乘判别分析(PLS-DA)和正交偏最小二乘判别分析(OPLS)构建分类模型,通过置换检验、Bootstrap验证及K折交叉验证评估模型性能并避免过拟合;随后采用四步筛选策略确定显著差异代谢物:(1)在80%训练集中筛选变量投影重要性(VIP)>1且载荷|L|>0.04(P<0.05)的代谢物,通过受试者工作特征(ROC)曲线分析验证模型区分能力;(2)通过1000次Bootstrap重复训练,筛选VIP>1占比超过95%的代谢物,排除受统计波动影响的参数;(3)采用主成分分析(PCA)提取贡献80%总方差的主成分,筛选PCA系数|cj|>0.9max|ci|的代谢物;(4)合并前两步筛选结果,确定最终的显著差异代谢物。结果解读:OPLS模型(3个正交成分+1个预测成分)表现最优,模型拟合度R²Y=0.83,预测能力Q²=0.57,Bootstrap验证P值为9×10^-4,且随机置换标签后R²Y显著降低,证实模型无过拟合;最终筛选出33种显著差异代谢物,ROC曲线下面积(AUC)为0.97(95%置信区间0.972-1.0),表明模型具有极佳的帕金森病与健康对照区分能力。
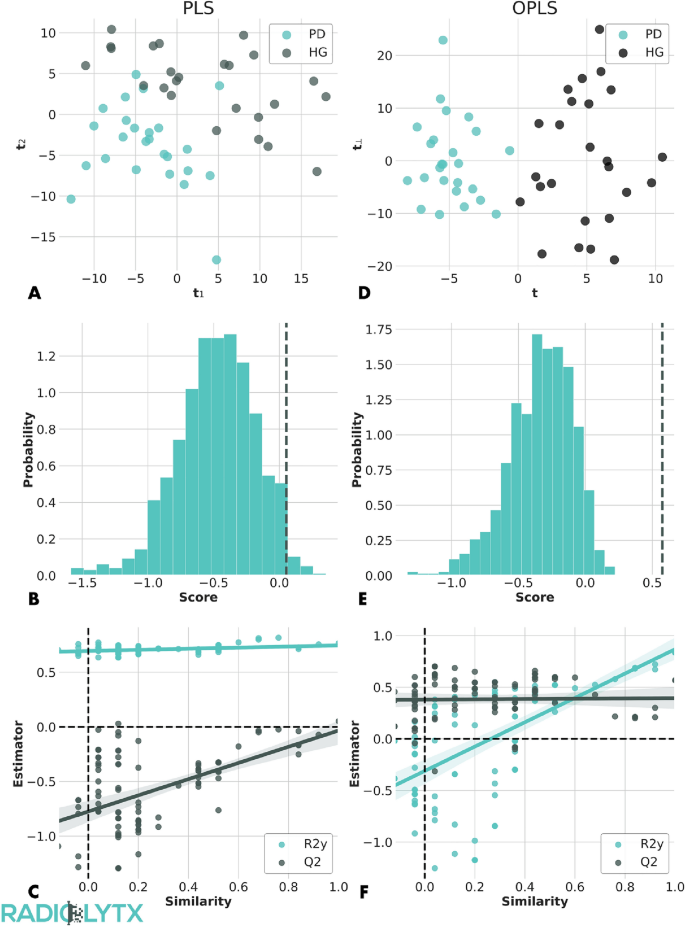
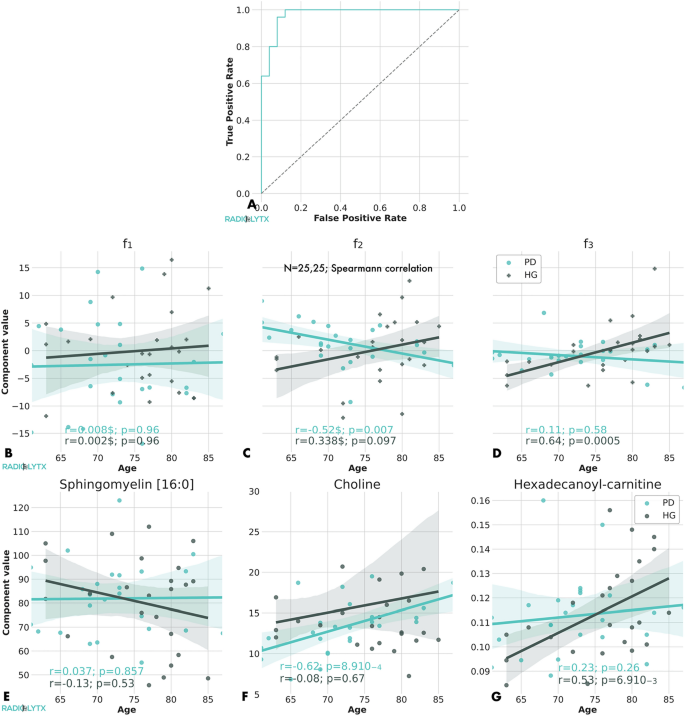
3.3 代谢物年龄相关性分析
实验目的是明确筛选出的差异代谢物与年龄因素的关联模式,区分帕金森病患者与健康对照的年龄依赖特征。方法细节:采用Spearman相关性分析主成分与研究对象年龄的关系,通过Bonferroni校正处理多重比较问题,筛选相关系数|r|>0.5(P<0.05/Npca)的显著主成分,并验证对应代谢物的年龄相关性。结果解读:筛选出的主成分可分为三类年龄关联模式:第一类主成分f0、f1、f4与帕金森病患者及健康对照的年龄均无显著关联;第二类主成分f2(贡献21%总方差)与帕金森病患者年龄呈显著负相关(r=-0.52,P=0.007),但与健康对照年龄无显著关联;第三类主成分f3(贡献11%总方差)与健康对照年龄呈显著正相关(r=0.64,P=5.6×10^-4),但与帕金森病患者年龄无显著关联。鞘磷脂C16:0、胆碱、十六烷酰肉碱分别是三类模式的代表性代谢物。
3.4 代谢通路富集验证
实验目的是解析差异代谢物所属的代谢通路,明确不同年龄关联模式对应的通路特征。方法细节:采用MetaboAnalyst 4.0软件进行京都基因与基因组百科全书(KEGG)通路富集分析,分别对整体差异代谢物及不同年龄关联组的代谢物进行富集分析,验证通路的显著性。结果解读:整体差异代谢物富集于三条核心通路,且对应不同的年龄关联模式:甘氨酸-丝氨酸-苏氨酸代谢通路的代谢物仅与帕金森病患者的年龄相关;不饱和脂肪酸生物合成通路的代谢物仅与健康对照的年龄相关;色氨酸代谢通路的代谢物与帕金森病相关,但与年龄无显著关联。
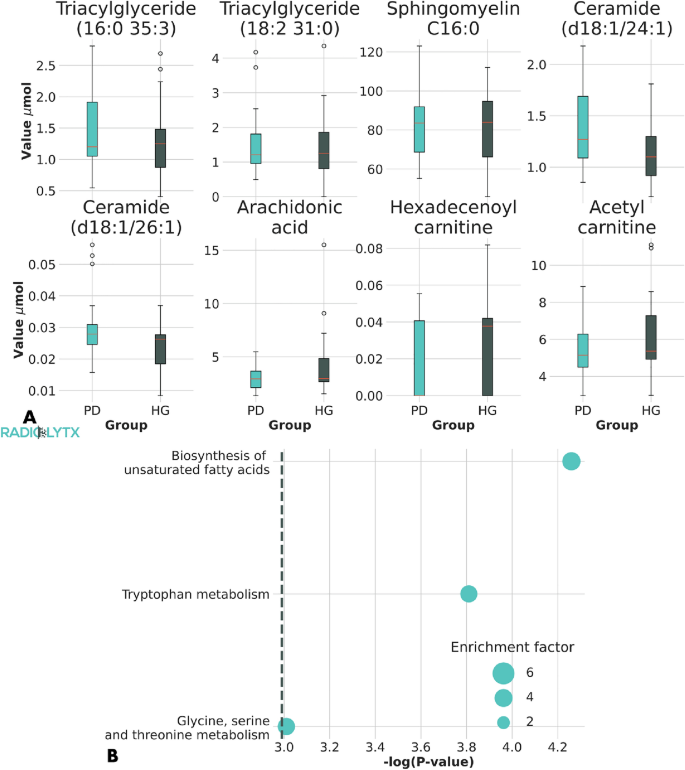
4. Biomarker研究及发现成果解析
Biomarker定位:本文筛选出的33种血液代谢物为潜在的帕金森病生物标志物,其筛选与验证逻辑遵循“机器学习模型初筛→Bootstrap重复验证→PCA特征提取→年龄相关性分析”的完整链条,确保了生物标志物的可靠性与特异性;根据年龄关联模式可分为三类:与帕金森病年龄相关、与健康对照年龄相关、与帕金森病相关但与年龄无关。
研究过程详述:这些生物标志物来源于空腹血浆样本,采用液相色谱-串联质谱(LC-MS/MS)和流动注射串联质谱(FIA-MS/MS)进行定量检测;特异性与敏感性数据显示,基于33种代谢物构建的OPLS模型ROC曲线AUC为0.97(95%置信区间0.972-1.0),样本量n=78(39名帕金森病患者、39名健康对照),具有极佳的疾病区分能力。
核心成果提炼:第一类与帕金森病患者年龄负相关的代谢物属于甘氨酸-丝氨酸-苏氨酸代谢通路,代表性代谢物如胆碱,提示该通路参与帕金森病的年龄依赖神经退行性过程,推测:该通路的年龄依赖异常可能通过影响线粒体功能和神经递质合成参与帕金森病的发病,需进一步动物实验验证;第二类与健康对照年龄正相关的代谢物属于不饱和脂肪酸生物合成通路,帕金森病患者该通路的年龄关联消失,提示帕金森病患者的脂质代谢已发生病理性改变,无法维持正常的年龄依赖调控;第三类与帕金森病相关但与年龄无关的代谢物属于色氨酸代谢通路,其代谢产物如犬尿氨酸参与α-突触核蛋白聚集和神经毒性,是帕金森病病理过程的核心环节。此外,筛选出的代谢物还包括酰基肉碱、神经酰胺、胆固醇酯等,其中酰基肉碱水平降低与线粒体β-氧化缺陷相关,神经酰胺水平升高参与帕金森病的细胞凋亡调控,这些代谢物为帕金森病的个性化早期诊断提供了潜在的生物标志物组合。
