1. 领域背景与文献引入
文献英文标题:Characterization of novel interactions with membrane NEU1 highlights new regulatory functions for the Elastin Receptor Complex in monocyte interaction with endothelial cells;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:心血管生物学(血管重塑与炎症免疫调控)
血管重塑是多数心血管疾病的病理基础,涉及细胞外基质(ECM)的重组与降解。弹性蛋白作为血管壁ECM的主要成分,不仅维持血管的强度与弹性,其降解产生的弹性蛋白衍生肽(EDP)还通过弹性蛋白受体复合物(ERC)介导多种病理生理效应。领域共识:近十年研究表明,ERC的NEU1亚基(神经氨酸酶-1)在EDP介导的血管与代谢疾病中发挥关键作用,通过去唾液酸化调控膜糖蛋白功能,参与细胞迁移、黏附等过程。当前研究热点聚焦于NEU1的新相互作用靶点及其调控机制,但尚未明确NEU1如何通过ERC调控单核细胞与内皮细胞的相互作用,这是动脉粥样硬化等炎症性血管疾病早期阶段的关键事件,存在研究空白。因此,本研究旨在验证NEU1与β₂整合素、细胞间黏附分子-1(ICAM-1)的相互作用,并解析其对单核细胞-内皮细胞相互作用的调控机制,为血管重塑相关疾病的干预提供新靶点。
2. 文献综述解析
作者按“ECM重塑-EDP产生-ERC介导信号-NEU1功能”的时间线与分子通路维度,系统梳理了领域内现有研究。现有研究的关键结论包括:弹性蛋白降解产生的EDP主要通过ERC发挥生物学效应,NEU1作为ERC的信号转导亚基,通过去唾液酸化调控整合素、受体酪氨酸激酶等膜蛋白功能,参与心血管、代谢等疾病进程;技术方法上,已有研究采用蛋白质组学筛选NEU1的相互作用蛋白,如CD36,并验证了其对巨噬细胞摄取氧化低密度脂蛋白的调控作用,但这些研究多聚焦于单一细胞类型的单一靶点,缺乏对细胞间相互作用的系统研究;局限性在于,尚未阐明NEU1如何通过ERC调控单核细胞与内皮细胞的黏附及跨内皮迁移,而这是炎症性血管疾病早期单核细胞招募的核心环节。本研究的创新价值在于,首次在单核细胞中验证NEU1与β₂整合素的相互作用,在内皮细胞中验证NEU1与ICAM-1的相互作用,并揭示了EDP-ERC-NEU1轴通过去唾液酸化调控这两种膜蛋白,进而促进单核细胞黏附与跨内皮迁移的共同作用机制,填补了ERC在细胞间相互作用调控领域的研究空白。
3. 研究思路总结与详细解析
本研究的整体框架为:以“蛋白质组学筛选的NEU1候选相互作用蛋白”为切入点,核心目标是明确NEU1与β₂整合素、ICAM-1的相互作用及对单核细胞-内皮细胞相互作用的调控机制;核心科学问题是EDP结合ERC后,NEU1如何通过去唾液酸化调控β₂整合素和ICAM-1的功能;技术路线遵循“候选靶点验证→分子机制解析→功能效应验证→通路阻断确认”的闭环逻辑。
3.1 单核细胞中NEU1与β₂整合素的相互作用验证
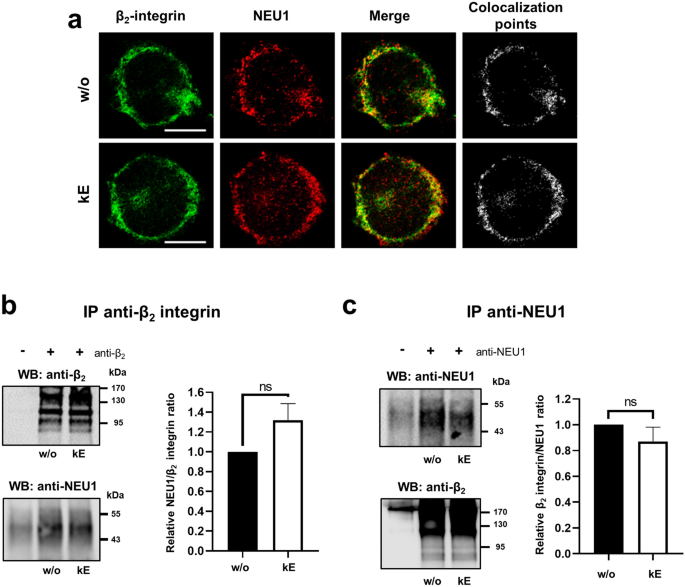
实验目的:验证NEU1与β₂整合素在人单核细胞中的共定位及相互作用,并明确EDP对该相互作用的影响。
方法细节:采用人单核细胞系THP-1,通过免疫荧光共聚焦显微镜观察NEU1与β₂整合素的亚细胞定位;采用免疫共沉淀(co-immunoprecipitation)实验,分别以抗β₂整合素和抗NEU1抗体进行免疫沉淀,检测共沉淀的蛋白;实验中设置EDP(κE,50μg/mL)刺激组与对照组,刺激时间为1小时。
结果解读:共聚焦显微镜结果(图1)显示,β₂整合素主要定位于细胞膜,NEU1同时存在于细胞内与细胞膜,两者在细胞膜处共定位,EDP刺激不改变其共定位模式;免疫共沉淀结果显示,NEU1与β₂整合素在基础状态下即存在相互作用,EDP刺激后共沉淀的NEU1有增加趋势但无统计学显著性(p=0.0821,n=6)。
产品关联:实验所用关键产品:Santa Cruz Biotechnology的兔多克隆抗NEU1抗体(H-300)、小鼠单克隆抗NEU1抗体(F-8);Merck的小鼠单克隆抗β₂整合素抗体(MEM48);LI-COR的Odyssey Fc扫描仪用于蛋白条带可视化。
3.2 EDP通过NEU1调控β₂整合素的去唾液酸化
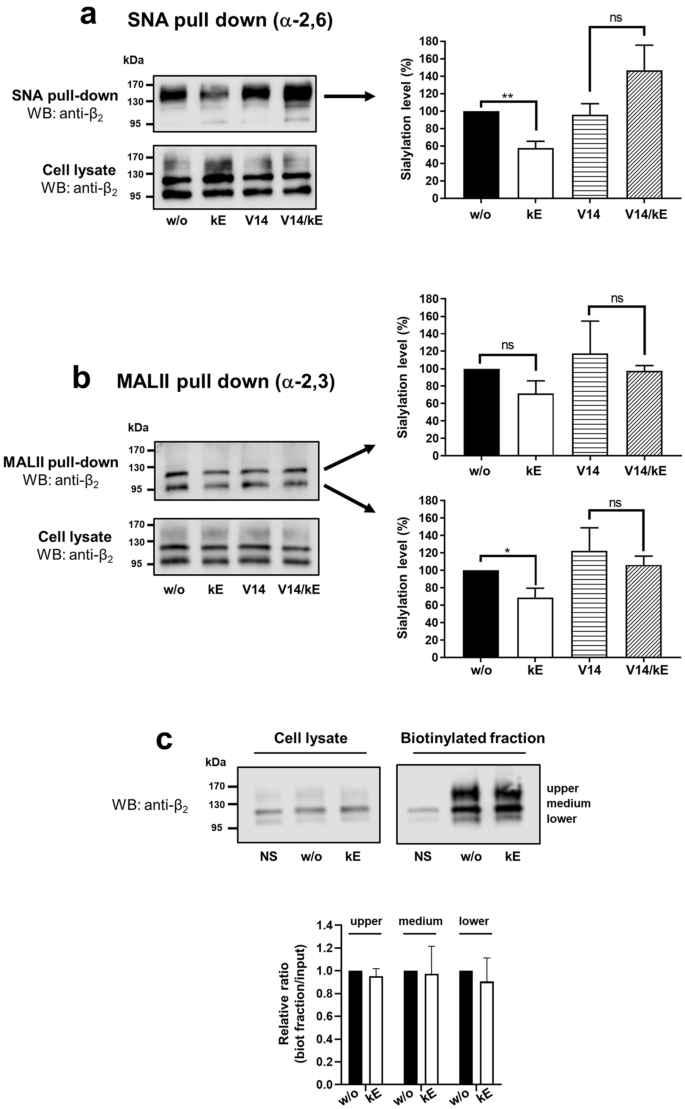
实验目的:明确EDP是否通过ERC-NEU1轴调控β₂整合素的唾液酸化水平。
方法细节:采用凝集素下拉实验,分别用接骨木凝集素(SNA,识别α-2,6唾液酸)和马疫链球菌凝集素II(MALII,识别α-2,3唾液酸)富集唾液酸化的β₂整合素;设置κE刺激组、V14肽(阻断EDP与ERC结合)预处理组、DANA(广谱神经氨酸酶抑制剂)预处理组;通过蛋白质免疫印迹检测不同条带的唾液酸化水平,并用密度分析定量。
结果解读:结果(图2)显示,基础状态下β₂整合素的不同条带唾液酸化模式不同,~150kDa条带主要为α-2,6唾液酸化,~100kDa和~120kDa条带主要为α-2,3唾液酸化;κE刺激后,~150kDa条带的唾液酸化水平显著降低42.1±7.7%(n=4,P<0.01),~100kDa条带显著降低31.1±10.6%(n=4,P<0.05);V14肽预处理可完全阻断该效应,表明依赖于ERC;细胞表面蛋白生物素化实验显示,EDP刺激不改变β₂整合素的细胞膜表达水平。
产品关联:实验所用关键产品:Vector laboratories的生物素化SNA和MALII凝集素;ThermoScientific的EZLink® sulfo-NHS-LC-biotin用于细胞表面蛋白生物素化;Sigma的DANA(广谱神经氨酸酶抑制剂);Genecust合成的V14肽(纯度99%)。
3.3 单核细胞中NEU1调控β₂整合素对内皮细胞黏附的影响
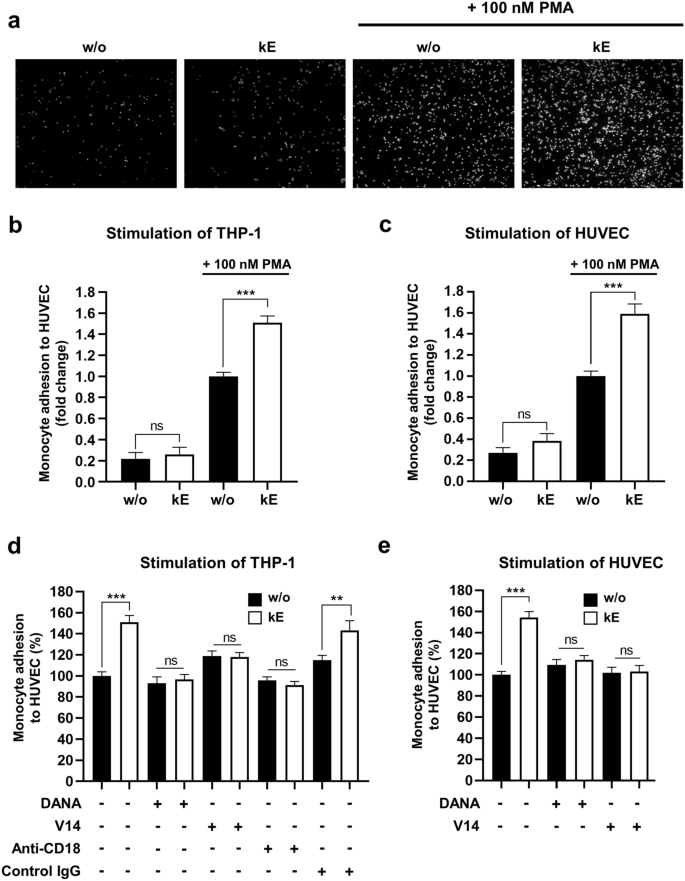
实验目的:验证EDP-NEU1-β₂整合素轴对单核细胞黏附内皮细胞的调控作用。
方法细节:采用人脐静脉内皮细胞(HUVEC),经佛波酯(PMA,100nM)过夜刺激诱导ICAM-1表达;THP-1单核细胞经κE刺激后,用钙黄绿素-AM标记,与HUVEC共孵育30分钟,通过荧光显微镜观察并定量黏附的单核细胞面积占比;设置V14肽、DANA、抗β₂整合素阻断抗体预处理组。
结果解读:结果(图3)显示,PMA刺激HUVEC后,单核细胞黏附率显著增加5倍(n=4-8,P<0.001);κE刺激单核细胞后,黏附率进一步显著增加50.8±6.5%(n=4-8,P<0.001);V14肽、DANA或抗β₂整合素阻断抗体可完全阻断该效应,表明依赖于ERC、NEU1的酶活性及β₂整合素。
产品关联:实验所用关键产品:Sigma的钙黄绿素-AM;Merck的抗β₂整合素阻断抗体及同型对照抗体;Zeiss的AXIO倒置荧光显微镜用于观察细胞黏附。
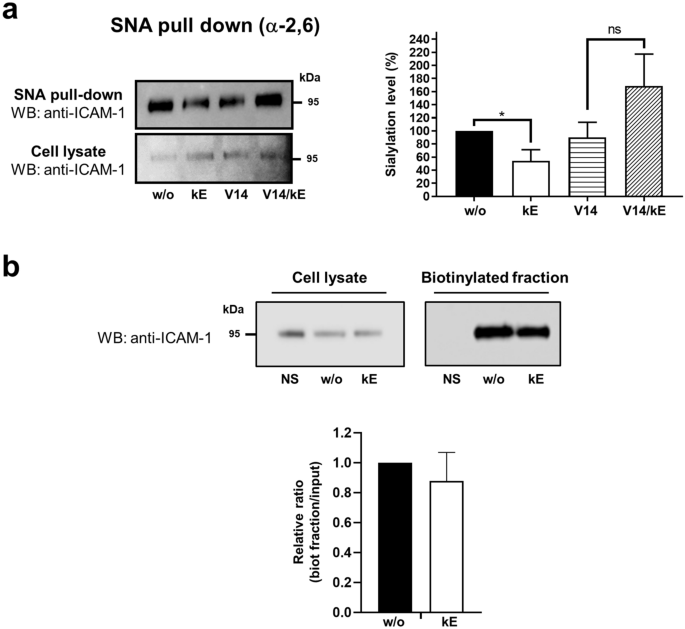
3.4 内皮细胞中NEU1与ICAM-1的相互作用及去唾液酸化调控
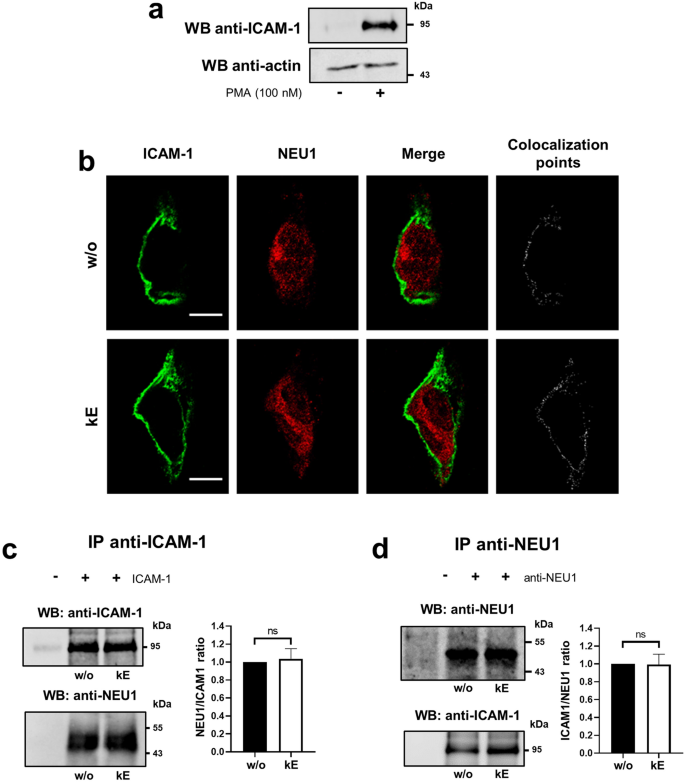
实验目的:验证NEU1与ICAM-1在人内皮细胞中的相互作用,及EDP对ICAM-1唾液酸化水平的调控。
方法细节:采用PMA刺激的HUVEC,通过免疫荧光共聚焦显微镜观察NEU1与ICAM-1的共定位;采用免疫共沉淀实验验证两者的相互作用;采用SNA凝集素下拉实验检测ICAM-1的α-2,6唾液酸化水平;设置κE刺激组与V14肽预处理组。
结果解读:共聚焦显微镜结果(图4)显示,ICAM-1主要定位于细胞膜,NEU1在细胞膜处与ICAM-1共定位,EDP刺激不改变其共定位;免疫共沉淀结果显示,NEU1与ICAM-1在基础状态下存在相互作用,EDP刺激无显著影响(n=3,P>0.05);凝集素下拉实验结果(图5)显示,κE刺激后ICAM-1的α-2,6唾液酸化水平显著降低46.0±17.5%(n=3,P<0.05),V14肽可阻断该效应;细胞表面蛋白生物素化实验显示,EDP刺激不改变ICAM-1的细胞膜表达水平。
产品关联:实验所用关键产品:Santa Cruz Biotechnology的小鼠单克隆抗ICAM-1抗体(6.5B5);Vector laboratories的生物素化SNA凝集素;Zeiss的LSM 710 NLO激光扫描显微镜用于共聚焦观察。
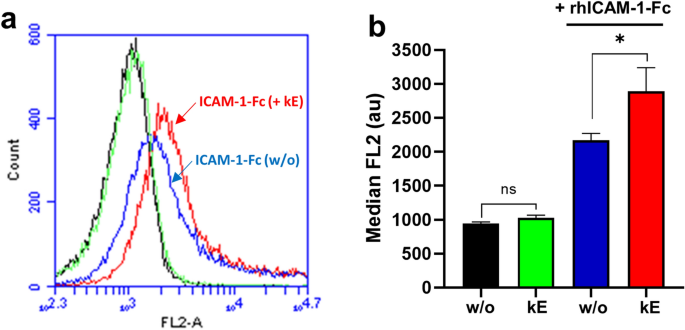
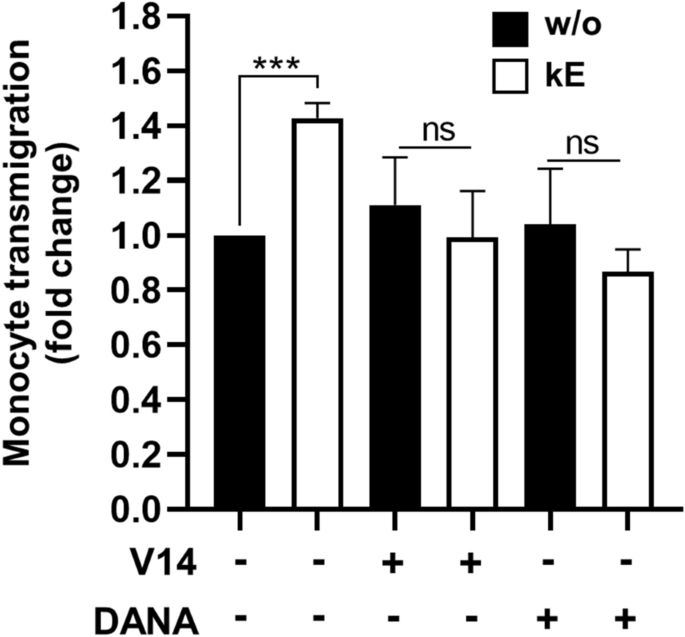
3.5 EDP-NEU1-ICAM-1轴对单核细胞黏附及跨内皮迁移的影响
实验目的:验证EDP-NEU1-ICAM-1轴对单核细胞黏附及跨内皮迁移的调控作用。
方法细节:采用Transwell小室构建HUVEC单层模型,检测单核细胞的跨内皮迁移能力;设置κE刺激HUVEC组、V14肽预处理组、DANA预处理组;通过荧光强度定量迁移的单核细胞数量;同时采用流式细胞术检测EDP刺激后单核细胞与ICAM-1的结合能力。
结果解读:流式细胞术结果(图6)显示,κE刺激单核细胞后,ICAM-1与单核细胞的结合能力显著增加(中位荧光强度从2168±102升至2893±347,n=5,P<0.05);Transwell实验结果(图7)显示,κE刺激HUVEC后,单核细胞跨内皮迁移能力显著增加42.8±5.6%(n=3-4,P<0.001),V14肽与DANA可完全阻断该效应;κE刺激单核细胞也可显著增加迁移能力32.6±7.9%(n=3-4,P<0.001)。
产品关联:实验所用关键产品:Greiner Bio-one的ThinCert™细胞培养小室(8μm孔径);BD Pharmingen的人Fc封闭试剂;BD Accuri C6流式细胞仪用于检测ICAM-1结合能力;TECAN infinite F200 Pro酶标仪用于定量荧光强度。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker为膜蛋白β₂整合素(单核细胞)和ICAM-1(内皮细胞),属于功能型Biomarker,筛选逻辑为“蛋白质组学预筛选→细胞系共定位与免疫共沉淀验证→功能实验验证调控效应”的完整链条。
研究过程中,β₂整合素来源于人单核细胞系THP-1,ICAM-1来源于PMA刺激的人脐静脉内皮细胞;验证方法包括免疫共沉淀验证相互作用、凝集素下拉实验验证唾液酸化水平、细胞黏附与迁移实验验证功能效应;特异性与敏感性方面,β₂整合素的去唾液酸化效应在κE刺激后具有统计学显著性(P<0.05),ICAM-1的去唾液酸化效应同样具有统计学显著性(P<0.05),但未提供ROC曲线等诊断相关数据。
核心成果提炼:本研究首次发现,EDP通过ERC激活NEU1,分别使单核细胞β₂整合素和内皮细胞ICAM-1去唾液酸化,进而显著增强单核细胞与内皮细胞的黏附(增加50.8±6.5%,n=4-8,P<0.001)及跨内皮迁移(增加42.8±5.6%,n=3-4,P<0.001);该Biomarker的功能关联在于,作为单核细胞招募的关键调控分子,参与炎症性血管疾病的早期进程;创新性在于首次揭示了NEU1通过ERC调控两种细胞类型中不同膜蛋白的共同机制,为血管重塑相关疾病的干预提供了新的分子靶点。
