1. 领域背景与文献引入
文献英文标题:Int6 reduction activates stromal fibroblasts to enhance transforming activity in breast epithelial cells;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:乳腺癌肿瘤微环境与肿瘤发生机制
乳腺癌是全球女性发病率最高的恶性肿瘤,肿瘤微环境在肿瘤的发生、发展、侵袭和转移中发挥关键作用,其中癌相关成纤维细胞(CAF)是肿瘤基质的核心组成部分,可通过分泌细胞因子、生长因子等构建促肿瘤微环境。领域共识:CAF可来源于正常成纤维细胞、间充质干细胞(MSC)等,但其具体的调控机制尚未完全阐明。INT6基因最初作为小鼠乳腺肿瘤病毒(MMTV)的整合位点被发现,后续研究表明INT6作为真核翻译起始因子3的亚基(eIF3e),参与翻译起始调控、蛋白酶体降解等过程,在乳腺上皮细胞中表达降低可促进细胞转化和上皮间质转化(EMT),但INT6在肿瘤基质细胞中的功能尚未被报道,这一研究空白限制了对INT6在乳腺癌发生中全面作用的理解。因此,本研究旨在探索INT6在乳腺肿瘤基质成纤维细胞中的表达及功能,明确其对CAF形成和肿瘤细胞恶性表型的调控作用,为乳腺癌的治疗提供新的靶点和理论依据。
2. 文献综述解析
作者围绕INT6的功能与调控机制、CAF的起源与功能两大维度展开综述,系统梳理了领域内的研究进展与未解决问题。现有研究显示,INT6不仅参与翻译起始的调控,还可通过与蛋白酶体相互作用调控蛋白质降解,以及参与无义介导的mRNA降解过程,在乳腺上皮细胞中,INT6表达降低可通过稳定癌蛋白Src3/AIB1、调控EMT相关基因的翻译促进细胞转化;CAF方面,现有研究证实CAF可通过分泌基质细胞衍生因子1(SDF-1)等细胞因子,通过旁分泌信号通路促进肿瘤细胞的增殖、侵袭和转移,CAF的起源包括局部成纤维细胞的活化、MSC的转分化等,但具体的调控因子和分子机制仍不明确。现有研究的局限性在于,大多聚焦于INT6在肿瘤上皮细胞中的作用,对其在基质细胞中的功能研究匮乏,同时CAF活化的关键调控通路尚未完全阐明。本研究的创新价值在于,首次发现INT6在乳腺肿瘤基质成纤维细胞中表达显著降低,并且可以诱导正常成纤维细胞向CAF转化,同时揭示了INT6通过间充质-间充质转化(MMT)调控CAF形成的新机制,填补了INT6在肿瘤微环境中作用的研究空白,为CAF的调控机制提供了新的视角。
3. 研究思路总结与详细解析
本研究的整体研究目标是明确INT6在乳腺肿瘤基质成纤维细胞中的表达特征及功能,阐明其对CAF形成和乳腺癌细胞转化活性的调控作用;核心科学问题为INT6如何调控成纤维细胞向CAF转化,以及该过程对肿瘤细胞恶性表型的影响;技术路线遵循“临床样本验证→细胞功能实验→机制探索”的逻辑闭环,首先通过数据库分析和免疫组化验证INT6在肿瘤基质成纤维细胞中的表达降低,随后通过基因沉默技术在正常成纤维细胞中抑制INT6表达,检测CAF样表型和功能变化,再通过共培养实验验证其对肿瘤细胞转化活性的影响,最后探索INT6调控CAF形成的分子机制。
3.1 INT6在乳腺肿瘤基质成纤维细胞中的表达验证
实验目的:明确INT6在乳腺肿瘤基质成纤维细胞中的表达水平变化。方法细节:首先分析Oncomine数据库中TCGA项目的乳腺癌组织与正常组织、Finak研究的肿瘤基质与正常基质的INT6 mRNA表达数据;随后建立免疫组化(IHC)实验方法,通过检测亲本和INT6沉默的MCF7细胞的Int6蛋白水平验证IHC的特异性;选取20例包含至少2mm外正常基质的乳腺癌石蜡样本,进行IHC染色,评估成纤维细胞中Int6的表达强度和阳性细胞比例,采用Wilcoxon符号秩检验分析统计学差异。结果解读:数据库分析显示,乳腺癌组织中INT6 mRNA水平较正常组织降低50%,肿瘤基质中INT6 mRNA水平较正常基质降低约42倍;IHC验证显示,INT6沉默的MCF7细胞中Int6蛋白水平降低50%,证实IHC方法的特异性;临床样本染色结果显示,正常基质中Int6阳性成纤维细胞比例显著高于肿瘤基质(P<0.001),虽然Int6的表达强度在两组间无显著差异(P=0.66),但正常基质的组织评分显著高于肿瘤基质(P=0.0014),表明INT6在肿瘤基质成纤维细胞中表达显著降低。
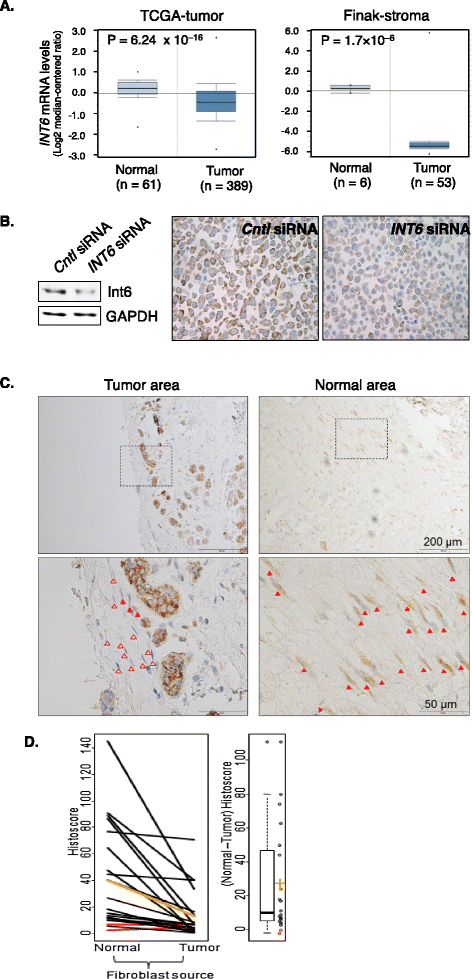
产品关联:实验所用关键产品:Dako的Int6抗体、Sigma的Int6抗体、R&D Systems的SDF-1 ELISA试剂盒等。
3.2 INT6抑制诱导正常乳腺成纤维细胞的CAF样表型
实验目的:验证INT6表达降低是否可以诱导正常乳腺成纤维细胞向CAF转化。方法细节:使用siRNA在永生化人乳腺成纤维细胞(HMF)中沉默INT6表达,在基因沉默后1-5天通过Western blot检测α-平滑肌肌动蛋白(α-SMA)的蛋白水平变化;通过免疫荧光染色检测α-SMA cables的形成情况,计数阳性细胞比例;通过半定量RT-PCR检测CXCL12(SDF-1编码基因)的mRNA表达水平,通过ELISA检测培养基中SDF-1的分泌水平。结果解读:INT6沉默后,HMF中α-SMA蛋白水平随时间逐渐升高,基因沉默5天后,含有α-SMA cables的HMF数量增加2.5倍以上;CXCL12 mRNA水平和SDF-1分泌水平均显著升高,表明INT6抑制可使正常HMF获得CAF的核心标志物和功能特征。
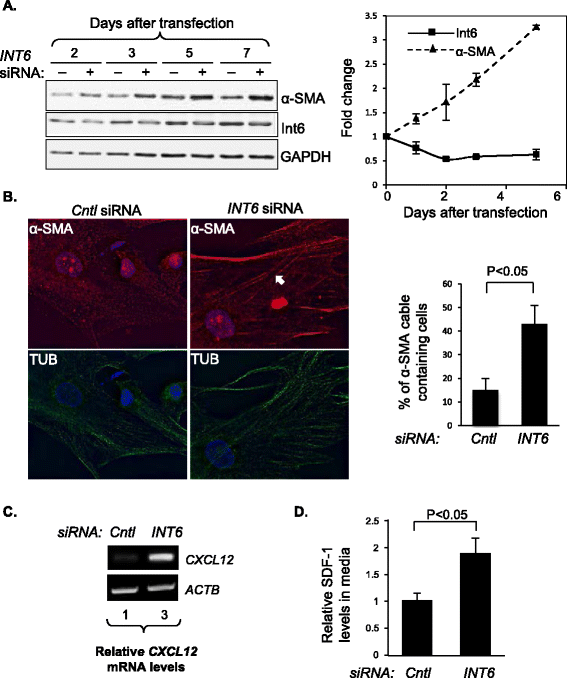
产品关联:实验所用关键产品:Cell Signaling的波形蛋白和N-钙粘蛋白抗体、Dako的α-SMA抗体、Qiagen的RNeasy Mini Kit、Invitrogen的SuperScript First-Strand Synthesis System等。
3.3 INT6抑制的HMF对乳腺癌细胞转化活性的促进作用
实验目的:明确INT6抑制的HMF是否可以增强乳腺癌细胞的恶性表型。方法细节:将INT6沉默的HMF与乳腺癌细胞(MCF7、MCF10AT、SUM102)按1:1比例混合,进行软琼脂克隆形成实验,15天后计数克隆数量;使用BD BioCoat Matrigel侵袭小室,将MCF7细胞接种于上室,下室加入INT6沉默或对照HMF的条件培养基,2天后计数侵袭的细胞数量;同时在软琼脂实验中加入SDF-1拮抗剂AMD3100,检测其对克隆形成的影响,并通过Western blot检测α-SMA水平变化。结果解读:INT6抑制的HMF与MCF7共培养时,软琼脂克隆形成能力增强5倍(n=3,文献未明确具体P值,基于图表趋势推测),对MCF10AT和SUM102细胞的克隆形成能力也有显著增强作用;侵袭实验显示,INT6抑制的HMF的条件培养基可使MCF7细胞的侵袭能力显著增强(n=5,文献未明确具体P值,基于图表趋势推测);加入AMD3100后,INT6抑制的HMF对肿瘤细胞克隆形成的促进作用显著减弱,同时α-SMA水平降低,说明SDF-1在该过程中发挥关键介导作用。
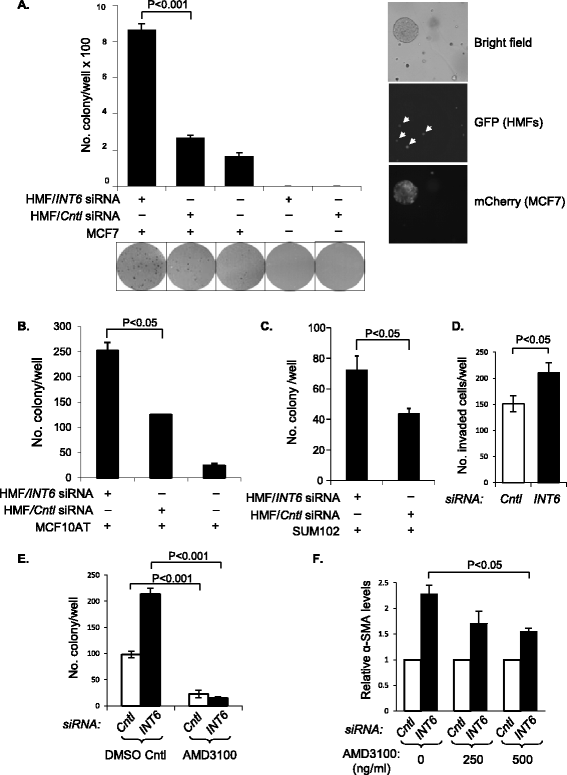
产品关联:实验所用关键产品:Sigma的AMD3100、BD Biosciences的Matrigel侵袭小室、LI-COR Biosciences的IRDye荧光二抗等。
3.4 INT6调控CAF形成的MMT机制探索
实验目的:探索INT6抑制诱导CAF形成的分子机制。方法细节:通过Western blot检测INT6沉默的HMF中间充质标志物波形蛋白、N-钙粘蛋白的表达水平;将MSC与MDA-MB-231细胞共培养诱导CAF样表型,通过Western blot检测Int6蛋白水平变化;在MSC中沉默INT6,检测不同时间点α-SMA的蛋白水平变化。结果解读:INT6沉默的HMF中,波形蛋白和N-钙粘蛋白的蛋白水平分别升高1.5倍和2.5倍;MSC与肿瘤细胞共培养诱导CAF样表型时,Int6水平显著降低;MSC中沉默INT6后,α-SMA水平随时间逐渐升高,表明INT6抑制可通过激活间充质-间充质转化(MMT),诱导成纤维细胞和MSC向CAF转化。
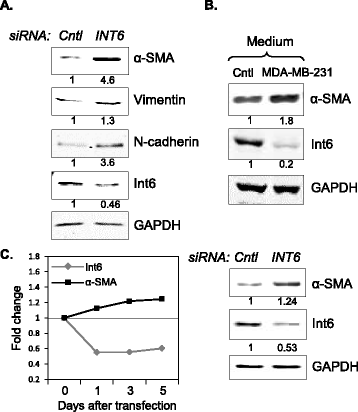
产品关联:文献未提及具体实验产品,领域常规使用Western blot相关试剂、siRNA转染试剂等。
4. Biomarker研究及发现成果解析
本研究中涉及的Biomarker为INT6,作为CAF形成的负调控因子,其表达变化与CAF的活化及肿瘤微环境的恶性转化密切相关。Biomarker定位:INT6属于功能型Biomarker,筛选与验证逻辑为:首先通过肿瘤数据库分析发现INT6在肿瘤基质中表达降低,随后通过免疫组化验证其在成纤维细胞中的表达差异,再通过细胞功能实验验证INT6抑制对CAF形成的诱导作用,最后在MSC中验证INT6对CAF形成的调控作用,形成完整的验证链条。
研究过程详述:Biomarker来源为临床乳腺癌组织样本的基质成纤维细胞、永生化HMF和MSC;验证方法包括数据库生物信息学分析、免疫组化、Western blot、RT-PCR、ELISA及功能实验;特异性与敏感性数据:免疫组化结果显示,肿瘤基质中Int6阳性成纤维细胞比例显著低于正常基质(P<0.001),组织评分差异具有统计学意义(P=0.0014),提示INT6对成纤维细胞活化的特异性调控作用。
核心成果提炼:INT6可作为CAF活化的关键调控因子,其表达降低可诱导正常成纤维细胞和MSC通过MMT向CAF转化,进而通过分泌SDF-1促进乳腺癌细胞的锚定非依赖性生长和侵袭;本研究的创新性在于首次揭示了INT6在肿瘤基质成纤维细胞中的功能,以及其通过MMT调控CAF形成的分子机制,为乳腺癌肿瘤微环境的靶向治疗提供了新的潜在靶点;统计学结果:免疫组化实验中正常与肿瘤基质的组织评分差异P=0.0014,Int6阳性成纤维细胞比例差异P<0.001;功能实验中,INT6抑制的HMF对肿瘤细胞克隆形成的促进作用具有显著统计学差异(n=3,文献未明确具体P值,基于图表趋势推测)。
