1. 领域背景与文献引入
文献英文标题:(+)-JQ1 attenuated LPS-induced microglial inflammation via MAPK/NFκB signaling;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:神经科学(小胶质细胞炎症调控与神经退行性疾病)
神经炎症是帕金森病、阿尔茨海默病等神经退行性疾病的核心病理环节,小胶质细胞作为中枢神经系统的固有免疫细胞,其过度激活会释放大量促炎细胞因子,加剧神经元损伤与疾病进展。领域共识:NFκB和MAPK信号通路是调控小胶质细胞激活的关键通路,靶向这些通路的抗炎策略是神经退行性疾病的潜在治疗方向。现有研究中,BET家族蛋白抑制剂(+)-JQ1已被证实具有外周抗炎作用,但其中枢神经系统中的抗炎机制尚未完全阐明,尤其是体内实验中通路调控的具体细节存在争议,且缺乏对MAPK与NFκB通路关联机制的深入解析。因此本研究旨在明确(+)-JQ1对小胶质细胞炎症的调控作用及分子机制,填补中枢抗炎机制研究的空白。
2. 文献综述解析
作者按“外周炎症-中枢炎症”的研究场景分类,结合“细胞实验-动物实验”的研究层面,系统梳理了(+)-JQ1的抗炎研究进展。现有研究显示,(+)-JQ1在胃肠道、血管内皮等外周炎症模型中可通过抑制NFκB通路减轻炎症反应,在中枢神经系统中,仅细胞实验报道其可下调小胶质细胞炎症基因表达,但体内实验结果存在不一致性,且未明确MAPK通路在其中的调控作用,同时缺乏对NFκB与MAPK通路关联机制的深入解析。本研究的创新点在于,首次在细胞和动物模型中同步验证了(+)-JQ1对小胶质细胞炎症的抑制作用,并明确其依赖MAPK/NFκB的协同调控通路,填补了中枢抗炎机制中通路关联研究的空白,为神经退行性疾病的抗炎治疗提供了新的实验依据。
3. 研究思路总结与详细解析
本研究以“验证(+)-JQ1的中枢抗炎作用-解析其分子通路-明确体内机制”为逻辑闭环,核心科学问题是(+)-JQ1如何调控小胶质细胞炎症的信号通路,研究目标是阐明其通过MAPK/NFκB通路抑制LPS诱导的小胶质细胞炎症的具体机制。
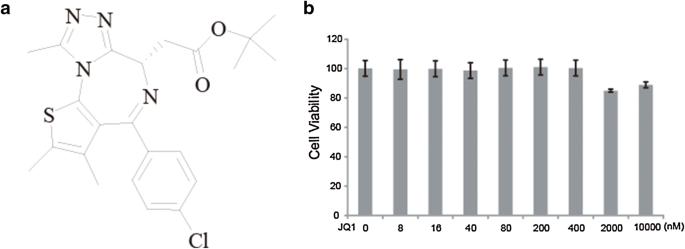
3.1 小胶质细胞活力安全浓度验证
实验目的:确定(+)-JQ1对小胶质细胞无细胞毒性的使用浓度范围,为后续功能实验提供基础。方法细节:采用小鼠小胶质细胞BV2系,用MTT法检测0-10μM浓度(+)-JQ1处理24小时后的细胞活力,设置3个生物学重复。结果解读:如图1所示,10μM以内的(+)-JQ1处理后,BV2细胞活力与对照组无显著差异(n=3,P>0.05),因此后续实验选用0-10μM浓度范围。产品关联:实验所用关键产品:MTT试剂盒(BBI Life Sciences)、DMEM培养基(Biological Industries)、胎牛血清(Lanzhou Bailing Biotechnology)。
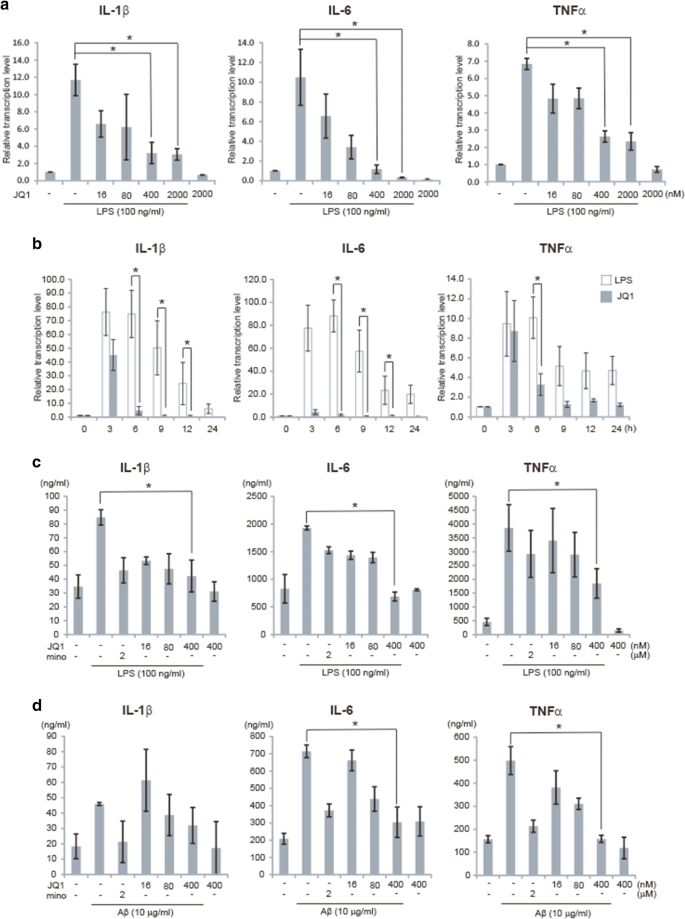
3.2 细胞水平抗炎效果验证
实验目的:验证(+)-JQ1对LPS和Aβ诱导的小胶质细胞炎症的抑制作用。方法细节:BV2细胞预处理0-2000nM(+)-JQ1 30分钟后,用100ng/ml LPS或10μM Aβ刺激,分别在4小时后用qRT-PCR检测炎症细胞因子mRNA表达,24小时后用ELISA检测细胞上清中细胞蛋白水平,设置米诺环素作为阳性对照。结果解读:如图2所示,(+)-JQ1可剂量依赖性下调LPS诱导的IL-1β、IL-6、TNFα的mRNA转录和蛋白分泌(n=3,P<0.05),且对Aβ诱导的炎症因子表达同样具有抑制作用,表明其对小胶质细胞炎症的抑制具有广谱性。产品关联:实验所用关键产品:LPS(Sigma-Aldrich)、Aβ(Sigma-Aldrich)、ELISA试剂盒(eBioscience)、qRT-PCR试剂盒(Takara、Cwbiotech)。
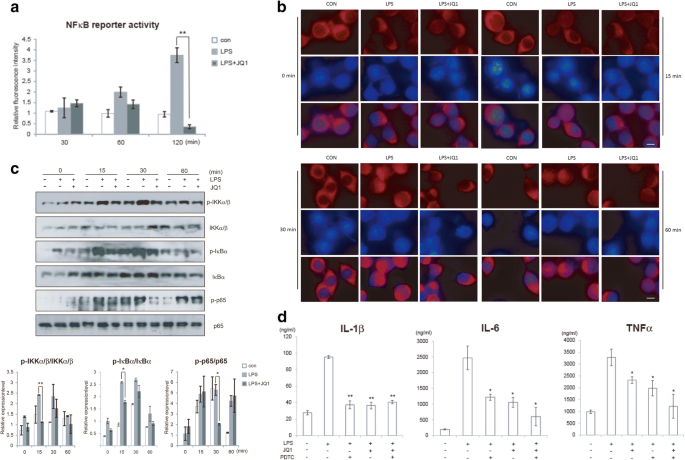
3.3 NFκB通路调控机制解析
实验目的:明确(+)-JQ1对NFκB信号通路的调控作用。方法细节:采用NFκB报告基因实验检测通路活性,免疫荧光染色检测p65核转位,免疫印迹检测IKKα/β、IκBα、p65的磷酸化水平,同时用p65抑制剂PDTC进行通路依赖验证。结果解读:如图3所示,(+)-JQ1可显著抑制LPS诱导的NFκB报告基因活性(n=3,P<0.05),减少p65核转位,并下调IKKα/β、IκBα、p65的磷酸化水平(n=6,P<0.05),PDTC处理与(+)-JQ1处理的抗炎效果相似,表明其抗炎作用依赖NFκB通路。产品关联:实验所用关键产品:pGL3-NFκB质粒(南京中医药大学Liyun Shi博士馈赠)、p65抗体(Cell Signaling Technology)、PDTC(Calbiochem)、免疫荧光试剂盒(Life Technologies)。
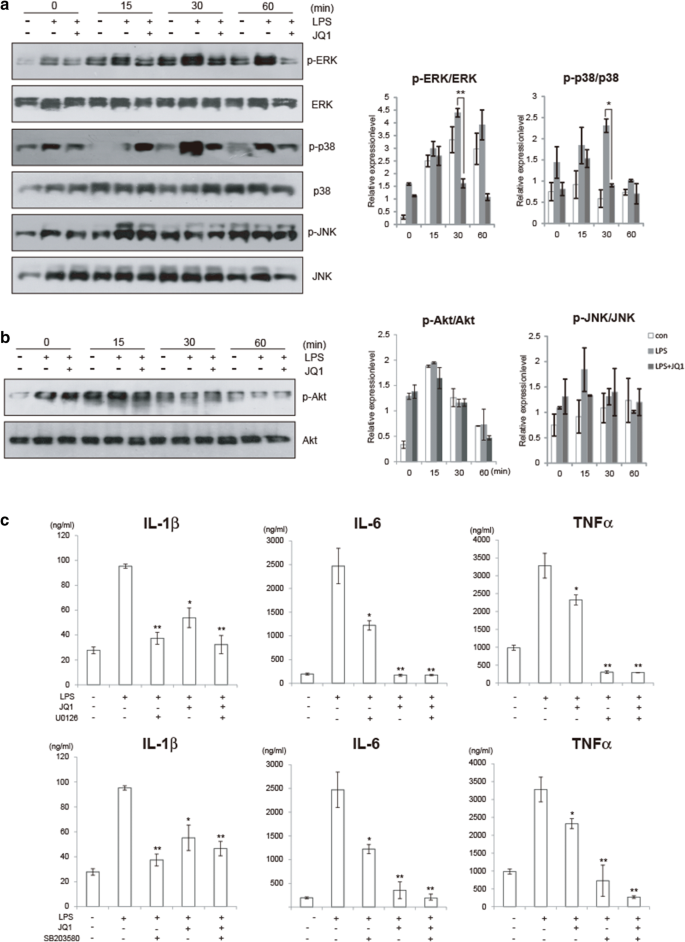
3.4 MAPK通路调控机制解析
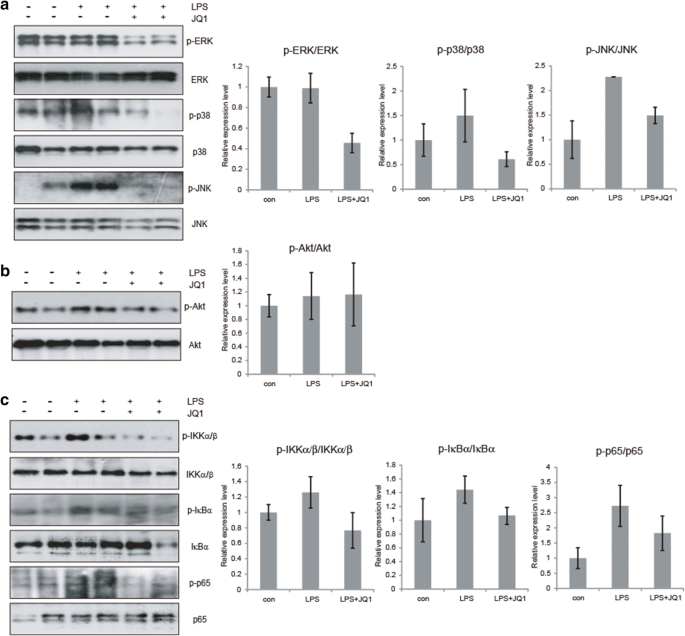
实验目的:探究MAPK通路在(+)-JQ1抗炎作用中的调控地位。方法细节:免疫印迹检测LPS诱导的ERK、p38、JNK的磷酸化水平,同时检测PI3K/Akt通路的磷酸化情况,并用ERK抑制剂U0126和p38抑制剂SB203580进行通路依赖验证。结果解读:如图4所示,(+)-JQ1可显著下调LPS诱导的ERK和p38的磷酸化水平(n=6,P<0.05),但对JNK和Akt磷酸化无显著影响,且(+)-JQ1的抗炎效果强于单独使用ERK或p38抑制剂,表明其抗炎作用部分依赖MAPK通路,且可能存在其他调控机制。产品关联:实验所用关键产品:磷酸化MAPK抗体(Cell Signaling Technology)、U0126和SB203580(Calbiochem)。
3.5 动物模型体内抗炎效果验证
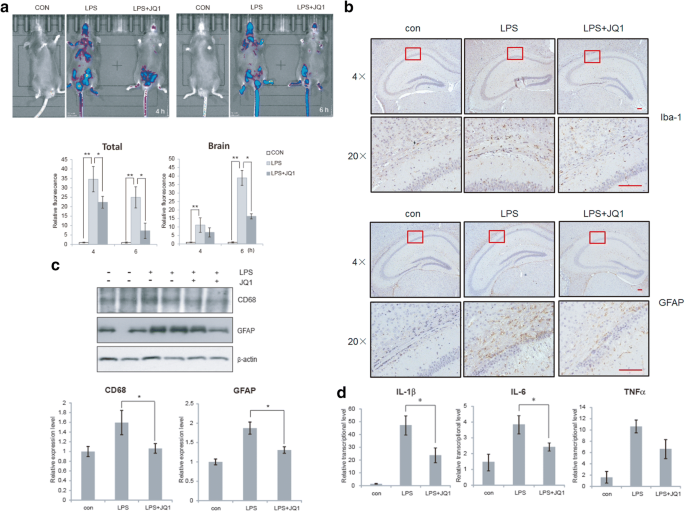
实验目的:验证(+)-JQ1在体内对中枢神经炎症的抑制作用。方法细节:采用IL-1β-luc转基因小鼠,腹腔注射LPS诱导炎症,同时侧脑室注射(+)-JQ1(50mg/kg),通过活体荧光成像检测IL-1β活性,免疫组化(IHC)检测小胶质细胞(Iba-1+)和星形胶质细胞(GFAP+)激活情况,免疫印迹检测炎症标志物,qRT-PCR检测脑内炎症因子表达。结果解读:如图5所示,(+)-JQ1可显著降低脑内IL-1β荧光信号(n=3,P<0.05),减少小胶质细胞和星形胶质细胞的激活(n=6,P<0.05),下调脑内IL-1β、IL-6、TNFα的mRNA表达(n=6,P<0.05),表明其在体内具有显著的中枢抗炎作用。产品关联:实验所用关键产品:IL-1β-luc转基因小鼠(浙江省医学科学院)、免疫组化抗体(Sigma、Wako)、活体成像系统(Shimadzu OPT plus)。
3.6 体内通路机制验证
实验目的:明确体内(+)-JQ1抗炎作用的通路依赖关系。方法细节:取小鼠脑组织,免疫印迹检测MAPK通路(ERK、p38、JNK)和NFκB通路(IKKα/β、IκBα、p65)的磷酸化水平。结果解读:如图6和图7所示,(+)-JQ1可显著下调LPS诱导的ERK、p38、JNK的磷酸化水平(n=6,P<0.05),同时下调IKKα/β、IκBα、p65的磷酸化水平(n=6,P<0.05),而对Akt磷酸化无显著影响,表明其体内抗炎作用依赖MAPK/NFκB通路。产品关联:实验所用关键产品:磷酸化通路抗体(Cell Signaling Technology)、免疫印迹试剂盒(Millipore ECL)。
4. Biomarker研究及发现成果
本研究涉及的Biomarker包括促炎细胞因子(IL-1β、IL-6、TNFα)和信号通路磷酸化蛋白(p-ERK、p-p38、p-IKKα/β、p-IκBα、p-p65),筛选逻辑为“细胞模型初筛-通路验证-动物模型确认”的三级验证体系。
研究过程详述:Biomarker来源为BV2细胞培养上清和小鼠脑组织,验证方法包括qRT-PCR检测mRNA表达、ELISA检测蛋白分泌、免疫印迹检测磷酸化水平、免疫组化检测细胞激活标志物。特异性方面,(+)-JQ1仅下调LPS诱导的上述Biomarker表达,对正常细胞无显著影响;敏感性方面,细胞实验中400nM(+)-JQ1即可使IL-1β表达下调约50%(n=3,P<0.05),体内实验中50mg/kg剂量可使脑内p-p65水平下调约40%(n=6,P<0.05)。
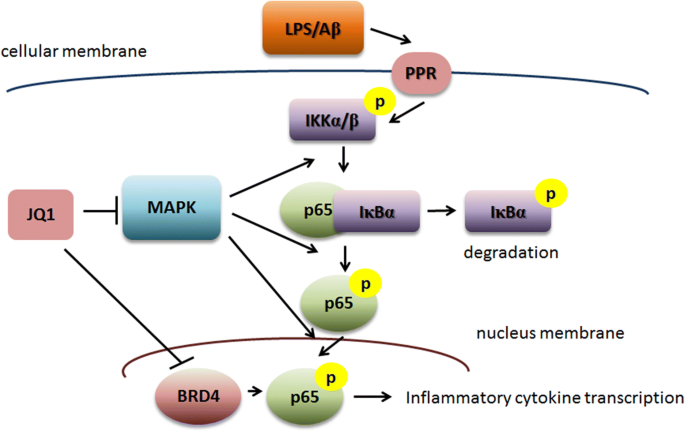
核心成果提炼:这些Biomarker可作为(+)-JQ1中枢抗炎效果的评估指标,首次证实(+)-JQ1通过MAPK/NFκB通路协同调控小胶质细胞炎症,其中MAPK通路调控NFκB通路的上游激活,为神经退行性疾病的抗炎治疗提供了新的靶点和机制依据。该研究明确了中枢抗炎治疗的潜在分子靶点,为后续临床转化研究提供了实验基础。
