1. 领域背景与文献引入
文献英文标题:Autosomal genetic control of human gene expression does not differ across the sexes;发表期刊:Genome Biology;影响因子:未公开;研究领域:人类分子遗传学(基因表达的性别特异性遗传调控)
尽管人类男女基因组高度相似,但在自身免疫病、癌症、心血管病、神经精神疾病等多种疾病的易感性、发病率、严重程度及发病年龄方面存在显著性别差异。此前研究认为,X染色体剂量差异和常染色体基因的性别特异性调控是导致这些差异的重要分子基础。基因表达作为连接基因型与表型的中间性状,其性别特异性遗传调控的研究主要集中在基因型-性别互作分析(即性别特异性表达数量性状位点,eQTL),但不同研究结果存在较大争议:部分研究称淋巴母细胞系中15%的顺式eQTL存在性别特异性效应,有的研究在全血中仅发现6个常染色体基因存在性别特异性eQTL,还有研究在脑组织中未检测到任何性别特异性eQTL。这些不一致的结果可能源于组织特异性、样本量不足导致的统计效力低下,或仅关注单个位点而未从全基因组整体遗传调控的角度分析。当前领域的核心问题是:人类常染色体基因表达的遗传调控是否普遍存在性别差异?本研究旨在通过遗传相关分析,从全基因组层面系统探究这一问题,为理解性别差异的遗传基础提供新的视角,具有重要的学术价值。
2. 文献综述解析
本文献综述部分围绕基因表达的性别特异性遗传调控研究展开,按研究方法(基因型-性别互作分析)和研究结果的异质性进行分类评述,明确现有研究的局限性,并提出本研究的创新思路。
现有研究的关键结论主要聚焦于性别特异性eQTL的检测,但不同研究的结果差异显著,从0到15%的比例不等,反映了该领域研究的不确定性。技术方法上,基因型-性别互作分析的优势在于可以直接定位单个遗传位点的性别特异性调控效应,但其局限性也十分明显:样本量普遍较小,导致统计效力不足,难以检测到效应量较小的性别特异性位点;同时,该方法仅关注单个位点,无法从全基因组整体层面评估常染色体基因表达遗传调控的性别相似性。本研究的创新价值在于,摒弃了传统的单个位点分析思路,采用双变量基因组限制最大似然(GREML)方法,将男女的基因表达水平视为两个独立的性状,通过估计遗传相关系数来判断常染色体基因表达的遗传调控是否存在性别差异,这种方法可以从全基因组整体层面评估遗传调控的相似性,弥补了现有研究的局限性,为该领域提供了更全面的分析视角。
3. 研究思路总结与详细解析
本研究的整体目标是探究人类全血中常染色体基因表达的性别特异性遗传架构,核心科学问题是男女常染色体基因表达的遗传调控是否存在普遍差异,技术路线遵循“数据整合与质控→表型验证→遗传分析→敏感性验证→功能解析”的闭环逻辑,采用大样本多队列数据和双变量GREML方法,系统分析常染色体基因表达的遗传相关。
3.1 研究队列数据整合与质量控制
该环节的核心目标是获取大样本量、高质量的欧洲血统人群基因表达与基因型数据,确保后续分析的可靠性。方法细节上,研究整合了三个独立队列(Brisbane系统遗传学研究BSGS、冠心病CAD队列、爱沙尼亚基因组中心EGCUT队列)的共2053名个体(1048名男性,1005名女性)的基因表达和基因型数据,所有个体均经过欧洲血统验证。基因表达数据采用Illumina系列芯片检测,基因型数据经过质控、填充后,保留HapMap3的单核苷酸多态性(SNP)构建遗传相关矩阵。同时,对基因表达探针进行严格筛选:排除与性染色体交叉杂交的探针、遗传力低于10%的探针、表达水平未显著高于背景的探针等,最终得到12528个常染色体基因表达探针用于后续分析。结果解读显示,数据整合与质控步骤确保了样本的同质性和数据的可靠性,为后续分析奠定了坚实基础。文献未提及具体实验产品,领域常规使用Illumina基因表达芯片、基因型芯片及GCTA、PLINK等生物信息学分析软件。
3.2 基因表达性别二态性验证
该环节的核心目标是确认全血中常染色体基因表达存在性别差异,为后续遗传调控分析提供表型基础。方法细节上,采用混合线性回归模型分析每个探针的表达水平与性别的关联,模型中纳入群体结构和多基因效应作为随机变量,以避免假阳性结果,采用Bonferroni校正的显著性阈值(P=3.99×10^-6)。结果解读显示,共有1413个常染色体探针(对应1266个独特基因)显示出显著的性别表达差异,其中50.5%的探针在女性中的表达水平高于男性,验证了全血中常染色体基因表达存在广泛的性别二态性(n=2053,P<3.99×10^-6)。
3.3 双变量GREML遗传相关分析
该环节的核心目标是估计男女常染色体基因表达的遗传相关系数,判断遗传调控是否存在性别差异。方法细节上,将男女的基因表达水平视为两个独立的性状,采用双变量GREML方法估计遗传相关系数r_G,检验r_G是否等于1(即遗传调控无性别差异),采用似然比检验评估显著性,并用Bonferroni方法校正多重检验。同时,为排除细胞比例差异的影响,进一步调整模型纳入预测和实测的细胞计数比例(中性粒细胞、淋巴细胞、单核细胞)。结果解读显示,所有测试探针的r_G中位数为1.00,表明平均而言男女常染色体基因表达的遗传调控高度一致;预期与观察到的P值的QQ图显示,整体分布符合零假设(基因组控制λ_GC=1.05),没有探针通过Bonferroni校正的显著性阈值。仅细胞分裂周期34(CDC34)基因在调整细胞比例后,r_G=0.33(P=2.24×10^-6),符合Bonferroni校正的显著性阈值,且该基因在女性中的表达水平显著高于男性(β=0.284,SE=0.043,P=3.66×10^-11,n=2053)。
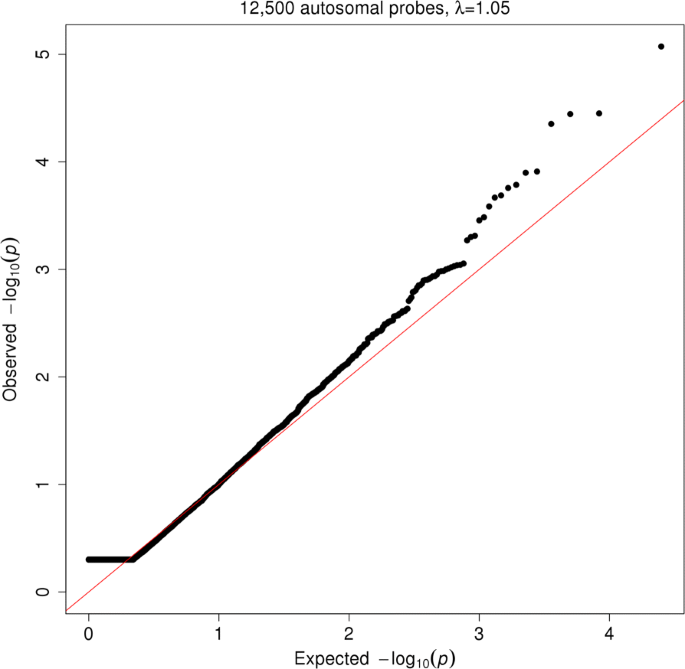
该图为预期与观察到的P值的QQ图,显示P值分布初始阶段因检验处于参数空间边缘而呈现平坦分布,后续紧密遵循零假设分布,表明整体上遗传调控无性别差异。
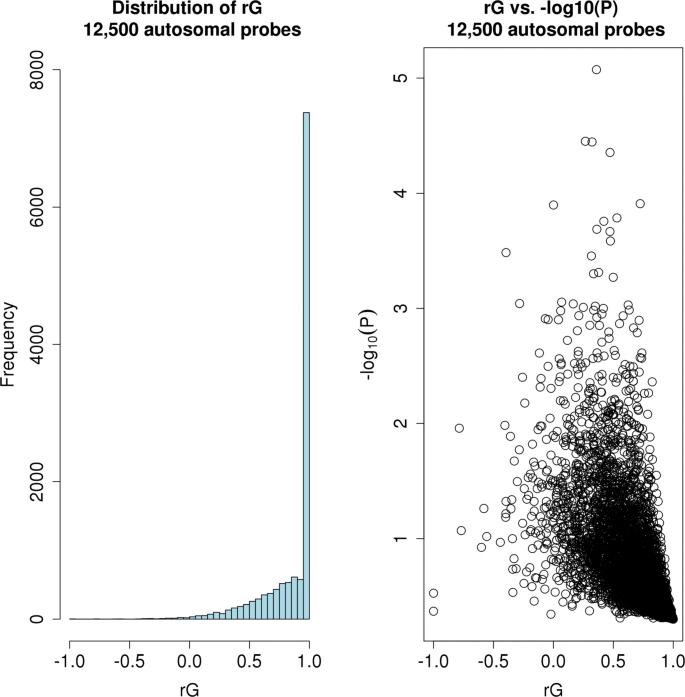
该图展示了所有探针的r_G分布,明显偏向1,中位数为1.00,直观反映了男女遗传调控的高度一致性。
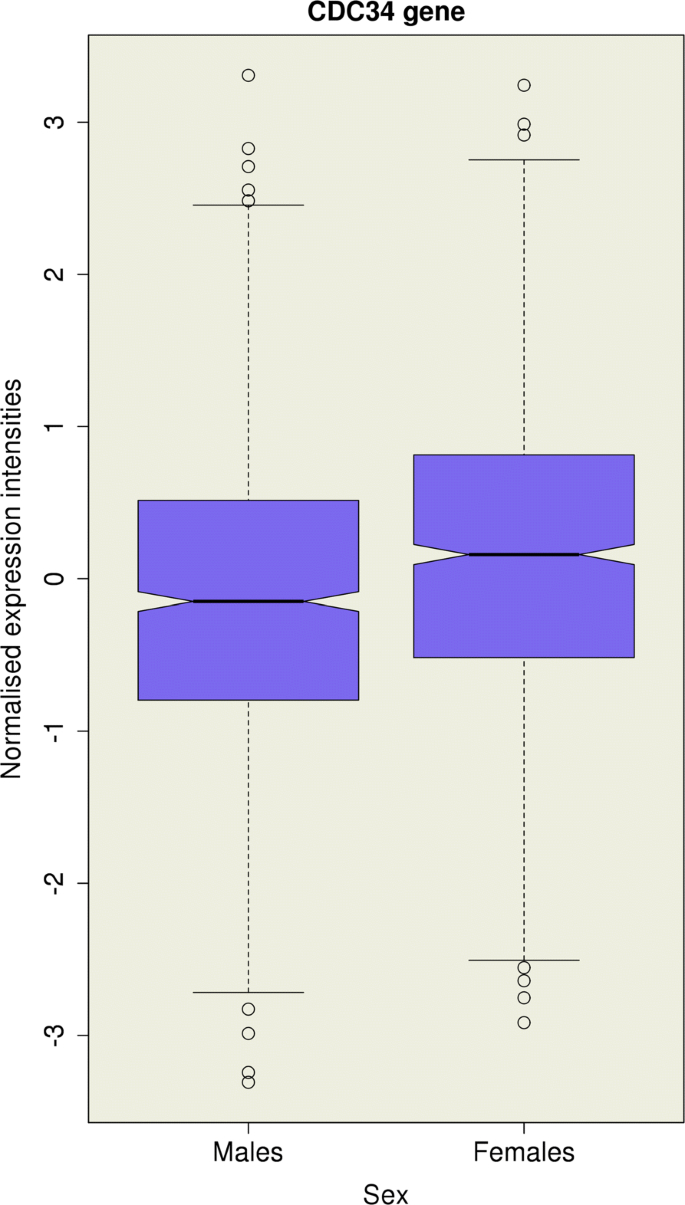
该图展示了CDC34基因在男女中的标准化表达水平分布,女性表达水平显著高于男性,验证了其表达的性别二态性。
3.4 敏感性分析与功能富集
该环节的核心目标是验证研究结果的可靠性,并探究潜在的功能关联。方法细节上,首先进行无约束双变量GREML分析,允许r_G超出[-1,1]的参数范围,以获得无偏估计;随后,选取100个最显著偏离r_G=1的探针,采用DAVID工具进行基因本体(GO)功能富集分析,以P<0.01作为显著性阈值。结果解读显示,无约束分析的r_G中位数为1.01,与有约束分析结果高度一致,进一步验证了结果的可靠性;GO功能富集分析显示,这些探针在免疫应答、多生物过程调控等生物学过程中存在弱富集,但未通过多重检验校正,表明不存在显著的功能富集。
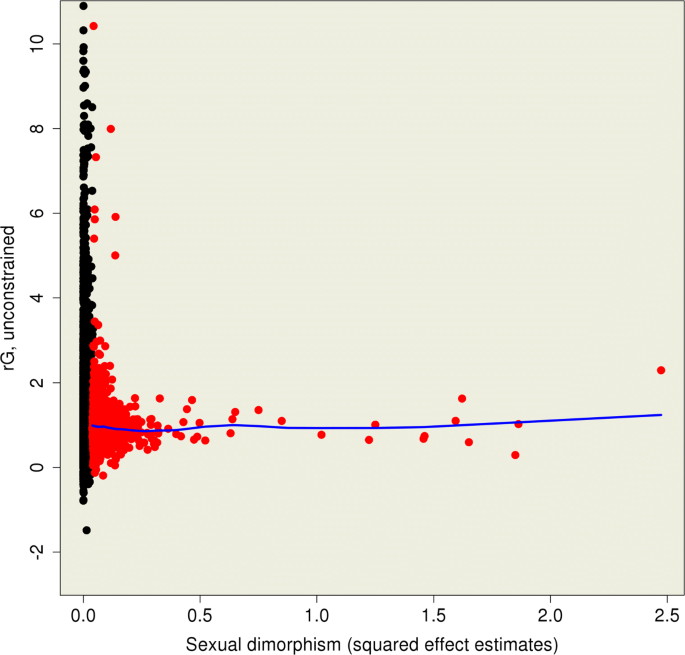
该图展示了无约束r_G与性别表达差异的关系,未观察到明显趋势,表明遗传调控的性别差异与表达水平的性别差异无直接关联。
4. Biomarker研究及发现成果
本研究中唯一显示出常染色体基因表达遗传调控存在性别差异的Biomarker是CDC34基因,其作为细胞周期调控相关基因,为理解性别特异性细胞功能调控提供了潜在靶点。
Biomarker定位方面,CDC34属于基因表达类Biomarker,筛选逻辑为通过全基因组双变量GREML遗传相关分析,在调整细胞比例后发现其r_G显著偏离1,随后通过混合线性回归验证其表达的性别差异,形成完整的筛选与验证链条。研究过程详述:该Biomarker的来源是全血样本的基因表达数据,验证方法包括双变量GREML遗传相关分析和混合线性回归分析,特异性与敏感性数据显示,CDC34基因的遗传相关系数r_G=0.33(P=2.24×10^-6,n=2053),表明其遗传调控在男女中存在显著差异;同时,该基因在女性中的表达水平显著高于男性(β=0.284,SE=0.043,P=3.66×10^-11,n=2053),具有明确的性别表达差异。核心成果提炼:CDC34是本研究中唯一发现的存在常染色体基因表达遗传调控性别差异的基因,其功能与细胞周期G1期调控和DNA复制起始相关,首次在全血中发现该基因的遗传调控存在性别差异,为后续研究性别特异性细胞周期调控机制提供了新的方向;但需要注意的是,整体上绝大多数基因的遗传调控在男女中是高度一致的,CDC34属于罕见的例外情况,统计学结果明确,样本量充足(n=2053)。
