1. 领域背景与文献引入
文献英文标题:Mettl1-mediated internal m⁷G methylation of Sptbn2 mRNA elicits neurogenesis and anti-alzheimer’s disease;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:神经科学(阿尔茨海默病与成人海马神经发生调控)
阿尔茨海默病(AD)是全球范围内最常见的不可逆性神经退行性痴呆,以进行性记忆丧失、认知功能障碍及神经元丢失、β-淀粉样蛋白(Aβ)沉积、神经原纤维缠结为核心病理特征。随着人口老龄化加剧,AD的患病率持续上升,给医疗和社会经济带来沉重负担,但目前临床治疗手段仅能缓解症状,无法阻止疾病进展。领域共识:成人海马神经发生(AHN)是海马区持续产生新生神经元的过程,与学习记忆等认知功能密切相关,AHN受损是AD认知障碍发生发展的关键机制之一,因此解析AHN的调控分子机制,寻找可靶向调控AHN的治疗靶点是AD研究的前沿方向。
RNA修饰是表观转录组学的核心研究内容,N⁷-甲基鸟苷(m⁷G)是一种高度保守的RNA修饰,传统认为主要存在于mRNA的5’帽结构,参与调控mRNA的输出、剪接和翻译。近年来研究发现,mRNA内部也存在m⁷G修饰,由Mettl1/Wdr4甲基转移酶复合物催化,在干细胞自我更新、分化等过程中发挥重要作用,但内部m⁷G修饰在AHN及AD中的具体功能和分子机制尚未明确,这一研究空白限制了对AD病理机制的深入理解及新型治疗靶点的开发。本文针对这一空白,系统探究了Mettl1介导的内部m⁷G修饰在AHN中的调控作用及其在AD中的治疗潜力。
2. 文献综述解析
本文综述围绕AD的病理机制、AHN的调控意义、m⁷G修饰的研究进展三个维度展开,明确了当前领域的研究现状与未解决问题。
首先,作者梳理了AD的研究现状:AD是最常见的痴呆类型,现有治疗无法逆转疾病进展,AHN受损是AD认知障碍的关键驱动因素,但调控AHN的分子机制仍不清晰。其次,作者总结了m⁷G修饰的研究进展:m⁷G修饰分为帽结构和内部修饰,内部m⁷G由Mettl1/Wdr4复合物催化,在胚胎干细胞自我更新、血管发育等过程中发挥作用,其功能异常与小头畸形、Galloway-Mowat综合征等疾病相关,但在神经发生及AD中的作用尚未报道。最后,作者指出当前研究的核心空白:内部m⁷G修饰在AHN中的调控机制及其与AD的关联尚未阐明,缺乏针对该方向的系统性研究。
通过对比现有研究,本文的创新价值在于首次揭示了Mettl1介导的Sptbn2 mRNA内部m⁷G修饰在AHN中的关键调控作用,明确了Mettl1作为AD治疗新靶点的潜力,填补了内部m⁷G修饰在神经发生及AD领域的研究空白,为AD的病理机制解析和治疗策略开发提供了全新的视角。
3. 研究思路总结与详细解析
本文的研究目标是明确Mettl1介导的内部m⁷G修饰在AHN中的调控作用及分子机制,并验证其在AD中的治疗潜力;核心科学问题是内部m⁷G修饰如何调控AHN,以及该调控通路是否可作为AD的治疗靶点;技术路线遵循“表达谱分析→细胞功能验证→分子机制解析→体内功能验证→疾病模型治疗验证”的闭环逻辑,从体外到体内,从细胞到动物,系统阐明了Mettl1-m⁷G-Sptbn2通路在AHN及AD中的功能。
3.1 神经发生过程中Mettl1/Wdr4及m⁷G表达谱分析
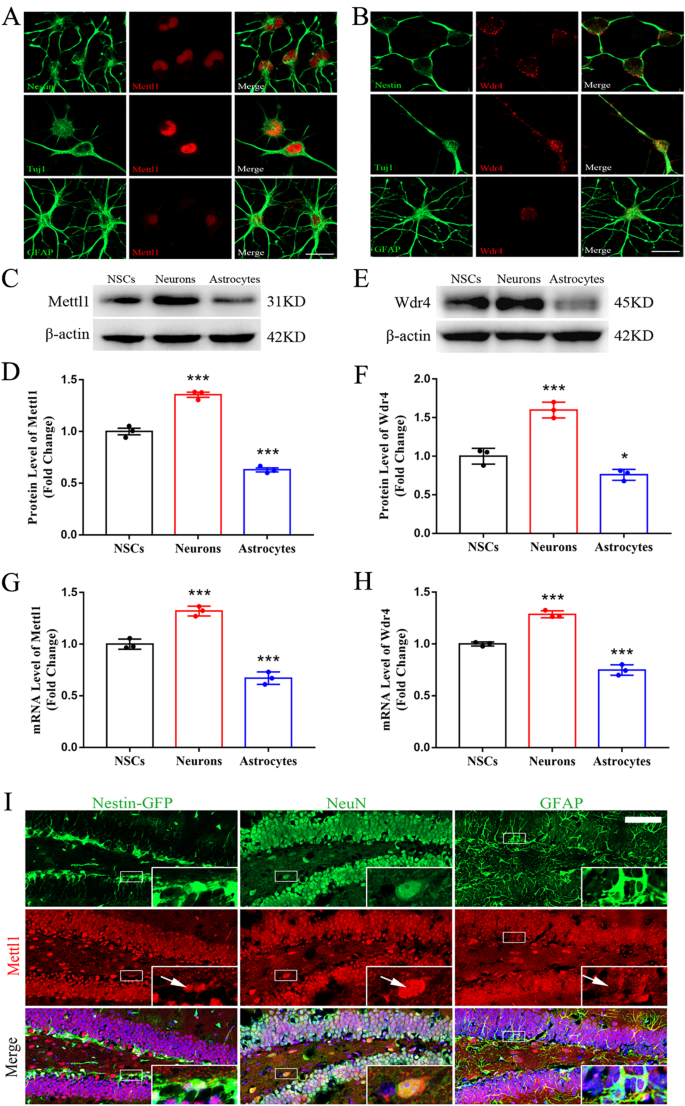
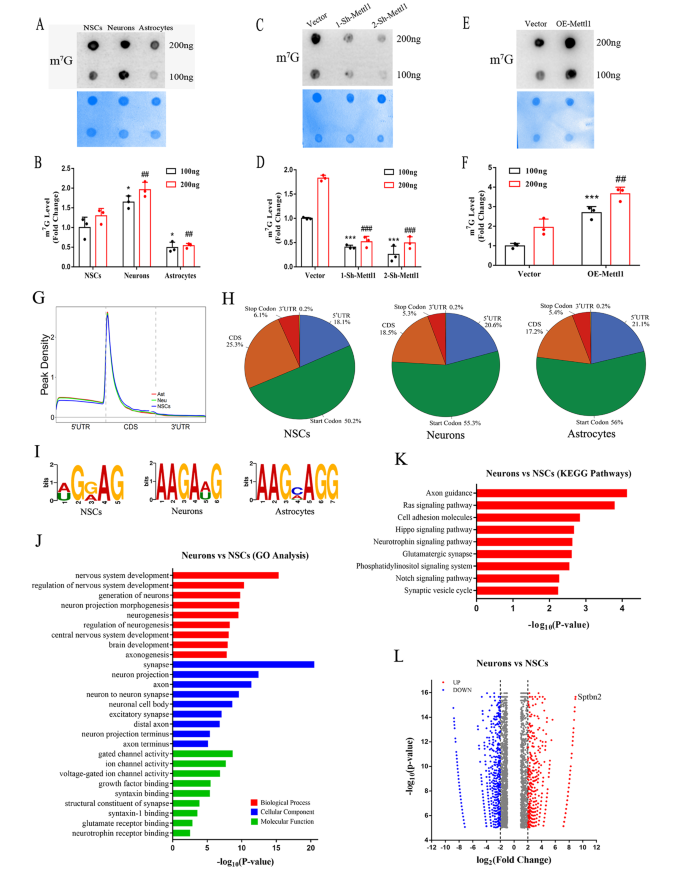
实验目的:明确Mettl1/Wdr4及m⁷G修饰在神经干细胞(NSCs)向神经元、星形胶质细胞分化过程中的表达变化,初步探索其与神经发生的关联。方法细节:体外培养成人海马NSCs,诱导其分化为神经元和星形胶质细胞,采用免疫荧光、蛋白质免疫印迹(Western blotting)、实时定量聚合酶链反应(qRT-PCR)检测Mettl1/Wdr4的蛋白及mRNA表达水平;采用m⁷G斑点印迹(dot blot)检测m⁷G修饰水平;同时在小鼠海马组织中进行免疫荧光共定位分析。结果解读:免疫荧光结果显示,Mettl1/Wdr4在巢蛋白(Nestin)阳性NSCs和β-III微管蛋白(Tuj1)阳性神经元的细胞核中高表达,在胶质纤维酸性蛋白(GFAP)阳性星形胶质细胞中低表达;Western blotting和qRT-PCR结果证实,神经元中Mettl1/Wdr4的表达水平较NSCs显著升高,星形胶质细胞中则显著降低(n=3,P<0.001);m⁷G dot blot结果显示,神经元中m⁷G修饰水平较NSCs显著升高,星形胶质细胞中显著降低。这些结果表明Mettl1/Wdr4及m⁷G修饰与神经发生密切相关,可能正向调控神经元分化。产品关联:实验所用关键产品:Proteintech的Mettl1抗体(货号14994-1-AP)、Invitrogen的Wdr4抗体(货号MA5-37987)、MBL的m⁷G特异性抗体(货号RN017M)等。
3.2 Mettl1对神经干细胞分化的调控作用验证
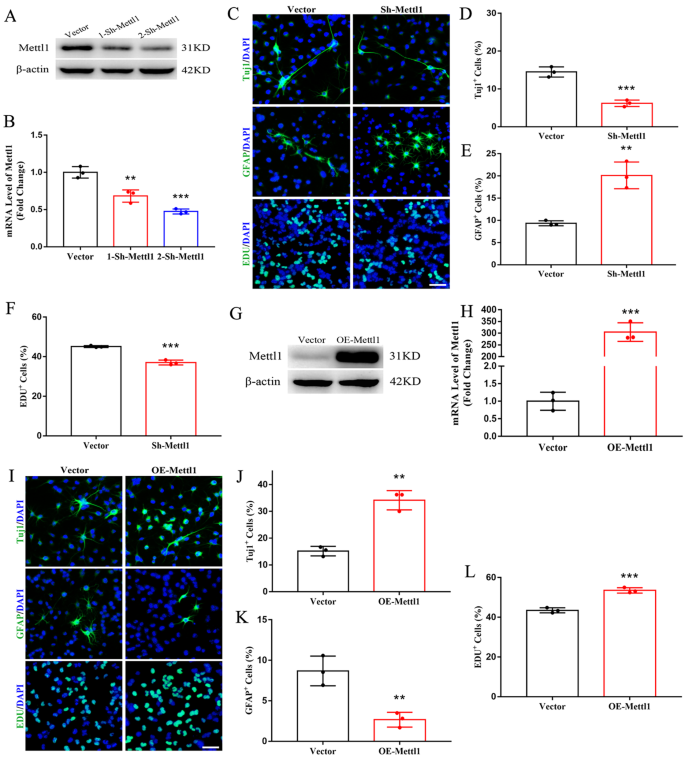
实验目的:验证Mettl1对NSCs分化命运的调控作用,明确其是否促进神经发生、抑制星形胶质发生。方法细节:采用慢病毒介导的短发夹RNA(shRNA)敲低NSCs中的Mettl1,或过表达Mettl1,通过免疫荧光检测神经元标志物Tuj1、星形胶质细胞标志物GFAP及增殖标志物5-乙炔基-2"-脱氧尿苷(EdU)的阳性细胞比例,Western blotting和qRT-PCR验证Mettl1的敲低/过表达效率。结果解读:Mettl1敲低后,Tuj1阳性神经元比例显著降低(n=3,P<0.001),GFAP阳性星形胶质细胞比例显著升高(n=3,P<0.001),EdU阳性增殖细胞比例显著降低(n=3,P<0.01);Mettl1过表达后,Tuj1阳性神经元比例显著升高(n=3,P<0.001),GFAP阳性星形胶质细胞比例显著降低(n=3,P<0.01),EdU阳性增殖细胞比例显著升高(n=3,P<0.001)。这些结果表明Mettl1可促进NSCs向神经元分化并增殖,同时抑制其向星形胶质细胞分化。产品关联:实验所用关键产品:Merck-Millipore的成人海马NSCs(货号SCR022)、KeyGEN BioTECH的EdU细胞增殖检测试剂盒(货号KGA331)等。
3.3 Mettl1介导的m⁷G修饰靶基因筛选与鉴定
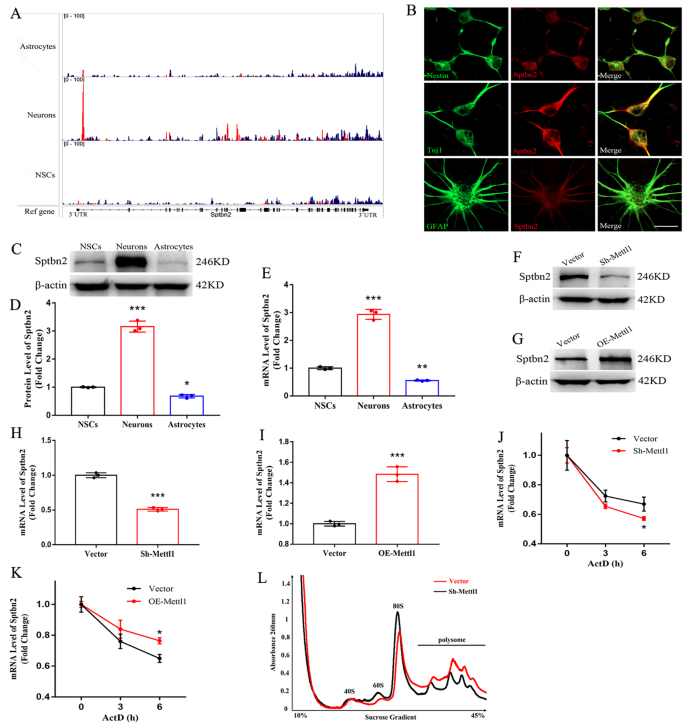
实验目的:筛选Mettl1介导的m⁷G修饰的靶基因,解析其调控神经发生的分子机制。方法细节:对NSCs、神经元和星形胶质细胞的mRNA进行m⁷G甲基化免疫沉淀测序(MeRIP-seq),分析内部m⁷G修饰的分布特征、基序偏好及差异修饰基因;通过qRT-PCR、Western blotting验证靶基因的表达水平;通过RNA稳定性实验(放线菌素D处理)检测靶基因mRNA的稳定性;通过多聚体分析(polysome profiling)检测靶基因的翻译效率。结果解读:MeRIP-seq结果显示,内部m⁷G修饰主要富集在mRNA的5’非翻译区(5’UTR)靠近翻译起始位点的区域,且偏好AG-rich基序;差异修饰基因的基因本体(GO)分析显示,神经发生相关通路显著富集;进一步分析发现,Sptbn2 mRNA在神经元中的m⁷G修饰水平显著高于NSCs。RNA稳定性实验显示,Mettl1敲低后Sptbn2 mRNA的半衰期显著缩短(n=3,P<0.05),过表达后则显著延长(n=3,P<0.05);多聚体分析显示,Mettl1敲低后Sptbn2 mRNA在多聚体组分中的比例降低,表明翻译效率下降。这些结果表明Sptbn2是Mettl1介导的m⁷G修饰的靶基因,Mettl1通过增强Sptbn2 mRNA的稳定性和翻译效率调控其表达。产品关联:实验所用关键产品:CloudSeq Inc.的m⁷G MeRIP-seq服务、Takara的RT试剂套装(货号RR047A)和TB Green Premix Ex Taq II(货号RR820A)等。
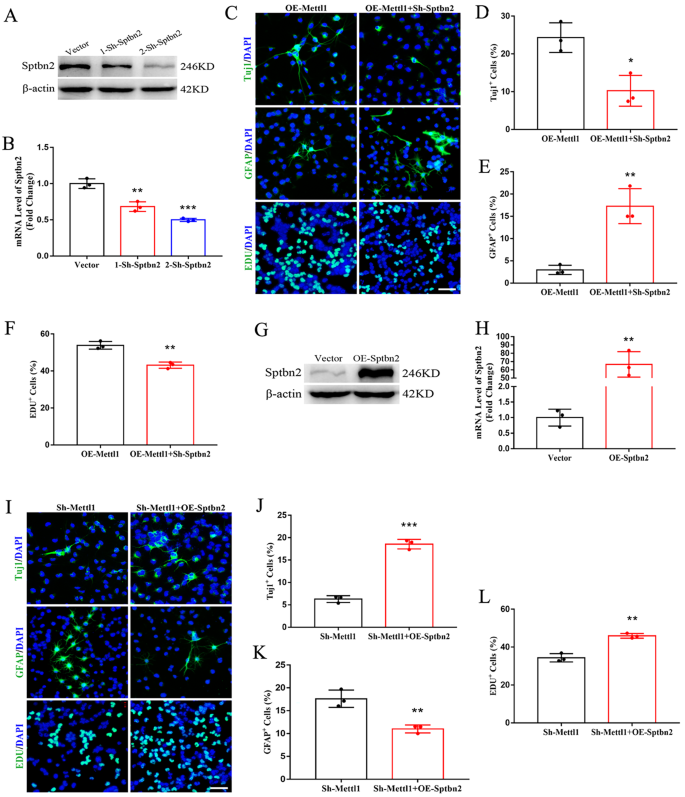
3.4 Sptbn2在Mettl1调控神经发生中的介导作用验证
实验目的:验证Sptbn2是否为Mettl1调控神经发生的下游效应分子。方法细节:在过表达Mettl1的NSCs中敲低Sptbn2,或在敲低Mettl1的NSCs中过表达Sptbn2,通过免疫荧光检测Tuj1、GFAP和EdU阳性细胞比例,验证神经发生的变化;通过Western blotting和qRT-PCR验证Sptbn2的敲低/过表达效率。结果解读:在过表达Mettl1的NSCs中敲低Sptbn2后,Tuj1阳性神经元比例较仅过表达Mettl1的组显著降低(n=3,P<0.01),GFAP阳性星形胶质细胞比例显著升高(n=3,P<0.05),EdU阳性增殖细胞比例显著降低(n=3,P<0.01);在敲低Mettl1的NSCs中过表达Sptbn2后,Tuj1阳性神经元比例较仅敲低Mettl1的组显著升高(n=3,P<0.001),GFAP阳性星形胶质细胞比例显著降低(n=3,P<0.01),EdU阳性增殖细胞比例显著升高(n=3,P<0.01)。这些结果表明Sptbn2介导了Mettl1对神经发生的调控作用,是Mettl1的关键下游靶标。产品关联:实验所用关键产品:Santa Cruz的Sptbn2抗体(货号sc-515737)、OBiO Technology的慢病毒载体及包装服务等。
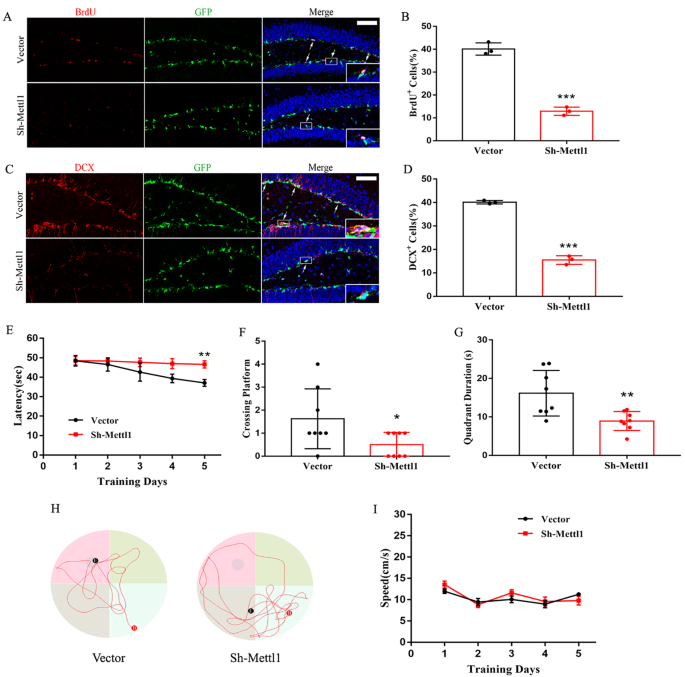
3.5 Mettl1在体内对海马神经发生及认知功能的调控
实验目的:在体内验证Mettl1对海马神经发生及认知功能的调控作用。方法细节:通过双侧立体定位注射向C57BL/6小鼠海马齿状回注射Mettl1 shRNA慢病毒,敲低海马组织中的Mettl1;采用5-溴-2"-脱氧尿苷(BrdU)腹腔注射标记增殖细胞,免疫荧光检测BrdU与双皮质素(DCX)的共定位,评估海马神经发生;采用Morris水迷宫实验检测小鼠的空间学习记忆能力。结果解读:免疫荧光结果显示,Mettl1敲低后,小鼠海马中BrdU+/DCX+的新生神经元数量显著降低(n=8,P<0.001);Morris水迷宫实验显示,Mettl1敲低小鼠在最后一天的逃逸潜伏期显著长于对照组(n=8,P<0.01),探索实验中穿越平台的次数显著减少(n=8,P<0.05),在目标象限停留的时间显著缩短(n=8,P<0.01),而游泳速度无显著差异。这些结果表明,体内敲低Mettl1会抑制海马神经发生并导致认知功能障碍。产品关联:实验所用关键产品:CST的BrdU抗体(货号5292 S)、Noldus的Ethovision XT 14.0行为分析软件等。
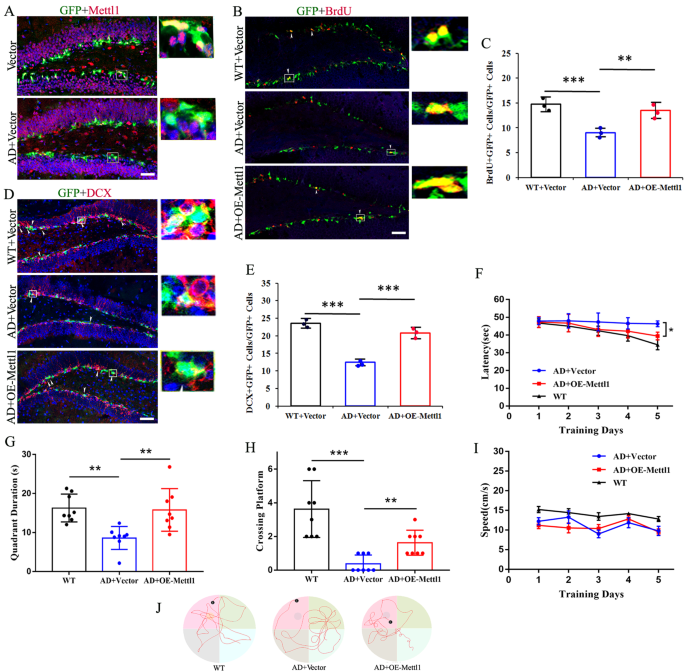
3.6 Mettl1过表达对APP/PS1小鼠神经发生及认知障碍的挽救作用
实验目的:验证Mettl1过表达是否可改善AD模型小鼠的海马神经发生缺陷及认知障碍。方法细节:向28周龄的APP/PS1双转基因小鼠海马齿状回注射Mettl1过表达慢病毒;免疫荧光检测BrdU+/DCX+新生神经元数量;采用Morris水迷宫实验检测认知功能。结果解读:免疫荧光结果显示,APP/PS1小鼠海马中Mettl1的表达水平较野生型小鼠显著降低;过表达Mettl1后,APP/PS1小鼠海马中BrdU+/DCX+新生神经元数量显著增加(n=8,P<0.001);Morris水迷宫实验显示,过表达Mettl1的APP/PS1小鼠逃逸潜伏期显著短于对照组APP/PS1小鼠(n=8,P<0.05),探索实验中穿越平台的次数显著增加(n=8,P<0.001),在目标象限停留的时间显著延长(n=8,P<0.01)。这些结果表明,Mettl1过表达可挽救APP/PS1小鼠的海马神经发生缺陷及认知障碍,具有潜在的AD治疗价值。产品关联:实验所用关键产品:B6C3-Tg (APPswe, PS1dE9) 85Dbo/J APP/PS1小鼠、OBiO Technology的Mettl1过表达慢病毒等。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker包括调控分子Mettl1、靶分子Sptbn2及m⁷G修饰,其中Mettl1可作为AD的潜在治疗靶点,Sptbn2的m⁷G修饰水平可作为神经发生状态的分子标志物,三者共同构成调控AHN的关键通路。
Biomarker定位:Mettl1是m⁷G甲基转移酶复合物的核心组分,其筛选逻辑为“体外表达谱分析→细胞功能验证→体内功能验证→疾病模型治疗验证”;Sptbn2是Mettl1介导的m⁷G修饰的靶基因,筛选逻辑为“MeRIP-seq差异修饰基因筛选→表达水平验证→功能挽救实验验证”;m⁷G修饰是调控Sptbn2表达的关键表观转录组学标记,其检测通过MeRIP-seq和dot blot实验完成。
研究过程详述:Mettl1的来源为细胞和组织的RNA及蛋白,验证方法包括qRT-PCR、Western blotting和免疫荧光,其在神经元中高表达,在AD模型小鼠海马中低表达;Sptbn2的来源为细胞和组织的RNA及蛋白,验证方法包括qRT-PCR、Western blotting、RNA稳定性实验和多聚体分析,其mRNA的m⁷G修饰水平在神经元中显著高于NSCs,Mettl1敲低后Sptbn2 mRNA稳定性和翻译效率显著降低;m⁷G修饰的检测通过dot blot和MeRIP-seq完成,神经元中m⁷G修饰水平较NSCs升高1.5倍以上(n=3,P<0.05)。
核心成果提炼:Mettl1作为调控AHN的关键分子,其功能缺失会导致海马神经发生抑制和认知障碍,过表达则可挽救AD模型小鼠的神经发生缺陷和认知障碍,体内实验显示其对认知功能的改善具有显著统计学意义(P<0.01);Sptbn2是Mettl1的下游效应分子,其m⁷G修饰水平直接影响mRNA稳定性和翻译效率,进而调控神经发生,首次揭示了内部m⁷G修饰在Sptbn2表达调控中的作用;该研究首次将Mettl1-m⁷G-Sptbn2通路与AHN及AD关联,为AD的治疗提供了全新的靶点,具有重要的转化应用潜力。
