1. 领域背景与文献引入
文献英文标题:Heat shock protein 70-mediated sensitization of cells to apoptosis by Carboxyl-Terminal Modulator Protein;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学(线粒体介导的凋亡及PKB/Akt信号通路调控)。
细胞存活与凋亡的平衡由多条信号通路精准调控,其中丝氨酸/苏氨酸激酶PKB/Akt是核心通路之一——通过磷酸化下游因子(如FoxO3a、Bad)抑制凋亡、促进增殖。羧基末端调节蛋白(CTMP)作为PKB/Akt的负调控因子,通过直接结合PKB抑制其活性,此前研究显示CTMP在肿瘤中因启动子甲基化而下调,具有肿瘤抑制作用。然而,CTMP在凋亡中的具体机制尚未完全阐明:其亚细胞定位(尤其是线粒体)是否参与凋亡调控?是否存在非PKB依赖的调控方式?这些是领域未解决的核心问题。当前研究热点聚焦于PKB/Akt通路的亚细胞定位(如线粒体中的PKB活性)及热休克蛋白(如Hsp70)对凋亡体的调控,但CTMP与热休克蛋白的相互作用及对凋亡的影响,尚未有明确结论。本研究针对这些空白,系统解析了CTMP的磷酸化修饰、线粒体定位及与Hsp70的相互作用在凋亡中的角色。
2. 文献综述解析
文献综述以“PKB/Akt通路→CTMP的研究现状→线粒体与凋亡→热休克蛋白的调控”为逻辑主线,逐步引出研究切入点:
1. PKB/Akt通路的功能与调控:作者总结了PKB/Akt的激活机制(PI3K产生的PtdIns(3,4,5)P3结合PH结构域,PDK1和rictor-mTOR分别磷酸化Thr308和Ser473)及亚细胞定位(线粒体、细胞核)对功能的影响;
2. CTMP的研究现状:CTMP通过抑制PKB活性发挥肿瘤抑制作用(如在v-Akt转化细胞、K-ras诱导肺癌模型中),且在胶质母细胞瘤中因甲基化下调;
3. 线粒体与凋亡:线粒体通过释放细胞色素C形成凋亡体,是凋亡的核心调控位点;
4. 热休克蛋白的调控:Hsp70通过结合凋亡蛋白酶激活因子1(Apaf-1),抑制procaspase-9招募,从而抑制凋亡体形成。
现有研究的关键结论包括:PKB/Akt调控细胞存活、CTMP是PKB负调控因子、Hsp70抑制凋亡体形成。技术方法上,酵母双杂交筛选蛋白相互作用、免疫沉淀验证结合是常用手段,但局限性在于未探究CTMP的线粒体定位及与Hsp70的相互作用。本研究的创新点在于:首次揭示CTMP的线粒体定位(依赖N端线粒体靶向序列)、首次鉴定CTMP的Ser37/Ser38磷酸化位点并发现其抑制线粒体定位、首次证明CTMP通过结合Hsp70促进凋亡(减少Hsp70与Apaf-1的结合),填补了CTMP非PKB依赖的凋亡调控机制空白。
3. 研究思路总结与详细解析
本研究围绕“CTMP的磷酸化位点→亚细胞定位(线粒体)→磷酸化对定位的影响→与Hsp70的相互作用→对凋亡的调控”展开,形成“机制解析→功能验证”的闭环。
3.1 CTMP磷酸化位点的鉴定
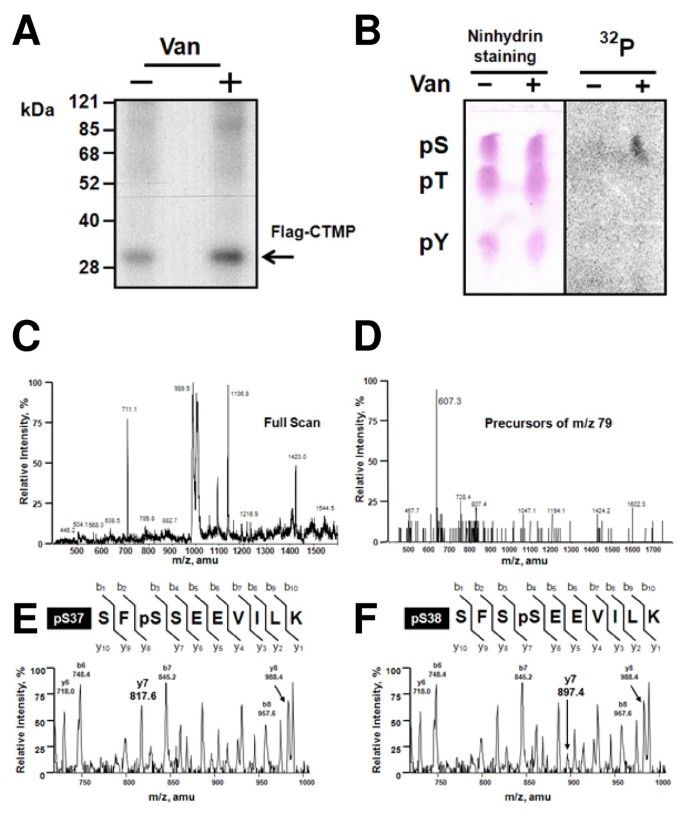
实验目的是确定CTMP在pervanadate(胰岛素模拟剂)处理后的体内磷酸化位点。方法细节:使用稳定表达Flag-CTMP的CCL64细胞,经³²P代谢标记后,用pervanadate处理,免疫沉淀Flag-CTMP,进行磷酸氨基酸分析(薄层层析)、HPLC分离胰蛋白酶消化的肽段,通过NanoESI-MS/MS和CID串联质谱鉴定磷酸化位点。结果解读:pervanadate处理后,³²P掺入量较对照组增加3倍(主要为丝氨酸磷酸化);质谱分析显示CTMP的35-44位肽段(SF SSEEVILK)存在Ser37或Ser38磷酸化(肽段m/z为607,较非磷酸化形式增加80 Da,CID串联质谱明确磷酸化位点)。实验所用关键产品:anti-CTMP抗体(来自P. Cron)、Flag抗体(Sigma);文献未提及具体代谢标记试剂及质谱系统,领域常规使用³²Pᵢ(代谢标记)、Sciex API 300三重四极杆质谱仪。
3.2 CTMP的线粒体定位分析
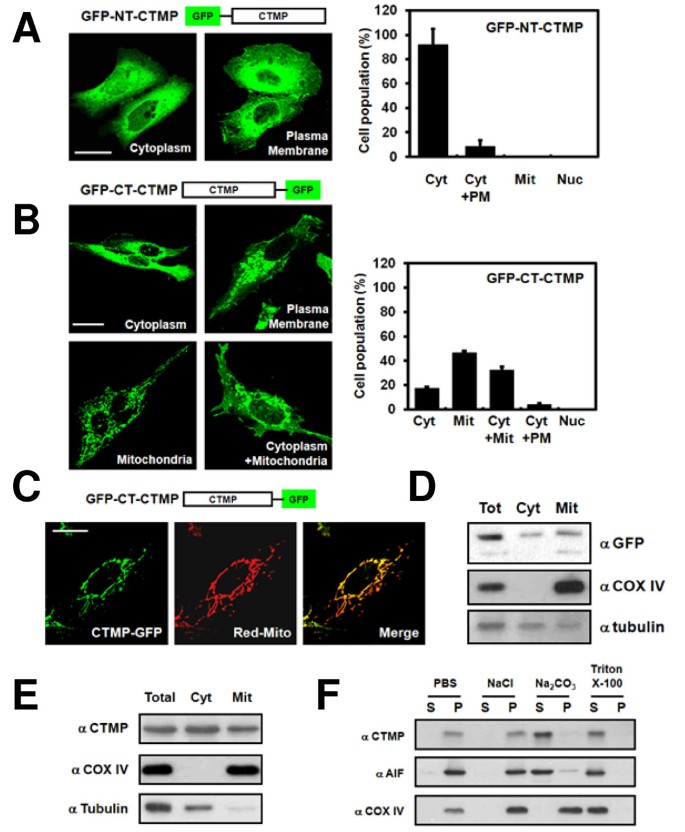
实验目的是明确CTMP的亚细胞定位。方法细节:构建N端(GFP-NT-CTMP)和C端(GFP-CT-CTMP)GFP标记的CTMP质粒,转染U2OS细胞,confocal显微镜观察定位(与线粒体标记DsRed-mito共定位);通过细胞分馏分离细胞质和线粒体组分,免疫印迹检测CTMP分布;对线粒体组分进行NaCl(溶解外膜蛋白)、Na₂CO₃(溶解膜间隙/基质蛋白)、Triton X-100(溶解内膜/外膜蛋白)处理,分离上清与沉淀并检测CTMP。结果解读:C端GFP标记的CTMP主要定位于线粒体(46%细胞线粒体表达,32%细胞线粒体与细胞质共表达),且与DsRed-mito共定位;细胞分馏显示CTMP存在于细胞质(α-tubulin阳性)和线粒体(COX IV阳性)组分;线粒体处理后,CTMP可被Na₂CO₃溶解(上清中检测到),提示其定位于线粒体膜间隙和/或基质(AIF为膜间隙标记,同样存在于上清)。实验所用关键产品:pEGFP-N3载体(Clontech)、pDsRed-mito质粒、anti-COX IV抗体(Cell Signaling)、anti-α-tubulin抗体;领域常规使用OLYMPUS 510 confocal显微镜。
3.3 磷酸化对CTMP线粒体定位的影响
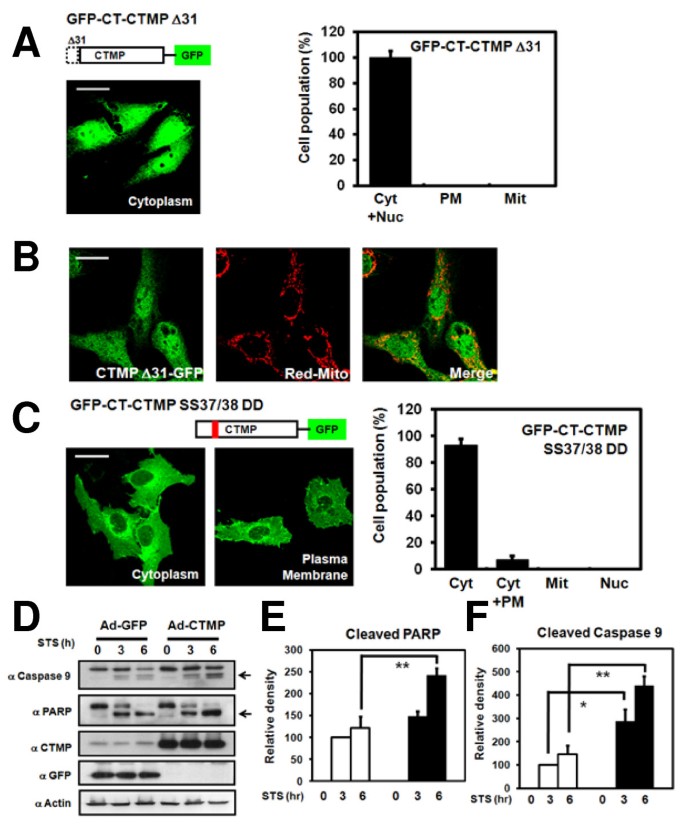
实验目的是探究Ser37/Ser38磷酸化对CTMP线粒体定位的调控。方法细节:构建CTMP的N端31位氨基酸缺失突变体(GFP-CT-CTMP ΔN31,缺失预测的线粒体靶向序列)和磷酸化模拟突变体(GFP-CT-CTMP S37D/S38D,将Ser37/Ser38突变为Asp),转染U2OS细胞,confocal显微镜观察定位(与DsRed-mito共定位)。结果解读:ΔN31突变体完全丧失线粒体定位能力(与DsRed-mito无共定位),说明N端31位氨基酸是线粒体靶向序列;S37D/S38D突变体主要定位于细胞质(93%细胞细胞质表达),提示Ser37/Ser38磷酸化抑制CTMP的线粒体定位。实验所用关键产品:QuikChange定点突变试剂盒(Stratagene);领域常规使用突变体构建试剂。
3.4 CTMP过表达对凋亡的影响
实验目的是验证CTMP对细胞凋亡的调控作用。方法细节:用腺病毒介导CTMP过表达HeLa细胞,24小时后用1μM staurosporine(凋亡诱导剂)处理3、6小时,免疫印迹检测凋亡标志物(PARP切割、caspase-9激活),并通过密度计量分析蛋白水平。结果解读:staurosporine处理3小时后,CTMP过表达组的cleaved PARP和cleaved caspase-9水平显著高于对照组(PARP切割增加约2倍,caspase-9激活增加约1.5倍,n=3,p<0.05),提示CTMP过表达增强细胞对staurosporine诱导凋亡的敏感性。实验所用关键产品:腺病毒表达系统(Invitrogen)、staurosporine(Sigma)、anti-PARP抗体(BD Biosciences)、anti-caspase-9抗体;领域常规使用ImageJ进行密度计量。
3.5 CTMP与Hsp70的相互作用及对Apaf-1复合物的影响
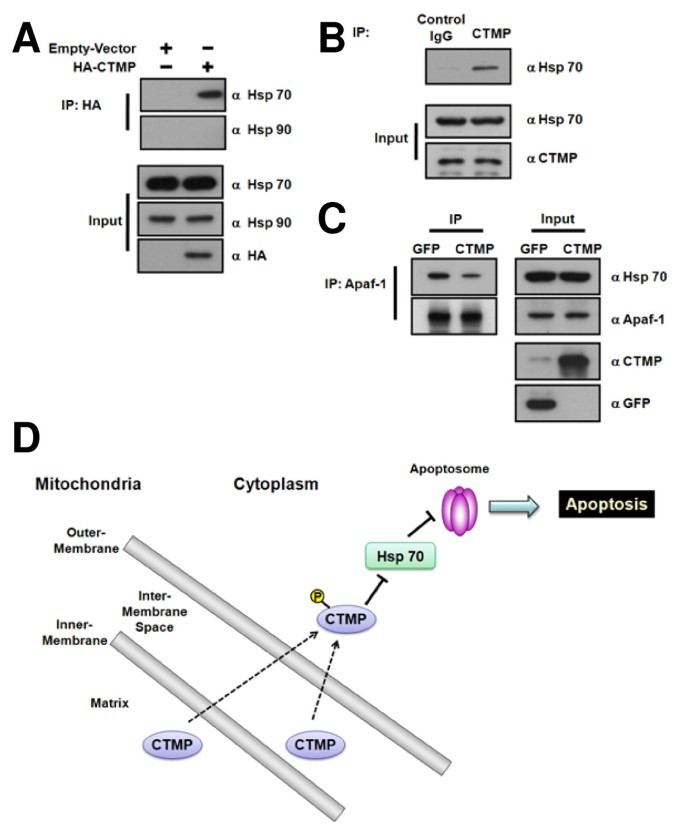
实验目的是探讨CTMP与热休克蛋白的相互作用及对凋亡体形成的影响。方法细节:转染HA-CTMP到HeLa细胞,免疫沉淀HA-CTMP,检测与Hsp70、Hsp90的结合;用anti-CTMP抗体免疫沉淀内源性CTMP,验证与Hsp70的相互作用;CTMP过表达后,用anti-Apaf-1抗体免疫沉淀,检测与Hsp70的结合。结果解读:CTMP特异性结合热休克蛋白70(Hsp70)(不结合Hsp90),内源性CTMP也与Hsp70存在相互作用;CTMP过表达组中,Apaf-1与Hsp70的结合水平较对照组降低约40%(n=3,p<0.01),提示CTMP通过结合Hsp70减少其与Apaf-1的相互作用,从而促进凋亡体形成。实验所用关键产品:HA抗体、anti-Hsp70抗体、anti-Apaf-1抗体;领域常规使用Protein A/G磁珠进行免疫沉淀。
4. Biomarker研究及发现成果解析
本研究未涉及传统意义上的Biomarker(如疾病诊断、预后的循环分子或细胞表面标志物)筛选,但揭示了CTMP作为功能分子在凋亡中的关键机制,为后续Biomarker研究提供了潜在靶点:
- 功能关联:CTMP的线粒体定位状态(磷酸化与否)可作为细胞凋亡敏感性的功能指标——Ser37/Ser38磷酸化抑制线粒体定位,使CTMP滞留细胞质并结合Hsp70,促进凋亡;
- 潜在靶点:CTMP与Hsp70的相互作用水平可能与肿瘤细胞的凋亡抗性相关,若临床样本中发现CTMP-Hsp70复合物水平升高,可能提示肿瘤对凋亡诱导剂(如staurosporine)敏感,为个性化治疗提供依据。
需注意的是,这些功能关联尚未经过临床样本验证,推测:CTMP的Ser37/Ser38磷酸化水平或可作为肿瘤凋亡敏感性的 Biomarker,但需进一步开展临床队列研究确认。
本研究首次揭示了CTMP的线粒体定位及磷酸化调控机制,阐明了其通过结合Hsp70促进凋亡的非PKB依赖路径,为理解PKB/Akt通路以外的凋亡调控提供了新视角,也为肿瘤治疗(如靶向CTMP-Hsp70相互作用)提供了潜在靶点。
