1. 领域背景与文献引入
文献英文标题:Stilbene glycosides are natural product inhibitors of FGF-2-induced angiogenesis;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:血管生成与天然产物药理学。
血管生成是指从现有血管网络生成新血管的生理过程,涉及内皮细胞基底膜降解、迁移、增殖及管腔形成,受促血管生成因子(如血管内皮生长因子VEGF、成纤维细胞生长因子FGF-2)与抗血管生成因子(如内皮抑素endostatin、血栓调节蛋白thrombospondin)的动态平衡调控。生理状态下,血管生成参与伤口愈合、胚胎发育;病理状态下,其过度激活与肿瘤生长、类风湿性关节炎、糖尿病视网膜病变等疾病密切相关。近年来,天然产物因低毒性、多靶点作用成为血管生成抑制剂的研究热点,已报道的活性成分包括染料木黄酮(genistein)、异甘草素(isoliquitrin)、人参皂苷(ginsenoside)等,但针对FGF-2的天然抑制剂仍十分有限——已知的仅包括倍半萜(torilin)、生物碱(sinomenine)等少数类型,且机制研究尚不深入。
Boswellia papyrifera是传统药用植物,其提取物具有抗炎活性,二苯乙烯苷是其主要活性成分之一。此前研究发现二苯乙烯苷可抑制磷脂酶A2(PLA₂),但未探讨其对FGF-2诱导的血管生成的作用。本研究旨在填补这一空白,通过体外细胞模型与体内鸡胚绒毛尿囊膜(CAM)实验,验证两种从Boswellia papyrifera分离的二苯乙烯苷(compound 1和compound 2)对FGF-2诱导的血管生成的抑制作用及分子机制,为开发新型天然血管生成抑制剂提供依据。
2. 文献综述解析
作者对现有研究的分类维度为“天然产物的化学结构与作用靶点”,涵盖二苯乙烯苷、倍半萜、生物碱等类型。现有研究的关键结论包括:①天然产物可通过抑制内皮细胞增殖、迁移或管形成发挥抗血管生成作用;②部分成分(如torilin)可特异性抑制FGF-2信号通路,但此类抑制剂数量极少;③技术方法上,结合体外细胞模型(如内皮细胞增殖实验)与体内模型(如CAM实验)可全面评估化合物活性,但FGF-2受体结合及下游信号通路的机制研究仍不充分。
本研究的创新点在于:①首次报道从Boswellia papyrifera分离的二苯乙烯苷对FGF-2诱导的血管生成的抑制作用;②明确compound 1的作用机制——通过预结合FGF-2,竞争性抑制其与FGF受体1(FGFR-1)、受体2(FGFR-2)的结合,进而下调ERK1/2磷酸化;③揭示结构-活性关系:compound 1因含有额外的鼠李糖基而更亲水,其抗血管生成活性显著强于结构类似但疏水性更高的compound 2。
3. 研究思路总结与详细解析
本研究的整体框架为“毒性评估→功能验证→机制解析→体内验证”:研究目标是明确二苯乙烯苷对FGF-2诱导的血管生成的抑制作用;核心科学问题是“二苯乙烯苷是否通过抑制FGF-2与受体的结合发挥作用”;技术路线遵循“体外细胞实验(增殖、迁移、管形成)→受体结合实验→信号通路检测→体内CAM实验”的闭环逻辑。
3.1 细胞毒性与增殖实验
实验目的:验证化合物对内皮细胞的毒性,及对FGF-2/VEGF/EGF诱导的细胞增殖的影响。
方法细节:①细胞毒性实验:采用MTT法(检测细胞存活率)与活性半胱天冬酶-3(active-caspase-3)免疫荧光法,以牛主动脉内皮细胞(BAEC)和人皮肤微血管内皮细胞(HDMEC)为模型,与凋亡诱导剂星形孢菌素(staurosporine)对比,孵育72小时(MTT)或24小时(caspase-3);②增殖实验:将细胞置于含2.5%胎牛血清(FCS)的培养基中,添加FGF-2(25 ng/ml)、VEGF(10 ng/ml)或EGF(75 ng/ml),同时加入不同浓度(1.4–71.5 μM)的化合物,孵育72小时后计数细胞数量。
结果解读:①毒性实验:compound 1和compound 2对BAEC、HDMEC无显著细胞毒性(MTT法吸光度与对照组无差异,active-caspase-3阳性细胞率<5%),而staurosporine可诱导显著凋亡(阳性细胞率>30%);②增殖实验:compound 1以剂量依赖方式抑制FGF-2诱导的BAEC增殖(半数抑制浓度IC₅₀=48.90±0.40 μM,n=3,p<0.05)和HDMEC增殖(IC₅₀=42.0±0.93 μM,n=3,p<0.05),但对VEGF或EGF诱导的增殖无影响;compound 2仅对HDMEC有弱抑制作用(IC₅₀=101.0±0.50 μM,n=3,p<0.05),对BAEC无效。
实验所用关键产品:Matrigel(Becton Dickinson)、FGF-2(R&D Systems)、VEGF₁₆₅(Apollo Cytokine Research)、EGF(Sigma)。
3.2 内皮细胞迁移与伤口愈合实验
实验目的:检测化合物对FGF-2诱导的内皮细胞迁移的抑制作用。
方法细节:①Boyden小室实验:将内皮细胞接种于上室(8 μm孔径聚碳酸酯膜,预涂明胶),下室添加含FGF-2(25 ng/ml)与化合物的培养基,孵育6小时后计数下室迁移细胞;②伤口愈合实验:将细胞培养至融合,划痕后添加FGF-2与化合物,孵育18小时后计数迁移至划痕区的细胞。
结果解读:①Boyden小室实验:compound 1抑制FGF-2诱导的BAEC迁移(IC₅₀=30.05±0.85 μM,n=3,p<0.05)和HDMEC迁移(IC₅₀=21.50±0.6 μM,n=3,p<0.05);②伤口愈合实验:compound 1显著减少FGF-2诱导的BAEC迁移(IC₅₀=41.80±0.95 μM,n=3,p<0.05)。compound 2在两种实验中均无显著活性。
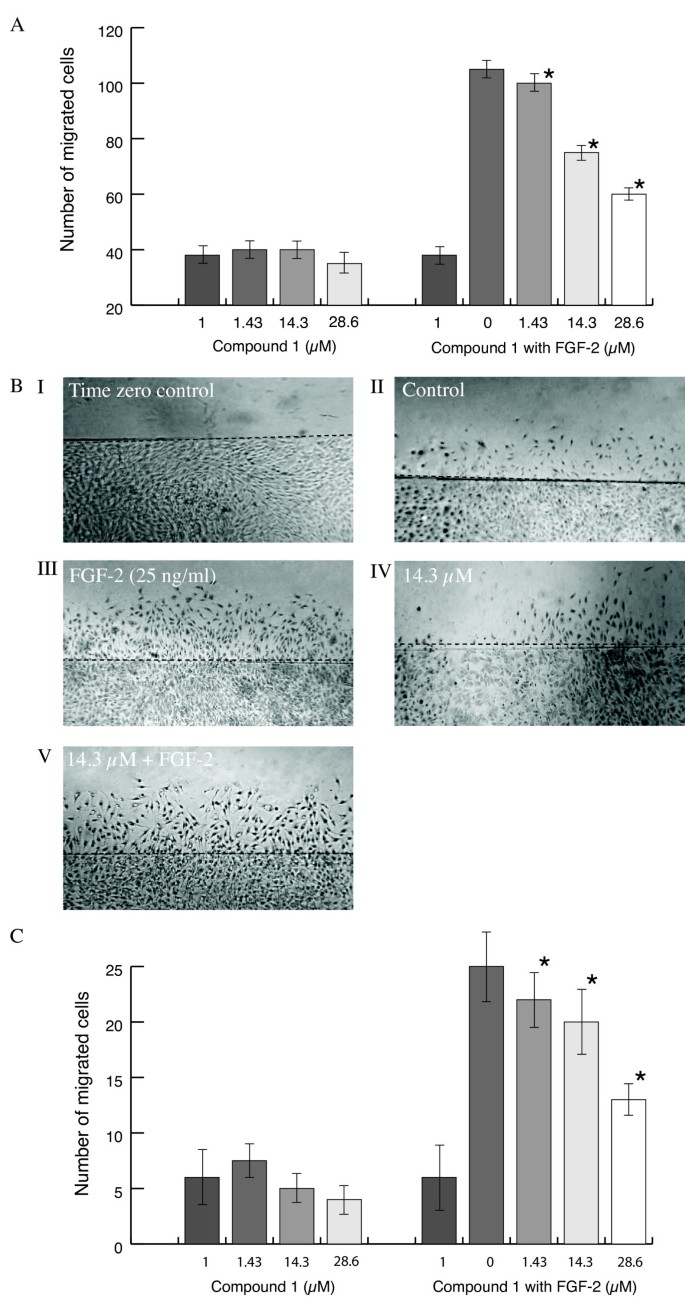
3.3 管形成与侵袭实验
实验目的:评估化合物对FGF-2诱导的内皮细胞管形成及侵袭的影响。
方法细节:①管形成实验:将细胞与Matrigel混合(1:1),添加FGF-2与化合物,孵育24小时后计数闭合管腔数;②侵袭实验:Transwell小室上室涂Matrigel,下室添加FGF-2与化合物,孵育24小时后计数侵袭细胞;③管退化实验:先让细胞形成管腔网络,再添加化合物,24小时后评估管腔退化程度。
结果解读:①管形成:compound 1抑制FGF-2诱导的BAEC管形成(IC₅₀=11.12±0.28 μM,n=3,p<0.05)和HDMEC管形成(IC₅₀=5.8±0.18 μM,n=3,p<0.05);②侵袭:compound 1抑制BAEC侵袭(IC₅₀=11.12±0.28 μM,n=3,p<0.05),compound 2仅对HDMEC有弱抑制(IC₅₀=32.46±0.95 μM,n=3,p<0.05);③管退化:compound 1诱导BAEC管腔退化(IC₅₀=40.0±0.2 μM,n=3,p<0.05)。
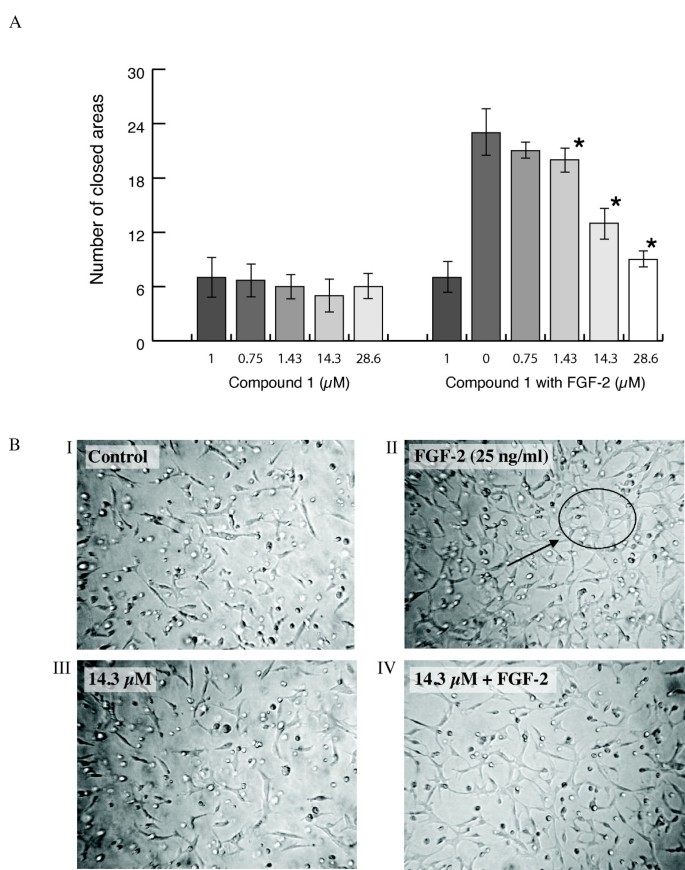
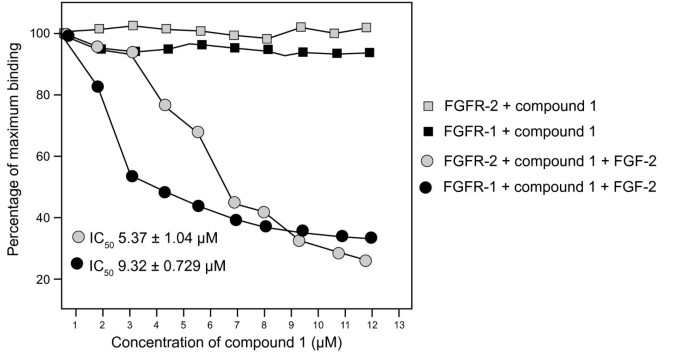
3.4 FGF受体结合实验
实验目的:验证化合物是否通过结合FGF受体抑制FGF-2信号。
方法细节:采用ELISA竞争结合实验,将可溶性FGFR-1或FGFR-2包被96孔板,化合物与FGF-2预孵育2小时后加入孔中,孵育2小时,通过检测结合的FGF-2量计算抑制率。
结果解读:compound 1预孵育可显著抑制FGF-2与FGFR-1(IC₅₀=9.32±0.729 μM,n=3,p<0.05)和FGFR-2(IC₅₀=5.37±1.04 μM,n=3,p<0.05)的结合;compound 2无此作用,且两种化合物均不影响VEGF与VEGF受体的结合。
3.5 ERK信号通路检测
实验目的:解析化合物对FGF-2下游信号通路的影响。
方法细节:采用蛋白质免疫印迹(Western blot)检测phospho-ERK1/2(磷酸化 extracellular signal-regulated kinase 1/2)水平,以α-肌动蛋白(α-actin)为内参,分析化合物对FGF-2诱导的ERK激活的抑制作用。
结果解读:compound 1以剂量依赖方式降低FGF-2诱导的phospho-ERK1/2水平(28.6 μM时,phospho-ERK1/2表达较FGF-2组下降约60%,文献未明确P值,但趋势显著);compound 2无此作用。
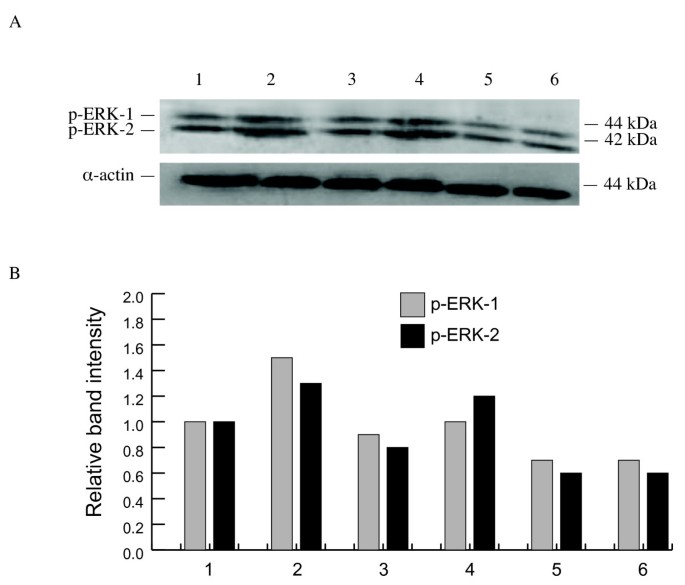
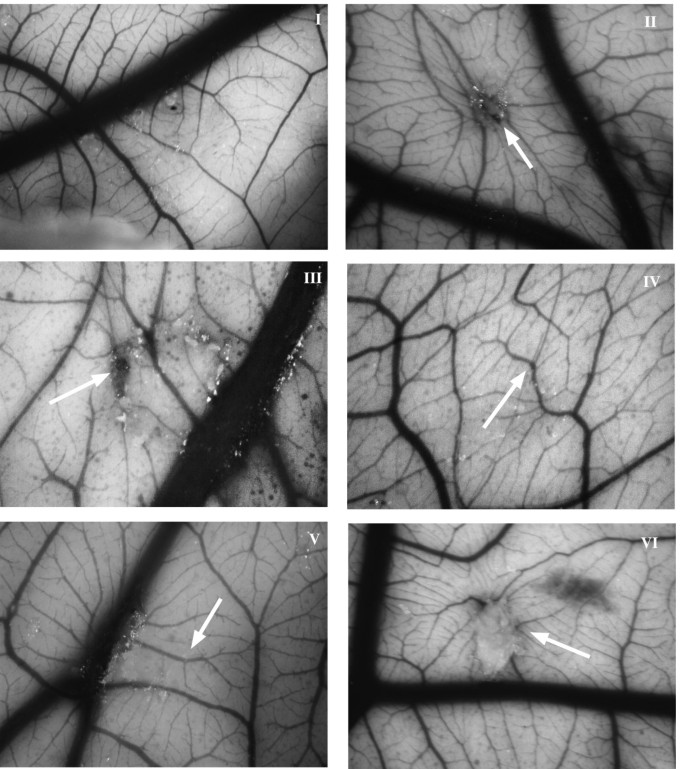
3.6 鸡胚绒毛尿囊膜(CAM)体内实验
实验目的:验证化合物在体内的抗血管生成活性。
方法细节:4日龄鸡胚开窗,8日龄时在CAM上放置含化合物(10 μg)与FGF-2(100 ng)的甲基纤维素 pellet,14日龄时评分血管生成程度(0=无血管,3=强放射状血管)。
结果解读:FGF-2可诱导显著血管生成(评分m=3,n=15,p<0.001);compound 1完全抑制FGF-2诱导的血管生成(m=0,n=8,p<0.0001),compound 2抑制90%(m=1,n=5,p=0.0186);两种化合物单独使用均无炎症或血管生成活性。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
本研究的Biomarker为“FGF受体结合能力”与“phospho-ERK1/2水平”,筛选逻辑遵循“体外受体结合实验→信号通路验证→体内活性确认”:先通过ELISA实验筛选compound 1对FGFR-1/2的结合能力,再通过Western blot验证下游ERK通路的抑制,最后通过CAM实验确认体内活性。
研究过程详述
Biomarker来源:①FGFR-1/2来自重组蛋白;②phospho-ERK1/2来自FGF-2刺激后的内皮细胞裂解液。
验证方法:①ELISA竞争结合实验(检测化合物对FGF-2与FGFR结合的抑制率);②蛋白质免疫印迹(检测phospho-ERK1/2的表达水平)。
特异性与敏感性:compound 1特异性抑制FGF-2与FGFR-1/2的结合(不影响VEGF受体),且剂量依赖性降低phospho-ERK1/2水平(IC₅₀与FGFR结合实验一致)。
核心成果提炼
- 功能关联:compound 1是FGF-2诱导的血管生成的天然抑制剂,其IC₅₀(5.37–48.90 μM)与已知的sinomenine(FGF-2抑制剂)相当,可显著抑制内皮细胞增殖、迁移、管形成及体内血管生成;
- 创新性:首次发现二苯乙烯苷通过“预结合FGF-2→抑制FGFR-1/2结合→下调ERK1/2磷酸化”的机制发挥作用,且结构中的鼠李糖基(增加亲水性)是活性关键;
- 应用潜力:compound 1无明显细胞毒性,体内实验无炎症反应,有望成为肿瘤等血管增生性疾病的候选治疗药物。
本研究为FGF-2的天然抑制剂家族增添了新成员,同时揭示了二苯乙烯苷的抗血管生成机制,为传统药用植物的现代化开发提供了实验依据。
