1. 领域背景与文献引入
文献英文标题:Analysis of mitotic phosphorylation of Borealin;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞生物学(有丝分裂调控/染色体乘客复合物功能)。
染色体乘客复合物(chromosomal passenger complex, CPC)是有丝分裂调控的核心分子机器,由Aurora B激酶、内着丝粒蛋白(INCENP)、Survivin和Borealin组成,其功能是确保Aurora B在有丝分裂前期定位至着丝粒、后期转移至纺锤体中带,从而调控染色体准确分离和胞质分裂。已知Borealin在G2/M期高表达,是CPC靶向至着丝粒的关键分子,但Borealin的翻译后修饰(如磷酸化)调控机制及功能仍是领域未解决的核心问题:虽体外实验显示Borealin的S165可被Aurora B磷酸化、T106符合CDK1 consensus位点,但体内磷酸化状态、调控其磷酸化的激酶/磷酸酶及磷酸化对CPC功能的影响均不明确。
本研究针对“Borealin有丝分裂磷酸化的状态与调控”这一空白,旨在明确Borealin在人体细胞有丝分裂中的磷酸化动态、分子调控机制及与CPC的相互作用,为解析CPC功能提供新依据。
2. 文献综述解析
文献综述的核心评述逻辑围绕“CPC功能→Borealin已知特征→现有研究局限”展开:作者首先概述CPC的组成与动态定位功能,强调Borealin是CPC靶向着丝粒的必需分子;随后聚焦Borealin的细胞周期表达模式(G2/M高表达)及潜在磷酸化位点(T106/CDK1、S165/Aurora B);最后指出现有研究的局限性——仅体外推测磷酸化位点,未验证体内状态;未明确调控激酶/磷酸酶;未探讨磷酸化对CPC功能的影响。
现有研究的关键结论包括:①Borealin是CPC核心成员,缺失导致染色体分离异常;②S165可被Aurora B体外磷酸化;③T106是CDK1潜在位点。但这些研究均基于体外实验,未解决“体内磷酸化是否发生、由谁调控、功能是什么”的核心问题。
本研究的创新价值在于:首次在体内证实Borealin有丝分裂磷酸化,明确其去磷酸化与有丝分裂退出同步;发现Aurora B并非必需激酶、T106/S165突变不影响迁移率(提示存在其他位点);提出“磷酸化由间期/有丝分裂均活跃的激酶催化,去磷酸化受短命磷酸酶调控”的新模型,填补了Borealin翻译后修饰的研究空白。
3. 研究思路总结与详细解析
整体框架
研究目标:解析Borealin有丝分裂磷酸化的状态、调控机制及与CPC的相互作用;核心科学问题:Borealin磷酸化的分子调控及功能意义;技术路线:构建突变体→细胞周期阻滞→生化检测→功能验证——通过转染野生型/突变型Borealin、诺考达唑阻滞有丝分裂,结合Western blot、磷酸酶处理、激酶抑制剂、免疫共沉淀等技术,实现从“状态观察”到“机制解析”的闭环。
3.1 外源性Borealin的有丝分裂电泳迁移率分析
实验目的:检测外源性Borealin在有丝分裂中的电泳迁移率变化,初步判断磷酸化状态。
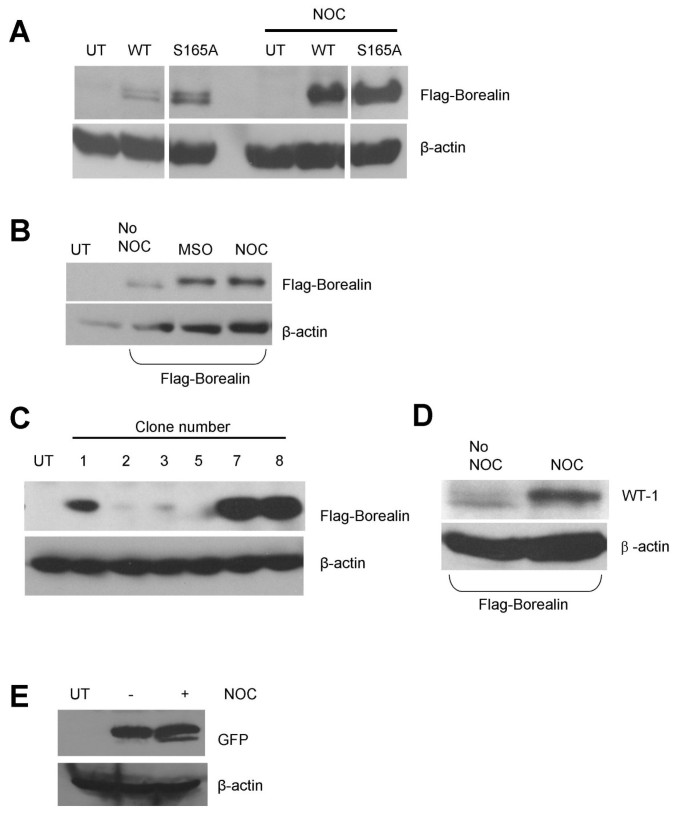
方法细节:将野生型(WT)或S165A突变型Flag-Borealin瞬时转染HeLa细胞,分为异步生长组和诺考达唑(14小时,阻滞有丝分裂)组;15% SDS-PAGE分离后,用Flag抗体Western blot检测,β-肌动蛋白为上样对照;同时用“有丝分裂摇落法”收集未用诺考达唑的有丝分裂细胞验证。
结果解读:异步细胞中Borealin以快速迁移形式为主,有丝分裂细胞中出现慢速迁移形式(图1);S165A突变型仍呈现慢速迁移,说明S165磷酸化不是迁移率变化的原因;“摇落法”收集的细胞也观察到慢速迁移,提示该变化是有丝分裂自然结果,非药物诱导。
实验所用关键产品:Flag标签抗体(领域常规使用Bethyl Laboratories或Sigma-Aldrich产品);诺考达唑(Sigma-Aldrich)。
3.2 内源性Borealin的磷酸化验证
实验目的:确认内源性Borealin的有丝分裂磷酸化,排除外源性过表达干扰。
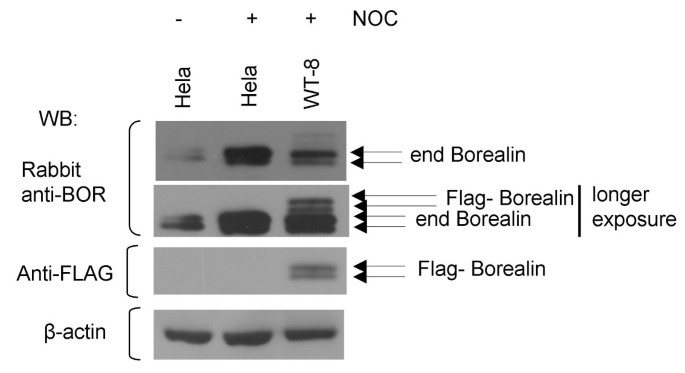
方法细节:通过原核表达GST-Borealin融合蛋白,免疫兔子制备抗Borealin多克隆抗体;检测异步/有丝分裂期HeLa细胞的内源性Borealin,同时对比WT-8细胞(外源性Flag-Borealin)的迁移率。
结果解读:内源性Borealin在有丝分裂期同样呈现慢速迁移形式(图3),与外源性一致,说明结果真实反映内源性蛋白状态。
实验所用关键产品:抗Borealin多克隆抗体(Proteintech Group Inc.定制);β-肌动蛋白抗体(NeoMarkers)。
3.3 磷酸酶处理验证磷酸化本质
实验目的:明确Borealin慢速迁移形式的本质是磷酸化。
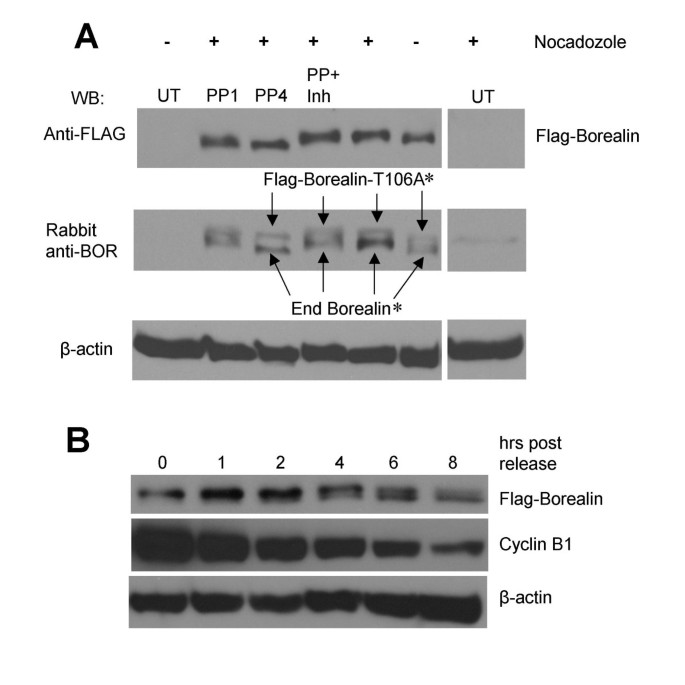
方法细节:收集诺考达唑阻滞的T106A突变型转染细胞裂解液,分为未处理、碱性磷酸酶(CIP)处理1/4小时、磷酸酶+抑制剂(NaF+NaVO₃)组;15% SDS-PAGE分离后Western blot检测。
结果解读:磷酸酶处理后慢速迁移带消失,转为快速迁移;抑制剂组保留慢速带(图4A),证实慢速迁移的本质是磷酸化。
实验所用关键产品:碱性磷酸酶(Promega);磷酸酶抑制剂(NaF、NaVO₃,Sigma-Aldrich)。
3.4 有丝分裂退出时的去磷酸化分析
实验目的:检测Borealin在有丝分裂退出中的去磷酸化动态,关联细胞周期进程。
方法细节:诺考达唑阻滞WT-8细胞后释放,0、1、2、8小时收集细胞;12.6% SDS-PAGE分离后,检测Borealin迁移率及Cyclin B1(有丝分裂退出标志)表达。
结果解读:释放后1小时仍以磷酸化形式为主,2小时开始去磷酸化,8小时完全转为去磷酸化(图4B);Cyclin B1随时间降解,提示去磷酸化与有丝分裂退出同步。
3.5 Aurora B激酶对Borealin磷酸化的依赖性分析
实验目的:验证Aurora B是否为Borealin磷酸化的必需激酶。
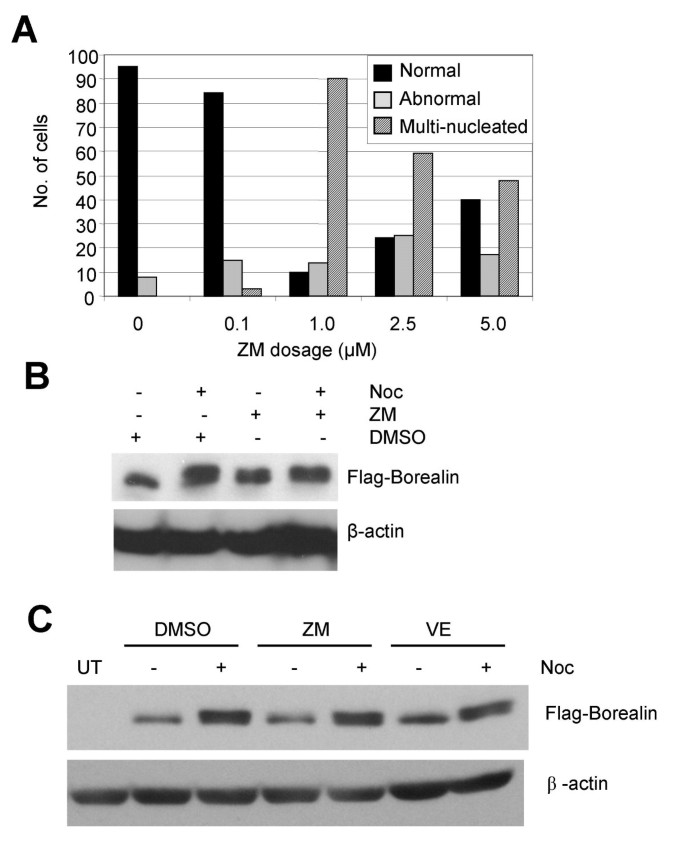
方法细节:WT-8细胞用Aurora抑制剂(ZM447439 2μM/10μM、VE465 100nM)预处理1小时,再用诺考达唑阻滞16小时;12.6% SDS-PAGE分离后Western blot检测。
结果解读:抑制剂处理组细胞出现多核化(Aurora B抑制表型),但Borealin仍保持慢速迁移的磷酸化形式(图5B、5C),说明Aurora B不是必需激酶。
实验所用关键产品:Aurora激酶抑制剂ZM447439(AstraZeneca)、VE465(Vertex Pharmaceuticals)。
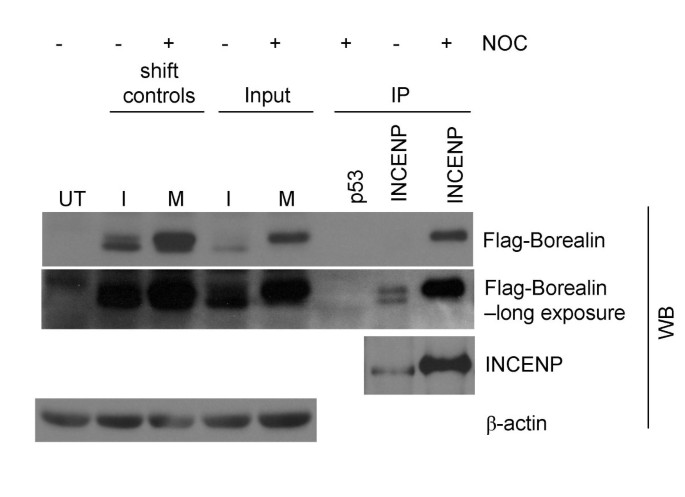
3.6 Borealin与INCENP的相互作用分析
实验目的:探讨磷酸化Borealin与CPC成员INCENP的相互作用。
方法细节:收集异步/有丝分裂期WT-8细胞裂解液,用INCENP抗体免疫共沉淀(p53抗体为阴性对照);Western blot检测Flag-Borealin。
结果解读:有丝分裂期的INCENP复合物富含磷酸化Borealin,异步期复合物中磷酸化/去磷酸化形式均有(图9),提示磷酸化促进Borealin与INCENP结合。
实验所用关键产品:抗INCENP抗体(Upstate);抗p53抗体(Santa Cruz Biotechnology)。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的Biomarker是“Borealin的有丝分裂期磷酸化形式”,属于“翻译后修饰型Biomarker”,可作为细胞处于有丝分裂期的分子标志。其筛选/验证逻辑为:体内观察(电泳迁移率变化)→生化验证(磷酸酶处理)→功能关联(CPC相互作用)。
研究过程详述
Biomarker来源:HeLa细胞(内源性)和WT-8细胞(外源性Flag-Borealin)的有丝分裂期裂解液;验证方法包括:①Western blot检测电泳迁移率(区分磷酸化/去磷酸化);②磷酸酶处理(确认磷酸化);③免疫共沉淀(关联CPC功能)。特异性方面,有丝分裂期磷酸化形式占主导,异步期为去磷酸化形式(图1、3、4);敏感性方面,诺考达唑阻滞的有丝分裂细胞中可稳定检测到磷酸化形式,但文献未提供量化的敏感性/特异性数据(如ROC曲线AUC值)。
核心成果提炼
- 功能关联:磷酸化Borealin更易与INCENP结合,提示磷酸化促进CPC组装(图9);
- 创新性:首次在体内证实Borealin有丝分裂磷酸化,且不依赖Aurora B或T106/S165位点(现有研究仅体外推测);
- 局限性:未提供Biomarker的量化统计学数据(如样本量、P值),但通过多次独立实验验证了结果重复性。
综上,本研究揭示了Borealin的有丝分裂磷酸化状态及调控机制,为CPC功能解析提供了新的分子基础。Borealin的磷酸化形式可作为有丝分裂期的分子标志,其调控的激酶/磷酸酶及对CPC功能的具体影响仍需进一步研究。
