1. 领域背景与文献引入
文献英文标题:Contributions of differential p53 expression in the spontaneous immortalization of a chicken embryo fibroblast cell line;发表期刊:BMC Cell Biology;影响因子:未公开;研究领域:细胞永生化与肿瘤抑制通路(p53/Rb通路)。
细胞永生化是指细胞突破“Hayflick界限”(正常细胞有限分裂次数)获得无限增殖能力的过程,是肿瘤发生的重要前期事件。1961年Hayflick提出细胞衰老学说,明确正常体细胞具有有限分裂寿命;后续研究发现,p53和Rb通路是细胞周期调控的核心——p53通过转录激活p21WAF1等靶基因介导G1/S期停滞,Rb通过抑制E2F-1活性控制细胞进入S期,两条通路的异常(突变、功能失活或表达失调)是细胞永生化的关键驱动因素。与哺乳动物细胞不同,鸟类细胞自发永生化极为罕见,截至本研究开展时仅建立DF-1和SC-1两株自发永生化鸡胚成纤维细胞(CEF)系。当前领域研究热点集中在解析鸟类细胞自发永生化的分子机制,但多数研究要么通过引入外源基因(如SV40 T抗原)诱导永生化,要么对已建立的永生化细胞系进行静态表征,缺乏对细胞从“有限寿命”向“完全永生化”转变过程中,p53/Rb通路动态变化及功能的追踪研究。
本研究针对这一空白,以SC-2细胞系为模型,全程追踪其从原代CEF经危机期(passage 18-33)、有限寿命扩展(passage 33-80)到完全永生化(passage 80后)的转变过程,重点探究p53差异表达在这一过程中的作用,为理解鸟类细胞自发永生化的分子机制提供动态视角。
2. 文献综述解析
作者围绕“细胞永生化的分子调控”核心,将现有研究分为p53通路、Rb通路及端粒调控三大维度,系统评述各通路的作用及局限性,并明确本研究的创新方向——动态追踪自发永生化过程中p53/Rb通路的变化。
现有研究中,p53被公认为“基因组守护者”,其突变或功能失活是多数哺乳动物细胞永生化的关键;Rb通路通过p16INK4a(鸟类中为p15INK4b)抑制CDK4/6活性,维持Rb的低磷酸化状态,p16的失活常与永生化相关;端粒酶激活是哺乳动物细胞永生化的经典机制,但鸟类细胞永生化时常检测不到端粒酶活性,端粒长度维持的替代机制尚未明确。现有研究的局限性在于:一是多采用外源基因诱导永生化,无法反映自发过程的真实机制;二是多对已建立的永生化细胞系进行“终点”表征,缺乏对“转变过程”的动态分析。
本研究的创新点在于:首次以自发永生化的SC-2细胞为模型,追踪其从“有限寿命”到“完全永生化”的整个转变过程,系统分析p53/Rb通路基因的动态表达及功能变化,揭示p53先下调后上调但功能失活、p21持续下调在永生化中的关键作用,弥补了现有研究对“过程机制”解析的不足。
3. 研究思路总结与详细解析
本研究的整体思路为“建立模型-表征表型-解析通路-验证功能”:首先建立SC-2自发永生化细胞系并表征其生长、形态及细胞周期表型;随后通过RT-PCR、Western blot等技术解析p53/Rb通路基因的动态表达;再通过CHX处理、报告基因实验验证p53的功能状态;最后探究端粒调控与永生化的关联。
3.1 细胞系建立与生长/形态学分析
实验目的:建立SC-2自发永生化细胞系,表征其不同永生化阶段的生长速率与形态变化。
方法细节:从原代CEF(passage 4解冻)开始传代,每2-3天换液,80%汇合时传代,计算population doublings per day(pd/d);通过光镜观察不同passage(43、95)SC-2细胞及原代CEF(passage 6)、衰老CEF(passage 18)、永生化DF-1细胞(passage 280)的形态;通过FACS分析细胞周期分布(propidium iodide染色)。
结果解读:原代CEF在passage 18进入危机期,生长速率几乎停滞,直至passage 33出现能持续生长的亚群(即SC-2细胞);passage 33-80的SC-2细胞生长缓慢(0.12 pd/d),形态扁平、肥大;passage 80后形态变为小而紧凑(类似DF-1细胞),生长速率升至0.60 pd/d(图1);FACS分析显示,SC-2细胞(passage 95)的G1期比例(48%)介于原代CEF(65%)与DF-1细胞(30%)之间,表明细胞周期进程加快。
产品关联:细胞培养所用DMEM、FCS、青霉素-链霉素等试剂均来自Invitrogen;FACS分析用Becton Dickinson的Cell Quest软件;形态观察用普通光学显微镜(文献未提及具体品牌)。
3.2 p53通路基因表达与功能分析
实验目的:检测SC-2细胞不同永生化阶段p53及下游靶基因的表达变化,验证p53的功能状态。
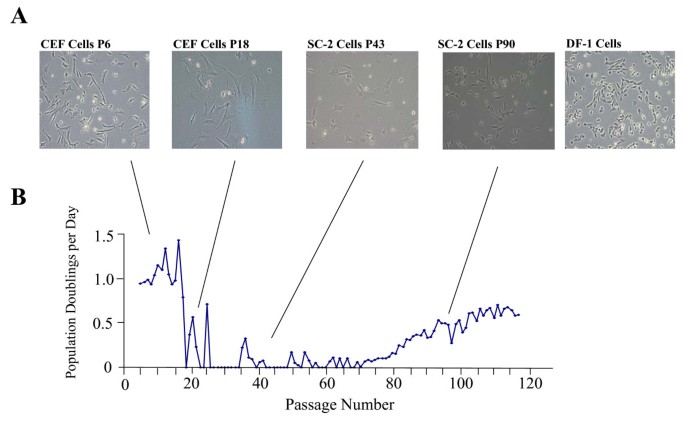
方法细节:通过RT-PCR检测不同passage(43、95)SC-2细胞、原代CEF(passage 6)、衰老CEF(passage 18)的p53、MDM2、p21WAF1、p27Kip1、p57Kip2 mRNA水平(以GAPDH为内参);通过Western blot检测p53蛋白水平(用Santa Cruz的p53抗体SC-99);用蛋白合成抑制剂CHX(Sigma,10 μg/ml处理4 h)处理细胞,检测p53 mRNA的调控机制;通过p53-luciferase报告基因实验验证p53的转录活性(将p53 consensus binding sequence插入pGL3载体,转染后检测luciferase活性)。
结果解读:RT-PCR显示,passage 43 SC-2细胞的p53 mRNA水平极低(几乎检测不到),passage 95则升高至与衰老CEF相当,但Western blot显示p53蛋白水平仅轻微降低;报告基因实验显示,passage 95 SC-2细胞的p53转录活性比原代CEF低2.8倍(n=3,P<0.05),表明p53功能失活;p21WAF1 mRNA在所有SC-2 passages均显著下调(比原代CEF低约50%,n=3,P<0.05);CHX处理后,passage 43 SC-2和DF-1细胞的p53 mRNA水平分别升高5倍和2.5倍,表明这些细胞中存在翻译依赖性的p53抑制元件,而passage 95 SC-2细胞因p53 mRNA已升高,CHX无显著作用(图3)。
产品关联:RT-PCR用Invitrogen的Superscript II反转录酶、Intergen的TaKaRa Ex Taq酶;Western blot用Bio-Rad的4%-20%梯度胶、Santa Cruz的p53抗体;报告基因实验用Promega的pGL3载体和Luciferase Assay System。
3.3 Rb通路基因表达分析
实验目的:探究Rb通路基因在SC-2细胞永生化中的动态变化。
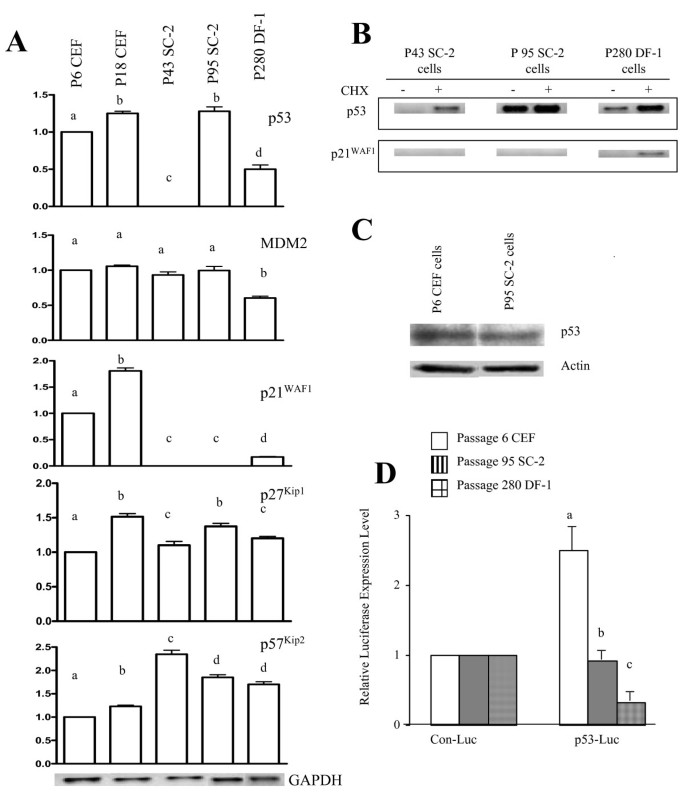
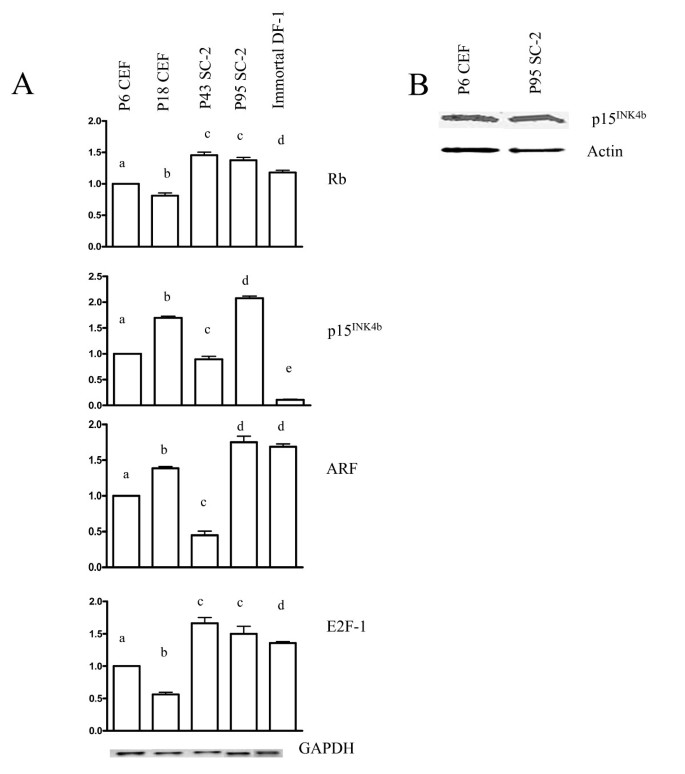
方法细节:通过RT-PCR检测不同passage SC-2细胞、原代CEF、DF-1细胞的Rb、p15INK4b、ARF、E2F-1 mRNA水平;通过Western blot检测p15INK4b蛋白(抗体由Gordon Peters馈赠)。
结果解读:RT-PCR显示,所有passage的SC-2细胞Rb mRNA水平均比原代CEF高约40%(n=3,P<0.05);passage 95 SC-2细胞的p15INK4b mRNA和蛋白水平均比原代CEF高30%(n=3,P<0.05);ARF mRNA在衰老CEF中升高,在passage 43 SC-2中降低,passage 95则恢复至原代水平;E2F-1 mRNA在永生化的SC-2和DF-1细胞中均升高(图4)。
产品关联:p15INK4b抗体来自Gordon Peters馈赠;其他试剂同3.2。
3.4 端粒调控与永生化关联分析
实验目的:检测SC-2细胞永生化过程中的端粒酶活性及端粒长度变化。
方法细节:通过TRAP法检测端粒酶活性;通过Southern blot检测端粒长度;通过RT-PCR检测端粒相关基因TRF2的mRNA水平。
结果解读:TRAP法未检测到SC-2和DF-1细胞的端粒酶活性,但端粒长度在所有passage均未缩短;RT-PCR显示,passage 95 SC-2细胞的TRF2 mRNA水平升高,推测TRF2参与端粒长度维持。
产品关联:TRAP试剂盒及端粒长度检测试剂未提及,领域常规使用TRAPeze Telomerase Detection Kit(Millipore)检测端粒酶活性,Southern blot用端粒探针(如TTAGGG重复序列)。
4. Biomarker 研究及发现成果解析
本研究涉及的Biomarker为p53、p21WAF1和p15INK4b,均为p53/Rb通路的关键调控因子,筛选逻辑基于“通路核心基因-动态表达验证-功能关联”的链条——先选择p53/Rb通路的核心基因,再通过不同passage细胞的动态检测验证其表达变化,最后关联其功能状态与永生化表型。
Biomarker 定位与研究过程
- p53:p53通路的核心转录因子,来源为细胞裂解液,验证方法为RT-PCR(mRNA)、Western blot(蛋白)和报告基因实验(转录活性)。结果显示:passage 43 SC-2细胞p53 mRNA极低,passage 95升高至与衰老CEF相当,但报告基因实验显示其转录活性比原代CEF低2.8倍(n=3,P<0.05),表明p53功能失活。
- p21WAF1:p53的直接靶基因,来源为细胞RNA,验证方法为RT-PCR。结果显示:所有SC-2 passages的p21 mRNA均显著低于原代CEF(n=3,P<0.05)。
- p15INK4b:Rb通路的关键抑制剂(鸟类中替代p16INK4a),来源为细胞RNA和裂解液,验证方法为RT-PCR和Western blot。结果显示:passage 95 SC-2细胞的p15 mRNA和蛋白水平均比原代CEF高30%(n=3,P<0.05)。
核心成果提炼
- p53的动态变化是永生化的关键:passage 43的p53下调帮助细胞绕过危机期(避免p53介导的周期停滞),passage 95的p53上调但功能失活(无法激活p21等靶基因)则允许细胞持续增殖。
- p21持续下调是永生化的必要条件:即使passage 95 p53 mRNA升高,p21的低表达仍能解除G1/S期停滞,支持细胞无限增殖。
- p15INK4b的升高未抑制永生化:passage 95 p15 mRNA和蛋白升高,但细胞仍保持高生长速率,推测p15可能存在功能失活(如翻译后修饰),无法有效抑制Rb通路。
这些成果首次揭示了鸟类细胞自发永生化过程中,p53通路的“动态失调”模式——从“表达下调”到“表达恢复但功能失活”,为理解鸟类细胞永生化的独特机制提供了新线索。
