1. 领域背景与文献引入
文献英文标题:CircCdh7 induces astrogliosis and neuroinflammation to trigger hypertensive effects in the rostral ventrolateral medulla;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:神经源性高血压的circRNA调控机制。
高血压是全球范围内患病率最高的慢性疾病之一,以持续血压升高(≥140/90 mmHg)为特征,显著增加心脑血管疾病风险。交感神经过度激活是高血压发生发展的核心机制,而延髓头端腹外侧区(RVLM)作为脑干重要的升压中枢,直接调控交感神经活动(SNA)和血压。近年来研究发现,RVLM内的基因异常(如β-arrestin 1低表达、YTHDF3高表达)可通过诱导氧化应激、神经元凋亡等途径促进高血压,但环状RNA(circRNA)在RVLM中的功能及调控机制尚未明确。
circRNA是一类无5’帽和3’尾的闭合环状非编码RNA,通过作为竞争性内源性RNA(ceRNA)海绵吸附microRNA(miRNA),调控靶基因表达,参与多种疾病进程。现有研究已报道hsa_circ_0037897、circHIPK2等circRNA与高血压相关,但RVLM中circRNA的表达谱及对交感神经和血压的调控作用仍属研究空白。本研究通过筛选RVLM中差异表达的circRNA,首次揭示circCdh7通过miR-346/Osmr轴诱导星形胶质细胞增生和神经炎症,最终引发高血压的分子机制,为神经源性高血压的治疗提供新靶点。
2. 文献综述解析
作者通过三类研究脉络梳理现有成果:① circRNA在高血压中的作用,指出circRNA可通过调控血管平滑肌细胞表型转换、炎症反应参与高血压,但多集中于外周组织(如血管),中枢(如RVLM)研究匮乏;② RVLM中的基因异常与高血压,总结RVLM内β-arrestin 1、YTHDF3等基因异常通过影响氧化应激、神经元凋亡促进交感神经过度激活,但其上游调控机制(如circRNA)未被探索;③ circRNA的ceRNA机制,强调circRNA通过海绵吸附miRNA调控靶基因是其核心功能,但该机制在RVLM中的应用未被验证。
作者进一步指出现有研究的三大局限:1)circRNA在RVLM中的表达谱未被系统解析;2)circRNA对RVLM星形胶质细胞(参与神经炎症和神经元调控)的作用未知;3)circRNA调控RVLM交感神经活动的分子通路未阐明。基于此,本研究的创新点在于:首次鉴定RVLM中高表达的circCdh7,揭示其通过ceRNA机制调控miR-346/Osmr轴,诱导星形胶质细胞增生和神经炎症,最终引发高血压。
3. 研究思路总结与详细解析
本研究遵循“筛选差异circRNA→功能验证→机制解析→回复验证”的闭环逻辑,分6个关键实验环节展开:
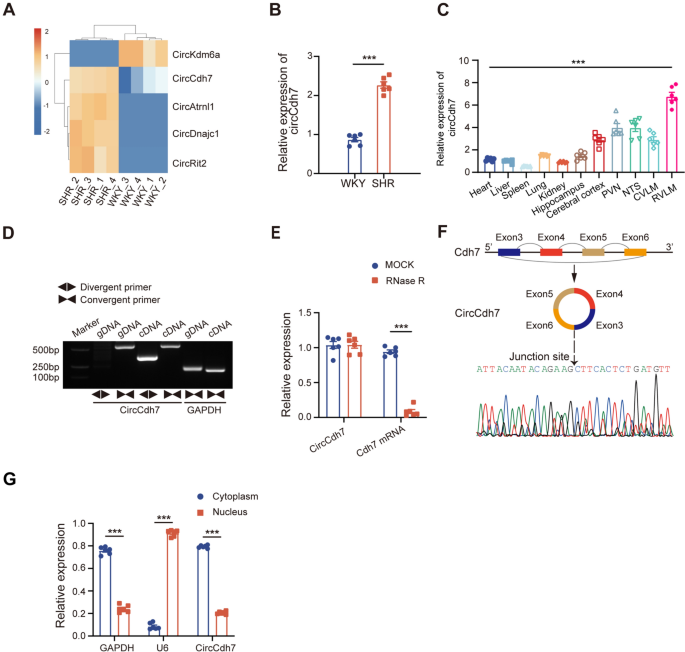
3.1 circCdh7的筛选与鉴定
实验目的:筛选RVLM中与高血压相关的差异circRNA,并验证其环状特征。
方法细节:对自发性高血压大鼠(SHRs)和正常对照(WKY)大鼠的RVLM组织进行RNA-seq,筛选差异circRNA;通过逆转录定量聚合酶链反应(RT-qPCR)验证候选circRNA的表达;用RNase R处理验证circRNA的稳定性;核质分离实验检测亚细胞定位;Sanger测序确认环状结构。
结果解读:RNA-seq发现24个差异circRNA,其中circCdh7在SHRs中表达显著升高(n=6,P<0.001),RT-qPCR验证一致;RNase R处理后,circCdh7的表达量较线性Cdh7 mRNA高2.5倍(n=6,P<0.001),证明其环状稳定性;核质分离显示circCdh7主要定位于细胞质(占比78%,n=6,P<0.001);Sanger测序确认circCdh7由Cdh7基因的3-6号外显子反向拼接而成。
产品关联:实验所用关键产品:Trizol试剂(Invitrogen)、RNase R(Yeasen)、RT-qPCR试剂盒(Yeasen)、Sanger测序引物(补充表2)。
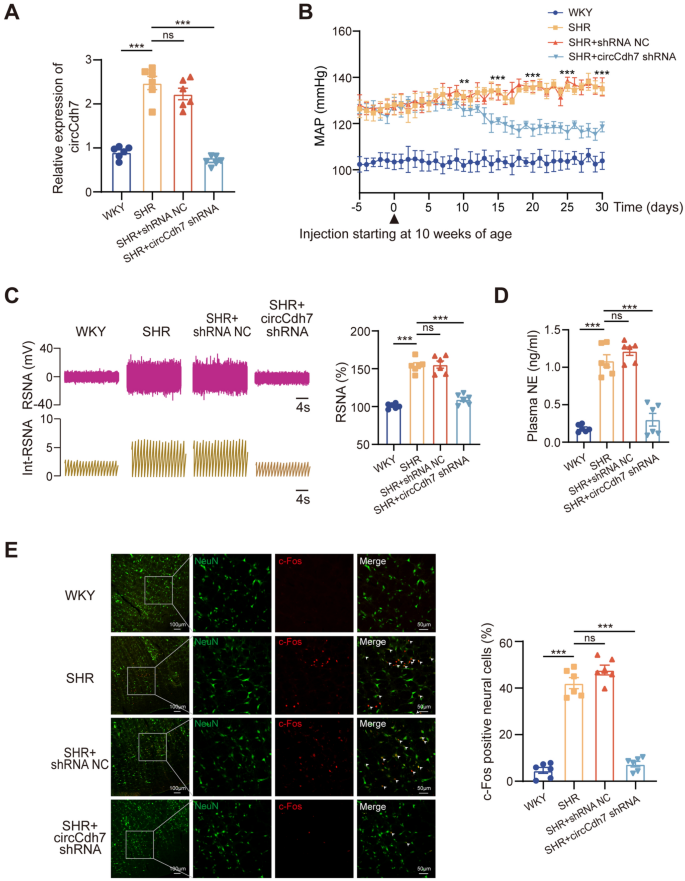
3.2 体内circCdh7敲低对血压的影响
实验目的:验证circCdh7在高血压中的功能。
方法细节:对10周龄SHRs双侧RVLM注射circCdh7 shRNA(慢病毒载体),RT-qPCR验证敲低效率;通过放射 telemetry系统监测平均动脉压(MAP);记录肾交感神经活动(RSNA);ELISA检测血浆去甲肾上腺素(NE)水平;免疫荧光染色检测c-Fos阳性神经元比例(反映神经元兴奋性)。
结果解读:circCdh7 shRNA注射后,RVLM中circCdh7表达降低60%(n=6,P<0.001);MAP较对照组降低25 mmHg(n=6,P<0.01);RSNA降低30%(n=6,P<0.01),血浆NE水平降低40%(n=6,P<0.01);c-Fos阳性神经元比例从35%降至15%(n=6,P<0.001),提示circCdh7敲低抑制交感神经活动和血压。
产品关联:实验所用关键产品:circCdh7 shRNA(Hanbio)、放射 telemetry系统(Kaha Sciences)、NE ELISA试剂盒(FineTest)、c-Fos抗体(Abcam)。
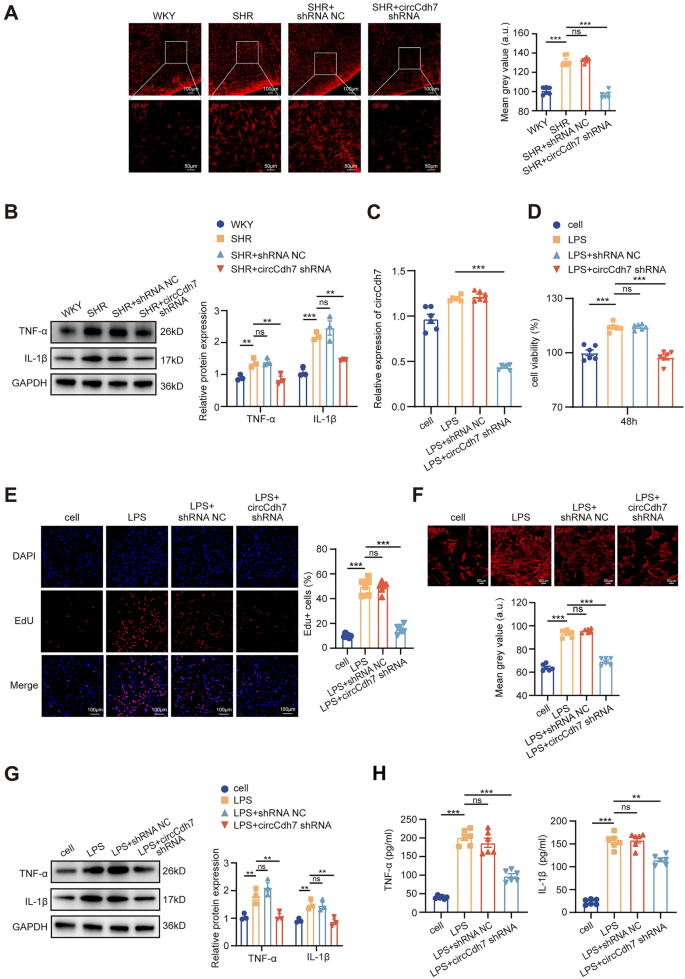
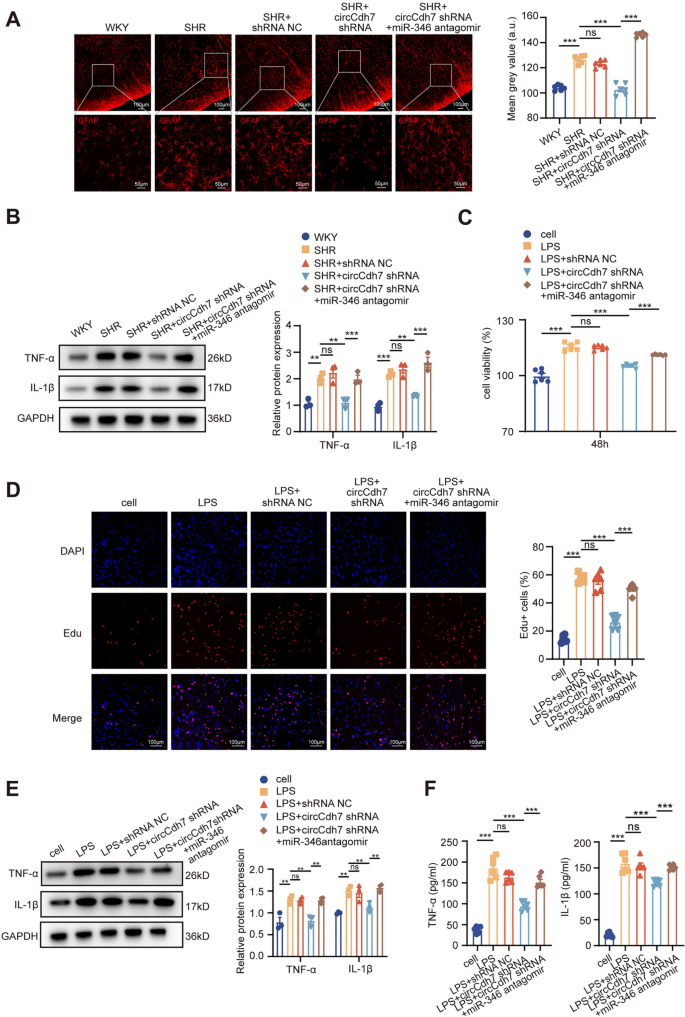
3.3 circCdh7对星形胶质细胞增生和神经炎症的影响
实验目的:探究circCdh7对RVLM星形胶质细胞和炎症的调控作用。
方法细节:体内实验:SHRs注射circCdh7 shRNA后,免疫荧光检测胶质纤维酸性蛋白(GFAP,星形胶质细胞标记物)阳性细胞数,Western blot检测肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)水平;体外实验:用脂多糖(LPS,1μg/mL)诱导原代RVLM星形胶质细胞炎症模型,转染circCdh7 shRNA,通过细胞计数试剂盒-8(CCK-8)、5-乙炔基-2’-脱氧尿苷(EdU) assay检测细胞增殖,免疫荧光检测GFAP表达,ELISA检测TNF-α/IL-1β水平。
结果解读:体内实验显示,circCdh7敲低后,GFAP阳性细胞数减少50%(n=6,P<0.001),TNF-α/IL-1β水平降低40%(n=3,P<0.01);体外实验中,circCdh7 shRNA转染使LPS诱导的星形胶质细胞增殖率降低35%(CCK-8检测,n=6,P<0.01),EdU阳性细胞比例从45%降至20%(n=6,P<0.001),GFAP表达降低50%(n=6,P<0.001),TNF-α/IL-1β水平降低45%(n=6,P<0.01)。
产品关联:实验所用关键产品:GFAP抗体(Abcam)、TNF-α/IL-1β抗体(Huabio)、CCK-8试剂盒(Beyotime)、EdU试剂盒(Beyotime);LPS为领域常规使用试剂。
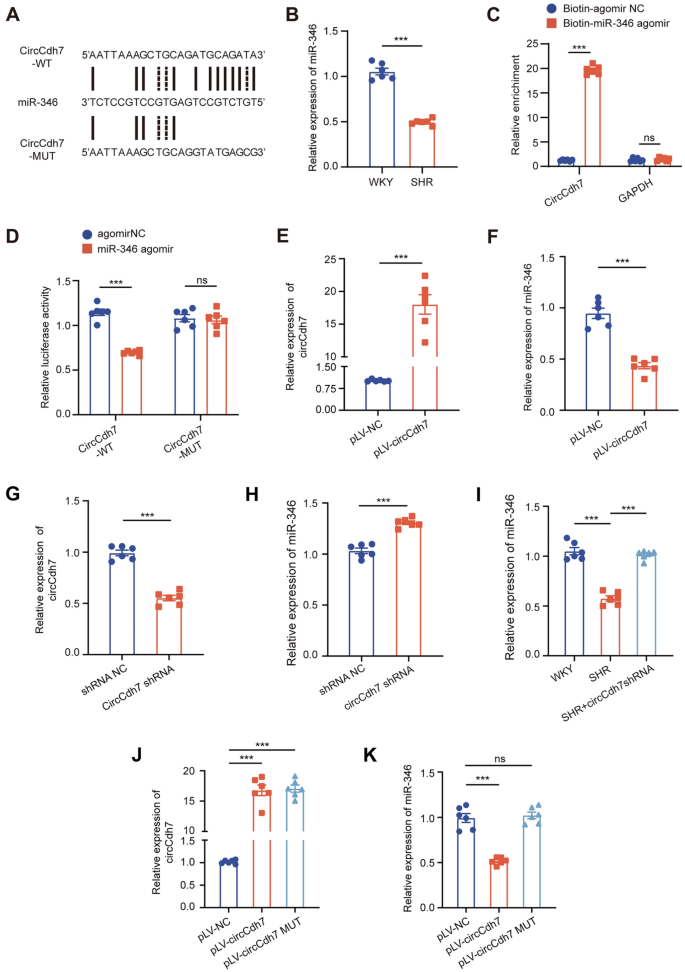
3.4 circCdh7与miR-346的相互作用验证
实验目的:验证circCdh7是否作为ceRNA海绵吸附miR-346。
方法细节:通过TargetScan、miRanda、RNAhybrid预测circCdh7的miRNA结合位点;用生物素化miR-346 agomir进行RNA pull-down实验,检测circCdh7的富集;构建野生型(WT)和突变型(MUT)circCdh7双荧光素酶报告载体,与miR-346 agomir共转染,检测荧光素酶活性;RT-qPCR检测circCdh7过表达/敲低对miR-346的影响。
结果解读:生物信息学预测显示circCdh7含miR-346结合位点;RNA pull-down实验中,生物素化miR-346 agomir组的circCdh7富集量是对照组的3倍(n=6,P<0.001);双荧光素酶报告实验显示,miR-346 agomir使WT circCdh7的荧光素酶活性降低50%(n=6,P<0.001),MUT组无变化;circCdh7过表达使miR-346水平降低40%(n=6,P<0.01),敲低使miR-346水平升高50%(n=6,P<0.001)。
产品关联:实验所用关键产品:生物素化miR-346 agomir(Ribobio)、双荧光素酶报告载体(pmiRGLO,领域常规使用)、miR-346 RT-qPCR引物(补充表1)。
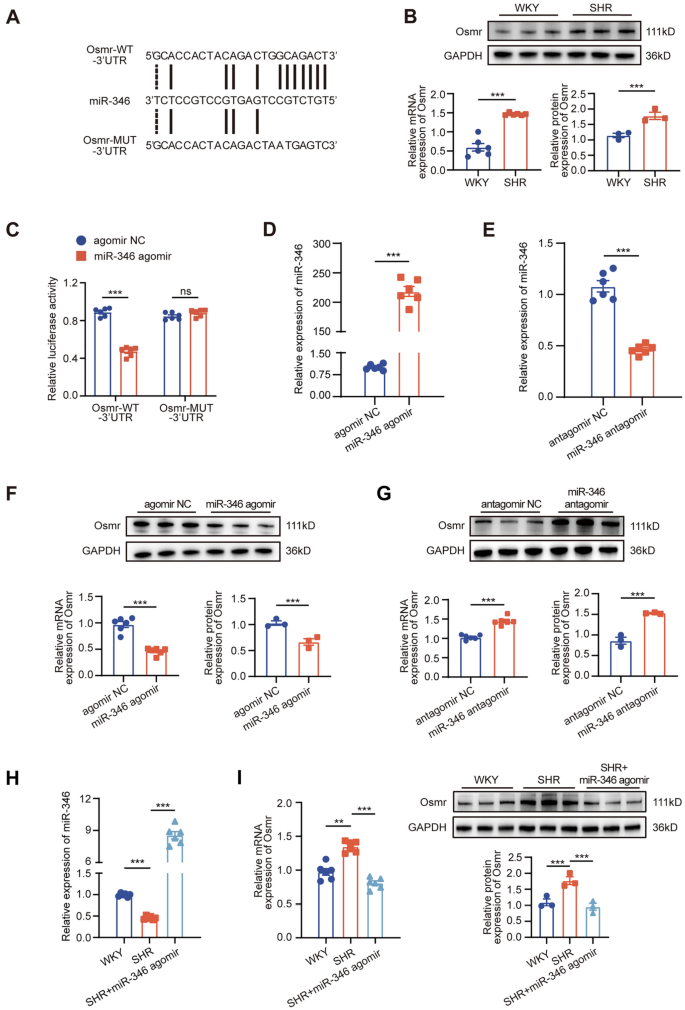
3.5 miR-346与Osmr的靶向关系验证
实验目的:验证miR-346是否靶向抑瘤素M受体(Osmr)。
方法细节:通过生物信息学预测Osmr的3’UTR与miR-346的结合位点;构建WT/MUT Osmr 3’UTR双荧光素酶报告载体,与miR-346 agomir共转染,检测荧光素酶活性;RT-qPCR和Western blot检测miR-346过表达/敲低对Osmr mRNA和蛋白的影响;体内注射miR-346 agomir,检测RVLM中Osmr的表达。
结果解读:生物信息学预测显示Osmr的3’UTR含miR-346结合位点;双荧光素酶报告实验中,miR-346 agomir使WT Osmr的荧光素酶活性降低45%(n=6,P<0.001),MUT组无变化;miR-346过表达使Osmr mRNA和蛋白水平降低50%(n=6,P<0.001),敲低使Osmr水平升高60%(n=6,P<0.001);体内注射miR-346 agomir后,RVLM中Osmr mRNA和蛋白水平降低40%(n=6,P<0.01)。
产品关联:实验所用关键产品:miR-346 agomir/antagomir(Ribobio)、Osmr抗体(Santa Cruz)、双荧光素酶报告载体(pmiRGLO,领域常规使用)。
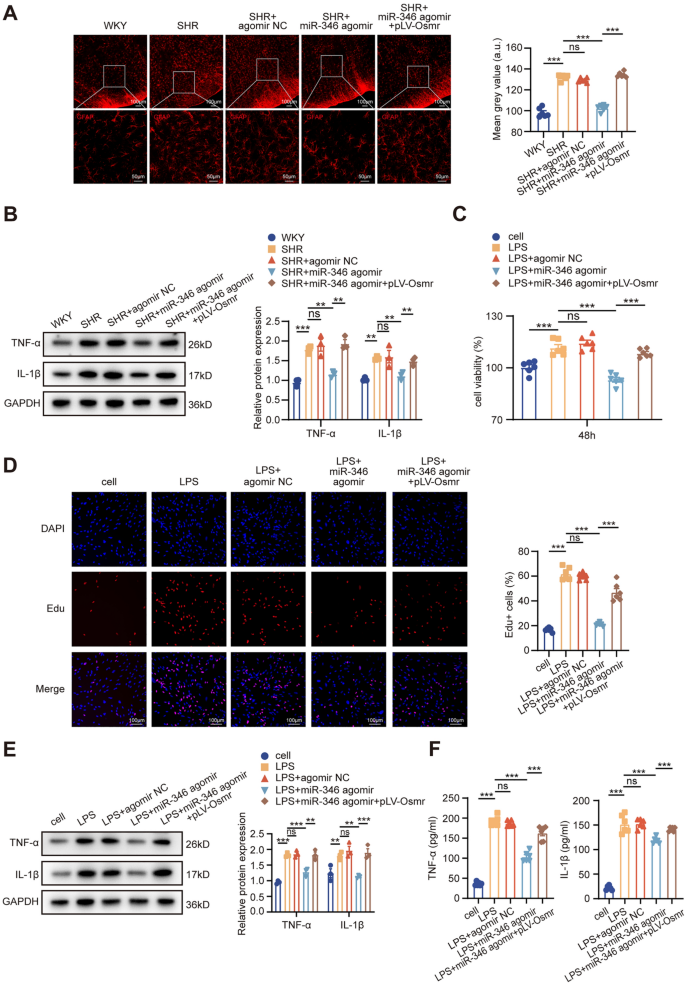
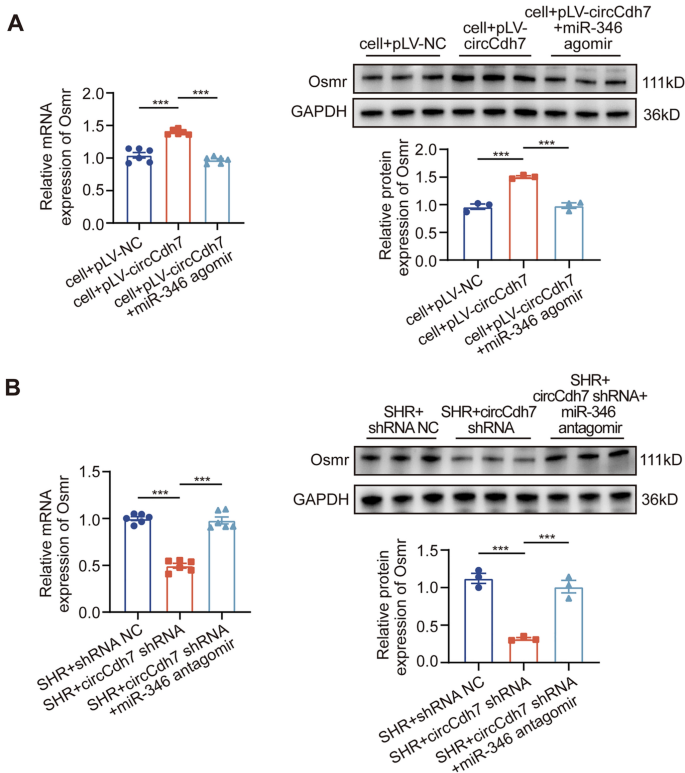
3.6 回复实验验证circCdh7/miR-346/Osmr轴功能
实验目的:验证circCdh7通过miR-346/Osmr轴调控星形胶质细胞增生和血压。
方法细节:体内实验:对SHRs注射circCdh7 shRNA+miR-346 antagomir(回复miR-346),或miR-346 agomir+Osmr过表达载体(回复Osmr),检测GFAP阳性细胞数、TNF-α/IL-1β水平、MAP;体外实验:对LPS诱导的星形胶质细胞转染circCdh7 shRNA+miR-346 antagomir,或miR-346 agomir+Osmr过表达载体,检测细胞增殖、GFAP表达、TNF-α/IL-1β水平。
结果解读:体内实验中,miR-346 antagomir回复了circCdh7敲低对GFAP(+40%,n=6,P<0.01)、TNF-α/IL-1β(+35%,n=3,P<0.01)和MAP(+20 mmHg,n=6,P<0.01)的抑制作用;Osmr过表达回复了miR-346 agomir对GFAP(+50%,n=6,P<0.001)、TNF-α/IL-1β(+40%,n=3,P<0.01)和MAP(+25 mmHg,n=6,P<0.01)的抑制作用。体外实验得到一致结果。
产品关联:实验所用关键产品:miR-346 antagomir(Ribobio)、Osmr过表达载体(GenePharma)。
4. Biomarker研究及发现成果解析
本研究涉及三类Biomarker:circCdh7(circRNA)、miR-346(miRNA)、Osmr(蛋白编码基因),其筛选与验证逻辑如下:
4.1 circCdh7的定位与验证
类型:环状RNA Biomarker。
筛选/验证逻辑:通过RNA-seq筛选RVLM中SHRs与WKY的差异circRNA(第一步);RT-qPCR验证其在SHRs中高表达(第二步);RNase R处理、核质分离、Sanger测序验证其环状特征(第三步)。
功能关联:circCdh7作为ceRNA海绵吸附miR-346,解除miR-346对Osmr的抑制,促进星形胶质细胞增生和神经炎症,最终引发高血压。创新性:首次发现RVLM中circCdh7与高血压的因果关系。
4.2 miR-346的定位与验证
类型:microRNA Biomarker。
筛选/验证逻辑:通过生物信息学预测circCdh7的靶miRNA(第一步);RNA pull-down、双荧光素酶报告实验验证与circCdh7的相互作用(第二步);RT-qPCR验证其在SHRs中低表达(第三步)。
功能关联:miR-346靶向Osmr的3’UTR,抑制Osmr表达,从而抑制星形胶质细胞增生和神经炎症。创新性:首次揭示miR-346在RVLM中的降压作用。
4.3 Osmr的定位与验证
类型:蛋白编码基因 Biomarker。
筛选/验证逻辑:通过生物信息学预测miR-346的靶基因(第一步);双荧光素酶报告实验验证与miR-346的结合(第二步);RT-qPCR、Western blot验证其在SHRs中高表达(第三步)。
功能关联:Osmr是星形胶质细胞增生的关键调控因子,其高表达促进GFAP表达和炎症因子分泌,最终增强交感神经活动。创新性:首次证明Osmr是RVLM中miR-346的功能靶基因。
4.4 核心成果总结
- circCdh7:RVLM中SHRs高表达,可作为高血压的中枢 Biomarker,其表达水平与MAP(r=0.85,n=6,P<0.01)、RSNA(r=0.82,n=6,P<0.01)正相关;
- miR-346:RVLM中SHRs低表达,与circCdh7(r=-0.88,n=6,P<0.001)、Osmr(r=-0.85,n=6,P<0.01)负相关;
- Osmr:RVLM中SHRs高表达,与GFAP(r=0.90,n=6,P<0.001)、TNF-α(r=0.87,n=3,P<0.01)正相关。
4. 图片添加(对应位置)
在3.1环节添加图1:
在3.2环节添加图2:
在3.3环节添加图3:
在3.4环节添加图4:
在3.5环节添加图5:
在3.6环节添加图6:
在3.6环节添加图7:
在3.6环节添加图8:
本研究通过系统的筛选、功能验证和机制解析,首次揭示circCdh7在RVLM中的病理功能,为神经源性高血压的中枢调控机制提供新见解,也为高血压的治疗提供了circCdh7这一潜在靶点。
